异黄腐酚与顺铂联合用药对肺癌顺铂耐药A549/DDP细胞的协同抑制作用
郭亚楠,郭红云,王 涛,张永东,郭文静,蒋 兵,苏海翔
(1.甘肃省医学科学研究院,甘肃省肿瘤医院,甘肃 兰州 730050;2.甘肃中医药大学基础医学院,甘肃 兰州 730000)
肺癌的病死率居癌症死因的首位[1],因其早期临床症状不明显,因此多数肺癌患者临床确诊时已到中晚期,从而失去了手术治疗机会。化疗是治疗肺癌的主要疗法之一[2],临床上肺癌的化疗以铂类药物为主,铂类中DDP是有效并广泛应用的一线用药,但是DDP治疗一段时间后,耐药性的出现往往导致药物失效和预后不良,尤其是非小细胞肺癌(non-small cell lung cancer,NSCLC)较容易对化疗药物产生耐药性[3],因此,寻找高效安全的多药耐药(multiple drug resistance,MDR)逆转剂是目前临床肺癌治疗的迫切需要。
异黄腐酚(isoxanthohunol,IN)作为一种异戊二烯基黄酮类物质[4],其主要存在于中药蛇麻花(humuluslupulus俗称:啤酒花)中,分子式C21H22O5,分子量354.4,其主要是黄腐酚(xanthohumol,XN)加热过程产生的一种同分异构体。在啤酒酿造的麦汁煮沸过程中,大部分XN被异构化为IN,因此啤酒中IN含量远高于XN[5]。体外实验研究报道,IN具有抗肿瘤[6]、抗炎[7]以及参与脂质代谢调节[8]等多种生物学功能。在国内外的食品、保健品、药品中受到广泛的关注。但目前关于IN联合DDP对人肺癌耐顺铂细胞株A549/DDP的作用及相关机制仍未有报道。本实验旨在观察IN联合DDP对A549/DDP细胞的增敏作用以及细胞周期、凋亡的影响,并探讨其分子机制,为中医药治疗NSCLC提供新的实验基础。
1 材料
1.1 细胞株人肺癌顺铂耐药株A549/DDP购自上海富衡生物科技有限公司。
1.2 药品与试剂异黄腐酚,玉门拓璞科技开发有限责任公司;顺铂规格:100 mg,批号:SC8452,齐鲁制药有限公司;DMEM培养基,美国Hyclone公司;10%胎牛血清,美国BI公司;100×青链霉素混合液规格:100 mL、CCK-8试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒,北京SoIarbio公司;细胞凋亡检测试剂盒,美国BD公司;羊抗兔P-gp、LRP、MRP、PI3K、p-AKt、GAPDH,美国Proteintech公司;化学发光显色液,美国Millipore公司。
1.3 仪器流式细胞仪(美国Becton Dickinson公司);凝胶成像系统、酶标仪(美国BIO-RAD公司);二氧化碳培养箱(德国BINDER公司);培养显微镜(日本OLYMPUS公司);台式低速离心机(上海精宏有限公司);双人单面超净工作台(苏州苏洁净化有限公司)。
2 方法
2.1 细胞培养人肺癌A549/DDP细胞培养于含10%胎牛血清的DMED培养液中,置37 ℃、5% CO2培养箱中培养。为了保持A569/DDP细胞的DDP耐药性,每次换液时在细胞培养液中均添加DDP(最终浓度为1 mg·L-1)。为了减少DDP对实验的干扰,在实验前更换成不加DDP的培养液。
2.2 A549/DDP细胞活性检测当A549/DDP细胞达到对数生长期时,将细胞以8×103个/孔接种于96孔板。待细胞贴壁后,加入不同浓度的IN、DDP,每组6个复孔,培养48 h后,加入10 μL CCK-8溶液,继续培养2 h,应用酶标仪测定各孔在450 nm波长处的吸光度值(A),计算各组细胞生长抑制率/%=1-(药物组A值/空白组A值)×100%。
2.3 药物协同作用Isobologram分析依据CCK-8的实验结果,得出不同浓度IN、DDP对A549/DDP细胞的IC50浓度,分别设为a和b,位于横坐标轴和纵坐标轴上,连接a、b两点的直线为相加线。同时根据CCK-8实验结果,求得不同浓度20 μmol·L-1IN与不同浓度DDP联用时的IC50浓度c,若d (20,c)点在a b连线上,则表示两药联用为相加作用,在该连线以下,表示两药联用为协同作用;在该连线以上,表示两药联用为拮抗作用[9-10]。
2.4 细胞凋亡检测当A549/DDP细胞达到对数生长期时,将细胞以1×106个/孔接种于6孔板。待细胞贴壁后,分别加入IN组、DDP组和IN与DDP联合用药组,培养48 h后,加入1 mL的胰酶消化后收集细胞,用预冷的PBS洗2次,根据试剂盒说明书操作,加入500 μL Binding buffer,5 μL Annexin V-FITC和PI溶液,避光反应20 min,滤膜过滤至流式管中用流式细胞仪检测。
2.5 细胞周期检测当A549/DDP细胞达到对数生长期时,将细胞以1×106个/孔接种于6孔板。待细胞贴壁后,按照2.4上述各组药物配置,分别加入到6孔板中,培养48 h后,收集细胞,用PBS洗涤2次,离心,每组样品用100 μL预冷的PBS重悬,然后再加入300 μL预冷的乙醇,轻轻混匀以后,放入-20 ℃冰箱过夜,次日,取出固定的细胞,弃上清,并用预冷的PBS清洗3次,然后按照细胞周期试剂盒说明书操作,加入500 μL的PI-RNase染液混匀,室温避光孵育20 min,滤膜过滤至流式管中用流式细胞仪检测。
2.6 细胞内相关蛋白变化检测细胞培养和分组处理同2.4。培养48 h后,收集细胞,用预冷的PBS洗涤细胞,每孔加入细胞裂解液,12 000 r·min-1离心20 min,用蛋白定量试剂盒定量,随后加入5×蛋白上样缓冲液置于90 ℃水浴锅中煮沸10 min。15%的聚丙烯酰胺SDS凝胶电泳后,将PVDF膜封闭于5%的脱脂奶粉中,且在室温条件下封闭2 h后依次加入一抗(稀释比1 ∶1 000),4℃孵育过夜后,用TBST洗膜3次,每次5 min;二抗封闭(稀释比1 ∶10 000),室温下孵育2 h,TBST洗膜3次,每次5 min,滴加ECL发光试剂于凝胶成像系统曝光。

3 结果
3.1 IN与DDP联用协同抑制A549/DDP细胞生长CCK-8实验结果见Fig1所示,IN浓度≤20 μmol·L-1时,作用于人肺癌耐顺铂细胞株A549/DDP细胞48 h后,细胞增殖率在90%以上,当浓度增加至30~80 μmol·L-1时,IN以浓度依赖性明显抑制A549/DDP细胞活性,差异具有统计学意义(P<0.05),IC50值为42.1 μmol·L-1。见Fig2结果所示,选择无明显细胞毒性的20 μmol·L-1IN与不同浓度的DDP联合给药48 h后,DDP对A549/DDP细胞的IC50从22.46 mg·L-1降为6.20 mg·L-1,并且发现与单独使用DDP组比较,≥6 mg·L-1DDP与20 μmol·L-1IN联用后,A549/DDP细胞的增殖率显著降低,差异有统计学意义(P<0.05)。同时,通过Isobologram分析见(Fig3),6 mg·L-1DDP与20 μmol·L-1IN联用对A549/DDP细胞的IC50坐标d (20,6.2)落在a (DDP IC50)和b (IN IC50)相加线左下方,再次证明了6 mg·L-1DDP与20 μmol·L-1IN联用对A549/DDP细胞可以产生协同作用。因此选择低浓度、低毒性的6 mg·L-1DDP与20 μmol·L-1IN联用进行后续实验研究。

Fig 1 Effect of combination of IN and DDP on proliferation of A549/DDP cells

Fig 2 Effect of DDP alone or in combination with IN on proliferation of A549/DDP cells
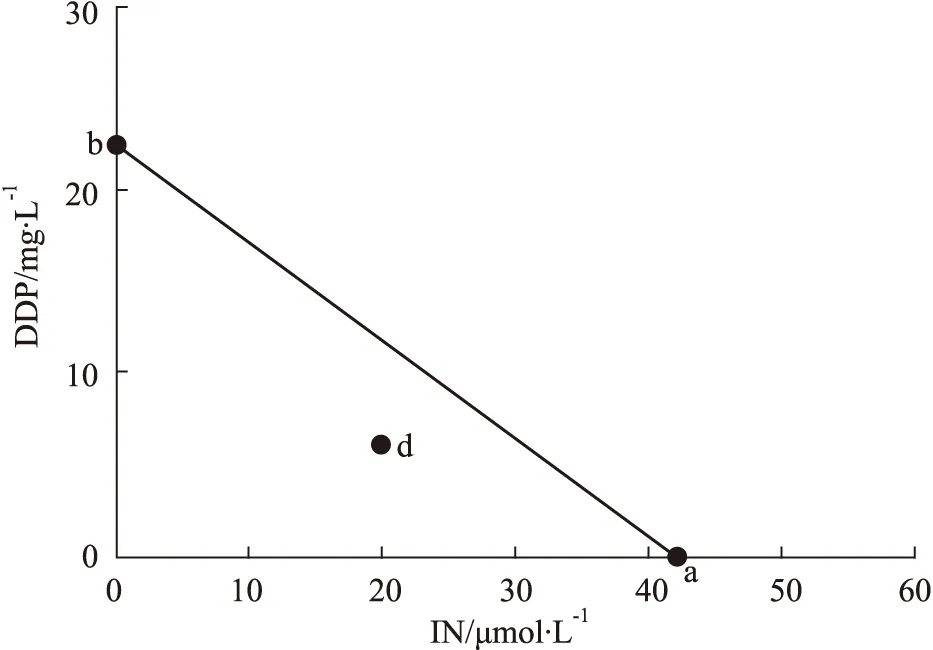
Fig 3 Synergism effect between IN and DDP analyzed with Isobolograma (42.1,0)and b (0,22.46)are the IC50 coordinates of IN and DDP to A549/DDP cells,respectively,d (20,6.20)are the IC50 coordinates of A549/DDP cells when 20 μmol·L-1 IN is combined with DDP.
3.2 IN与DDP联用诱导A549/DDP细胞凋亡空白组、DDP、IN和IN+DDP组作用A549/DDP细胞48 h后,各组细胞凋亡率分别为(12.29±0.78)%、(14.26±0.25)%、(17.92±0.65)%和(26.73±0.62)%,与空白组、IN组和DDP组比较,联合用药组细胞凋亡率明显升高,差异有统计学意义(P<0.01),见Fig4。

Fig 4 Effect of IN and combined DDP treatment on A549/DDP cell apoptosis**P<0.01 vs the blank group;##P<0.01 vs the other three groups.
3.3 IN与DDP联用阻滞A549/DDP细胞周期空白组、DDP、IN和IN+DDP组作用A549/DDP细胞48 h后,各组细胞中的G0/G1期DNA含量百分比平均值分别为28.20%、39.06%、59.25%和75.22%。与空白组、IN组和DDP组比较,联合用药组作用A549/DDP细胞后,G0/G1期细胞比例明显升高,细胞分裂周期停滞在G0/G1期的能力更强,差异有统计学意义(P<0.01)。见Fig5。

Fig 5 Cycle analysis of A549/DDP cells treated with IN combined with DDP
3.4 IN与DDP联用降低A549/DDP细胞中P-gp、LRP、MRP、PI3K和p-AKt蛋白表达水平空白组、DDP、IN和IN+DDP组作用A549/DDP细胞48 h后,与空白组、IN组和DDP组比较,联合用药组作用细胞中的P-gp、LRP、MRP蛋白表达水平明显降低,差异有统计学意义(P<0.01),见Fig6。同时,与空白组、IN组、DDP组3组比较,联合用药组对A549/DDP细胞中PI3K/AKT信号通路相关蛋白PI3K和p-AKt相对表达水平降低,差异有统计学意义(P<0.01),见Fig7。

Fig 6 Effect of IN combined with DDP on expression of drug resistance-related proteins in A549/DDP cells**P<0.01 vs the blank group;##P<0.01 vs the other three groups.

Fig 7 Effect of IN combined DDP on expression levels of PI3K and p-AKt in A549/DDP cells##P<0.01 vs with the other three groups.
4 讨论
DDP是治疗肺癌的标准化疗药物,但目前化疗耐药已成为提高肺癌患者整体生存率的关键制约因素之一[11]。临床上肺癌患者尤其是NSCLC较容易对化疗药物产生耐药性,对患者的预后造成极大的不良影响,因此,克服DDP耐药或者增加其对癌细胞的敏感性对于治疗NSCLC具有重要的意义。IN作为一种异戊二烯基黄酮类物质,因其有抗氧化、抑制癌细胞增殖、抗菌及免疫调节等多种生物活性。相关研究表明黄酮类物质与DDP联合给药可以减少DDP引起的毒副反应,增加DDP敏感性[12]。在本研究中,我们研究了IN与DDP联用对人肺癌耐DDP细胞株A549/DDP的协同作用,并探讨了其可能的相关机制。
首先,通过CCK-8实验发现IN呈浓度依赖性明显抑制A549/DDP细胞生长。IN和DDP单独使用在低浓度时对A549/DDP细胞增殖无明显抑制作用,但两药联合应用后则明显抑制A549/DDP细胞增殖,并通过Isobologram得出结果,发现低浓度的IN与DDP联用具有协同作用。通过流式细胞仪实验检测IN与DDP两药联用对A549/DDP细胞凋亡的作用,实验结果表明IN与DDP两药联用后促进A549/DDP细胞凋亡的能力更强,阻滞A549/DDP细胞G0/G1期的能力更明显。
肿瘤的多药耐药是多基因多途径多系统广泛参与的复杂过程,机制至今尚未完全清楚,目前常见的主要包括P-gp、MRP和LRP等,LRP、MRP、P-gp介导的药物外排机制已经被认为是最经典以及耐药效应最明确的肿瘤MDR机制。LRP、MRP、P-gp蛋白是一种依赖ATP供能、具有药物外排功能的跨膜糖蛋白,是研究的最早也是最深入的耐药相关蛋白。LRP、MRP和P-gp作为一种具有外排作用的转运体,降低了细胞内化疗药物的浓度和使药物远离鞭点等方式影响肿瘤的凋亡而逆转MDR[13],相关研究表明,LRP、MRP、P-gp在肺癌耐药中表达率很高,LRP、MRP、P-gp的高表达是肺癌多药耐药发生的主要机制[14]。研究表明,黄酮类化合物藤黄酸和DDP共同处理A549/DDP细胞后,可明显下调细胞P-gp蛋白的表达,从而表明藤黄酸和DDP联用发挥协同作用抑制P-gp的表达可使A549/DDP细胞对DDP的敏感增加[15]。本研究结果表明,IN和DDP联用较空白组和单独用药组明显降低LRP、MRP、P-gp蛋白表达水平,提示联用可协同抑制人肺腺癌耐DDP细胞株A549/DDP的生长。
PI3K/Akt信号通路是细胞生存重要通路之一,PI3K/AKT通道的激活是肿瘤细胞对化疗药物如DDP、紫杉醇等产生耐药的关键因素,在肿瘤MDR方面,很多研究都证实PI3K/AKT信号参与MDR的形成[16]。肺癌的多种生长因子主要通过PI3K/AKT信号转导通路而发挥作用,肿瘤细胞经化疗药物作用后增加了AKT磷酸化水平,并激活PI3K/AKT信号通路,活化的AKT进一步激活其下游因子使癌细胞对化疗药物产生耐药性。研究表明,黄酮类化合物水飞蓟素与阿霉素联合给药可以增加耐药乳腺癌细胞MDA-MB-435和MCF-7细胞对阿霉素的敏感性,其机制可能与水飞蓟素和DDP联用发挥协同作用抑制PI3K、AKT和ERK等致癌信号通路分子有关[17]。本研究结果表明,IN和DDP联用较空白组和单独用药组明显降低PI3K和p-AKt蛋白表达水平,提示两药联用后可协同抑制PI3K/AKt信号通路的活性,从而增强DDP对耐药细胞的作用。
综上所述,IN与DDP联合用药可起到协同作用阻滞细胞于G0/G1期,促进细胞凋亡,抑制A549/DDP细胞增殖的作用,其可能的机制是通过抑制耐药蛋白LRP、MRP、P-gp蛋白表达以及抑制PI3K/AKt信号通路的活性,增强DDP对耐药细胞的作用,进而与DDP对A549/DDP细胞产生协同抗肿瘤作用,这为IN在未来具有作为治疗NSCLC的辅助药物或者DDP的化疗增敏剂的潜力提供了科学依据及理论基础。

