加味牛蒡子汤促进自发性类风湿关节炎小鼠淋巴管生成抑制炎症免疫反应
方 叶,王晓赟,尤佳锋,梁倩倩,3,4,郑为超
(1.安徽理工大学医学院,安徽 淮南 232001;2.上海中医药大学附属龙华医院,上海 200032;3.上海市中医药研究院脊柱病研究所,上海 200032;4.筋骨理论与治法教育部重点实验室,上海 200032)
类风湿关节炎(rheumatoid arthritis,RA)是一种有多种炎症性细胞因子浸润和大量免疫细胞参与的自身免疫性疾病,它表现为一个侵蚀性、破坏性的过程[1]。目前,临床上针对RA没有较好的根治方法和治疗药物,且疗效较佳的相关生物制剂价格昂贵,不良反应发生率高。因此,寻找到RA有效疗法和治疗药物是亟待解决的临床问题。
淋巴系统是沟通全身免疫调节的重要介质。淋巴管参与运送免疫细胞,承载营养物质,维持机体体液平衡[2]。淋巴管通过排出渗出液、抗原、炎症介质和抗原提呈细胞参与炎症反应的调节,淋巴管的重塑和扩张对炎症消退、组织愈合具有重要意义[3]。
中医认为RA属“痹症”,痹而不通,不通则痛[4]。炎症状态下,淋巴功能障碍与中医“痹症”理论不谋而合[5]。多年来,中药在缓解和改善RA临床症状方面取得了较好的效果[6]。加味牛蒡子汤是上海中医药大学施杞教授结合石氏伤科诊疗方法创制出的治疗痰瘀互结型RA的经典方。本项目组前期研究发现,加味牛蒡子汤能够弥补炎症状态下淋巴回流功能受损,改善关节周围体液微循环,减轻关节炎症[7]。但关于加味牛蒡子汤是否影响淋巴管的生成和分布以其对机体炎症免疫反应的药理作用尚不清楚。本文将从更加直观的角度探讨加味牛蒡子汤对炎症状态下淋巴管新生及机体免疫反应的药理效应。
1 材料
1.1 实验动物2只2月龄携带人类杂合子TNF-α基因的种鼠由希腊亚历山大弗莱明生物医学免疫学研究所的G.Kollias博士友好赠予,交与上海南方模式公司饲养繁育,与C57BL/6小鼠进行回交,保持所得动物为携带一个人类肿瘤坏死因子转基因副本的杂合子,动物生产许可证号:SCXK(沪)2017-0010。研究选用3月龄左右清洁级TNF-Tg♀小鼠作为RA模型,并另选相应同窝野生型C57BL/6小鼠进行对照。
1.2 药物与试剂
1.2.1中药 加味牛蒡子汤药物组成:炒牛蒡子9 g 僵蚕9 g 三七12 g 独活9 g 秦艽6 g 半夏9 g黄芪12 g。上述药物均购自上海中医药大学附属龙华医院中药房,将中药经煎提后制成含生药0.99 kg·L-1的水提物。
1.2.2试剂 福尔马林固定液(Wexis,5205000),苏木精(Hematoxylin,Sigma,H3136-25G)、阿尔新蓝(Alcian blue 8GX,Sigma,A5268)、伊红(Eosin Y,Sigma,E4009-5G)、荧光桃红B(Phloxine B,Sigma,P2759-25G)、橙黄G(Orange G,Sigma,O3756-25G)、硫酸铝铵(Sigma,A-2140)、碘酸钠(Sodium iodate,Sigma,S4007-100G),中性封片树胶(上海标本模型厂),抗原修复液(雷根生物,IH0310),牛血清白蛋白(BioFroxx,4240GR100),PBS(Medicago,09-2052-100),透膜剂(Triton®X-100,BioFroxx,1139ML100),抗TNF-α抗体(R&D Systems,AF-410-SP),抗F4/80抗体(Abcam,ab204266),抗iNOS抗体(Abcam,ab209027、ab3523),抗LYVE-1抗体(Abcam,ab14917),抗Podoplanin抗体(Abcam,ab11936),抗仓鼠二抗(Invitrogen,A21111),抗兔二抗(Cell signaling,#4412s),即用型免疫组化试剂盒(博士德生物,SA1022、SA1023),免疫荧光封片剂(Vector vectashield,H-1200)
1.3 仪器组织脱水机(LEICA,TP1020),石蜡包埋机(LEICA,EG1150C),切片机(LEICA,RM2135),展片机(LEICA,HI1210),Olympus全片扫描图像采集系统(OLMPUS,VS120-SL)。
2 方法
2.1 动物分组及给药将3月龄左右的10只TNF-Tg小鼠随机分成两组,每组5只,另取5只同窝野生型小鼠作为对照。小鼠适应性饲养1周后,给予RA模型组(生理盐水组)和对照组小鼠生理盐水灌胃,加味牛蒡子汤组给予加味牛蒡子汤药物灌服。根据标准小鼠(20 g)与人(70 kg)体质量比,中药剂量换算系数为9.01[4],按小鼠10 mL·kg-1·d-1灌胃给药,连续12周。
2.2 标本处理末次给药后,间隔24 h,处死小鼠,踝关节用10%福尔马林固定液固定过夜,置于14%的EDTA脱钙液中持续脱钙21 d,期间每72 h更换一次脱钙液。取出脱钙完成的踝关节,流水冲洗2 h,梯度脱水后,包埋,行4 μm厚度连续切片,备染。
2.3 ABOG染色石蜡切片脱蜡至水,阿尔新蓝-苏木精混合染液浸染1.5 h,盐酸乙醇分化,氨水返蓝,水洗,橙红染液浸染3 min,乙醇梯度脱水,二甲苯通透,中性树胶封片。VS120全片扫描仪(明场模式)观察蓝染的软骨、粉橙色骨组织以及蓝紫色的炎症浸润面积。
2.4 TNF-α、iNOS免疫组织化学染色石蜡切片脱蜡至水,组化笔画圈,胰蛋白酶37 ℃抗原修复10 min,流水冲洗,按免疫组化试剂盒操作,经双氧水去除内源性过氧化物酶15 min,正常山羊血清封闭1 h,一抗(TNF-α、iNOS)4 ℃避光孵育过夜,流水冲洗,PBS浸洗3次,生物素化二抗和SABC复合物各处理30min,DAB显色,水洗,苏木精染核,盐酸乙醇分化,氨水返蓝,梯度乙醇脱水,二甲苯通透,中性树胶封片。VS120全片扫描仪(明场模式)观察TNF-α、iNOS的表达。
2.5 M1型巨噬细胞免疫荧光染色石蜡切片脱蜡至水,组化笔画圈,胰蛋白酶37 ℃抗原修复10 min,水洗,37 ℃恒温箱内封闭1 h,一抗(F4/80和iNOS分别以1 ∶400和1 ∶200比例稀释)混合液4 ℃避光过夜,流水冲洗,PBS浸洗3次,荧光封片剂封片。VS120全片扫描仪(荧光模式)观察踝关节附近炎症性M1型巨噬细胞的分布情况。
2.6 淋巴管免疫荧光染色石蜡切片脱蜡至水,组化笔画圈,胰蛋白酶37 ℃抗原修复10 min,水洗,37 ℃恒温封闭1 h,一抗(LYVE-1和Podoplanin均以1 ∶500 比例稀释)一抗混合液4 ℃过夜,流水冲洗,PBS浸洗3次,抗兔和抗仓鼠二抗(1 ∶400比例稀释)混合液避光孵育1 h,流水冲洗,PBS浸洗3次,荧光封片剂封片。VS120全片扫描仪(荧光模式)观察淋巴管分布情况。

3 结果
3.1 加味牛蒡子汤对TNF-Tg小鼠骨与软骨侵蚀和炎症浸润的影响ABOG染色显示,与对照组小鼠相比,生理盐水组的TNF-Tg小鼠的距骨矢状面完整性严重破坏,边界模糊,骨髓腔丢失,骨和软骨侵蚀严重,蓝紫色的炎症浸润面积明显增加。加味牛蒡子汤治疗明显减少了TNF-Tg小鼠的炎症面积,踝关节距骨轮廓逐渐清晰,软骨结构开始恢复,连续性结构得以保存,骨量明显增加,软骨侵蚀明显改善,P<0.01,(Fig1)。
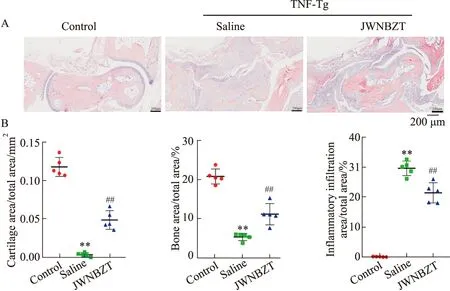
Fig 1 Histological changes of n=5)Blue stain indicates cartilage,blue-purple stain indicates inflammation.**P<0.01 vs control,##P<0.01 vs saline.
3.2 加味牛蒡子汤对TNF-Tg小鼠炎症因子TNF-α、iNOS表达的影响与对照组小鼠相比,生理盐水组的TNF-Tg小鼠炎症细胞因子TNF-α、iNOS的阳性染色明显较多,加味牛蒡子汤治疗组较生理盐水组小鼠炎症因子的阳性表达明显减少,P<0.01,(Fig2)。
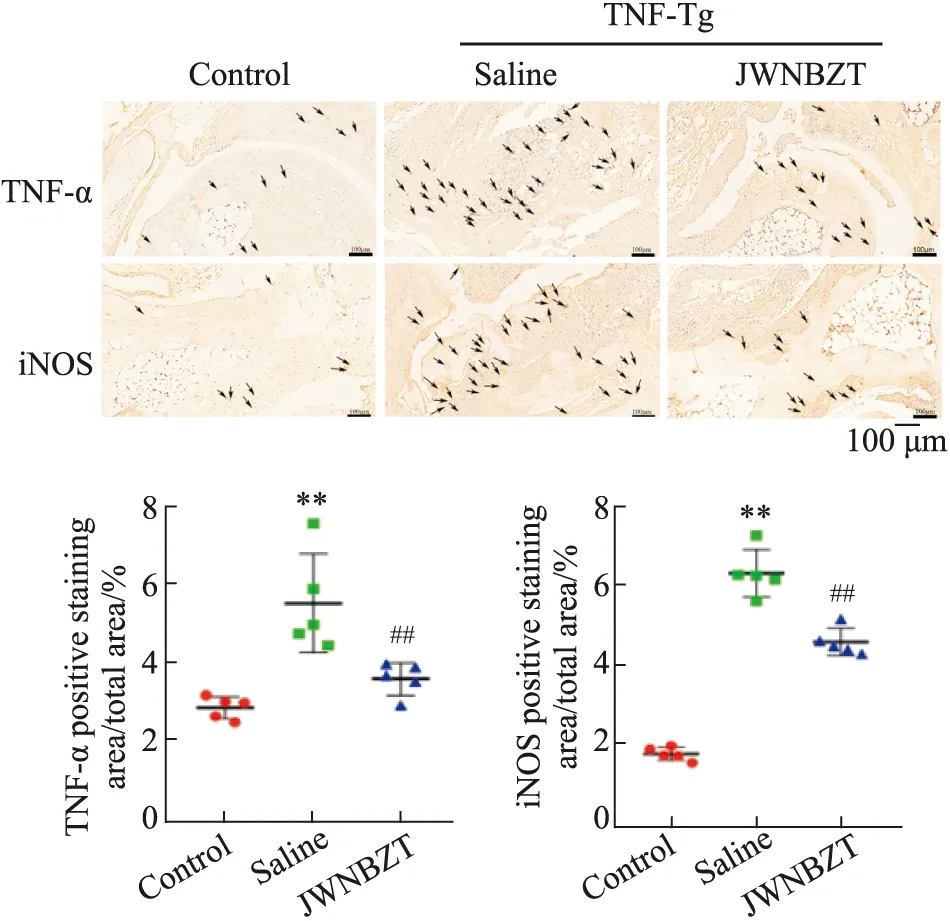
Fig 2 Expression of inflammatory cytokines Black arrows indicate positive staining.**P<0.01 vs control;##P<0.01 vs saline.
3.3 加味牛蒡子汤对TNF-Tg小鼠M1型巨噬细胞浸润的影响F4/80和iNOS双荧光标记炎症性M1型巨噬细胞的免疫荧光染色图片显示,对照组小鼠相较于TNF-Tg小鼠几乎未见M1型巨噬细胞,生理盐水组小鼠炎症性巨噬细胞数量较多,关节炎症加重,加味牛蒡子汤治疗组小鼠踝关节周围M1型巨噬细胞明显减少,炎症免疫反应减弱,P<0.01,(Fig3)。

Fig 3 Effect of inflammatory macrophages of type n=5)Yellow stain indicates inflammatory macrophages of type M1.**P<0.01 vs control;##P<0.01 vs saline.
3.4 加味牛蒡子汤对TNF-Tg小鼠踝关节周围淋巴管新生的影响双标记淋巴管免疫荧光染色图片显示,TNF-Tg小鼠淋巴管明显增生,淋巴管面积相对增多;加味牛蒡子汤治疗后,踝关节区域LYVE-1+/Podoplanin+的毛细淋巴管新生增加(P<0.05),分布更广,且毛细淋巴管汇集而成的LYVE-1-/Podoplanin+的成熟淋巴管的数量明显增多,面积明显增大(P<0.01),(Fig4)。
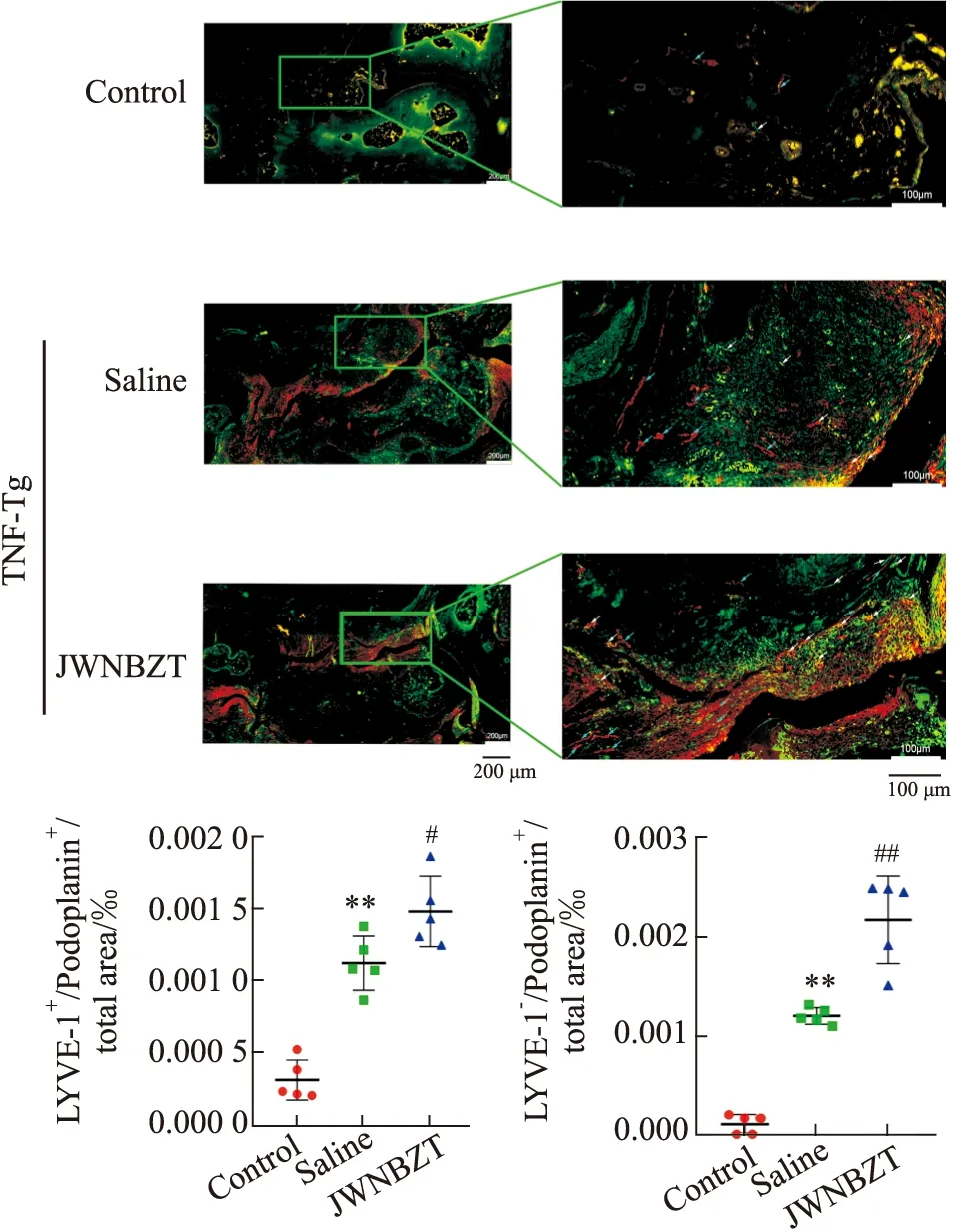
Fig 4 Effect of lymphangiogenesis and n=5)White arrows indicate lymphatic vessels of LYVE-1+/Podoplanin+;Blue arrows indicate lymphatic vessels of LYVE-1-/Podoplanin+.**P<0.01 vs control;#P<0.05,##P<0.01 vs saline.
4 讨论
RA的发生和发展过程伴随着强烈的炎症免疫反应、组织病理改变和淋巴循环功能的变化。RA急性炎症阶段,淋巴回流功能增加[8],有利于代偿调节机体局部炎症免疫环境,对抗急性炎症反应,避免机体进一步损伤;而在RA慢性发展过程中,大量炎症因子刺激下,淋巴管收缩功能受损,导致淋巴回流功能下降[9]。可见,淋巴系统功能和RA的发展过程密切相关。淋巴系统通过影响渗出液、炎症介质和炎性免疫细胞的数量在调节炎症反应中起着关键作用[10]。炎症下,淋巴管生成有多种细胞参与,巨噬细胞可产生血管内皮生成因子(包括VEGF-C和VEGF-D以及基质金属蛋白酶MMP-2和MMP-9等)为淋巴管提供重要的生长环境[11],且维持巨噬细胞极化水平稳态有助于抵抗炎症,促进组织愈合[12]。阻断VEGF-C/VEGFR-3信号通路,淋巴生成和扩张受阻,加剧许多炎症性疾病[10]。此外,炎症条件下,淋巴管是T细胞、B细胞等免疫细胞运输的关键通道,参与塑造和协调免疫反应;反之,巨噬细胞等免疫细胞可提供影响淋巴管的生长、发育和活动的信号和细胞因子微环境,二者之间相互承载、相互作用[2]。前期研究发现,RA炎症下淋巴管的淋巴回流受阻、循环不畅,给予RA模型小鼠炎症性关节局部注射VEGF-C过表达腺病毒,能够增加淋巴管新生,减轻炎症免疫反应[13]。在RA模型小鼠腹腔内注射VEGFR-3中和性抗体,就会抑制淋巴管生成和回流功能,加重关节炎症[14]。可见,淋巴管新生和扩张能够弥补淋巴回流功能受损,改善微循环,反馈调节炎症免疫反应,是机体的自我保护的补偿机制之一。因此,基于淋巴系统激活在炎症中的有益作用,探寻促进靶向调节淋巴循环系统的形态和功能的药物,可能是炎症病理中一个很有前景的治疗方法。
中医认为痰瘀痹病是RA的重要病因,化痰逐瘀散结法调控淋巴循环系统功能对RA的治疗有重要意义[15]。加味牛蒡子汤是上海中医药大学施杞教授根据“以气为主、以血为先、痰瘀兼顾”的学术思想在牛蒡子汤基础上加入中药三七创制出的,临床上治疗痰瘀互结型RA收到了良好的疗效。且牛蒡子汤用于骨伤科痹病有确切的疗效[16-18]。本研究在前期探讨加味牛蒡子汤能够改善淋巴回流功能,减轻RA的基础上,进一步发现了给予加味牛蒡子汤治疗具有促进TNF-Tg小鼠淋巴管的新生和扩张,便于运输免疫细胞,清除过多的炎性细胞和炎症因子,促进炎症消退和关节形态、功能修复的药理效应。
综上,RA是一种严重破坏性的自身免疫病,有效治疗方剂加味牛蒡子汤能够促进淋巴管新生和成熟,减少炎症性M1型巨噬细胞,减少骨破坏和软骨侵蚀,减轻关节炎症免疫反应。因此,加味牛蒡子汤促淋巴管生成和扩张,补偿调节淋巴功能障碍,抑制关节炎症免疫反应的药理效应或将为RA的治疗提供新的研究方向。

