冠心Ⅱ号精制/纯化方对垂体后叶素致急性心肌缺血模型大鼠的保护作用
刘剑刚,熊 双,丰加涛,董国菊,史大卓,梁鑫淼
(1.中国中医科学院西苑医院心血管病中心,国家中医心血管病临床医学研究中心,中国中医科学院心血管病研究所,北京 100091;2.中国科学院大连化学物理研究所分离分析化学重点实验室,辽宁 大连 116023)
“冠心Ⅱ号”是现代活血化瘀中药治疗冠心病心绞痛的代表方药。二十世纪七十年代,通过中国医学科学院阜外心血管病医院等在京六家医院成立的北京地区防治冠心病协作组的临床研究,表明其治疗心绞痛症状缓解的有效率为88.10%[1],为后期血瘀证与活血化瘀研究在全国范围广泛开展奠定了中西医结合的基础。目前,心血管病的介入治疗技术快速发展,但对于稳定性冠心病的患者选择药物治疗还是介入治疗,直到目前尚未有一致的结论,因此药物的早期治疗显得尤为重要[2]。
方药(方剂)是连接中医与中药的桥梁,探索方剂的现代化研究,开展药效物质基础与作用机制的系统研究,其技术关键是中药化学层次的配伍配比、生物活性及其间的关系辨识[3]。课题组对冠心Ⅱ号方进行二次开发,通过对其组方进行新的分离、提取、纯化,使其化学成分明确,且生药质量标准中有效成分芍药苷和丹酚酸B的含量和国家药典(2015版)规定的成分含量检测比较有了较大的提高[4]。本研究通过舌下静注垂体后叶素建立大鼠急性心肌缺血模型,观察现代工艺提取精制和纯化后的冠心Ⅱ号方对预处理(给药)心肌缺血模型大鼠的干预作用,并通过药效指标以及多靶点的效应对比研究,确定二次开发的冠心Ⅱ号药效组分特征成分和药理作用的关系,为进一步冠心Ⅱ号新剂型的二次研发提供药理学依据。
1 材料与方法
1.1 动物60只,Wistar大鼠,SPF级,体质量(180-200)g,♀♂各半,动物质量合格证号:1100111911065302/3,许可证号:SCXK(京)2016-0006,北京维通利华实验动物技术有限公司提供。屏障环境实验动物室饲养,12 h光照,12 h黑暗,动物自由摄水,全价饲料喂食,适用性饲养1周后开始实验。
1.2 药物与试剂冠心Ⅱ号精制方(Refined Guanxin Ⅱ,RGX Ⅱ ),制备样品干粉相当于3.31 g生药·g-1;冠心Ⅱ号纯化方(Optimized Guanxin Ⅱ,OGX Ⅱ ),制备样品干粉相当于16.74 g生药·g-1,由中国科学院大连化学物理研究所提供。冠心Ⅱ号原方制剂,复方川丹颗粒(Chuandan granules,CHDG),1.44 g生药·g-1,批准文号:京药制字Z20163025,由中国中医科学院西苑医院中药制剂室提供,尼可地尔(nicorandil)片,商品名为欣地平,5 mg/片,批号:1906031,由西安汉丰药业有限公司提供。
垂体后叶素(pituitrin,Pit)注射液,1mg(6 IU)·ml-1,批号:190423,由安徽宏业药业有限公司提供;戊巴比妥钠,佛山市化工实验厂(进口分装)提供,批号:CC860907;色谱柱,Tnature C18(4.6×250 mm,5 m),由大连思谱精工有限公司提供,乙腈(分析纯),异丙醇(分析纯),甲醇(分析纯)由国药集团药业股份有限公司提供。
肌酸激酶同工酶MB(CK-MB)试剂盒为中生北控生物科技股份有限公司提供,批号:20191130,心肌钙蛋白(CTNT)ELSIA试剂盒,批号:20191208,内皮素(ET-1)ELSIA试剂盒,批号:20191210,一氧化氮(NO)试剂盒,批号:20191210,由北京华英生物技术研究所提供。超氧化物歧化酶(SOD)活性试剂盒,批号:20191125,丙二醛(MDA)试剂盒,批号:20191128,过氧化氢酶(CAT)试剂盒,批号:20191108,总抗氧化物(T-AOC)试剂盒,批号:20191108,Ca2+,Mg2+-ATP酶活性试剂盒,批号:20191130,Na+,K+-ATP酶活性试剂盒,批号:20191130,均由南京建成生物工程研究所提供。
1.3 仪器DR-200BS型,全自动酶标分析仪,无锡华卫德朗仪器有限公司生产;7160型,全自动生化仪,日本HITACHI公司生产;CARDIPIA 800B型,心电图仪,秦皇岛市康泰医学系统有限公司生产;S6000型,高效液相色谱仪,华谱科仪(北京)科技有限公司生产。
1.4 药物提取方法冠心Ⅱ号方由丹参、川芎、赤芍、红花和降香(3 ∶1.5 ∶1.5 ∶1.5 ∶1)组成,按照处方饮片比例称取药材提取精滤,去除固体杂质。精制制备样品干粉相当于3.31 g生药·g-1。纯化制备样品干粉相当于16.74 g生药·g-1[5]。
1.5 3种药物样品的制备及有效成分的含量测定色谱柱,Tnature C18(4.6×250 mm,5 μm),流动相,A:乙腈,B:水;C:2% H3PO4/水,D:40%异丙醇/甲醇,流速,1.5 mL·min-1,提取波长,254 nm,柱温,40 ℃,进样量,20 μL。
复方川丹颗粒、冠心Ⅱ号精制方,冠心Ⅱ号纯化方分别制备样品:川丹颗粒提取液、精制过滤液、纯化洗脱液。制备能够较大程度上保留指标性成分,川丹颗粒、精制冠心Ⅱ号、纯化冠心Ⅱ号的丹酚酸B外标含量分别为0.767%、4.247%、32.76%,芍药苷外标含量分别为0.418%、1.546%、12.15%。3种冠心Ⅱ号方制剂的指纹图谱基本一致,见Fig1。
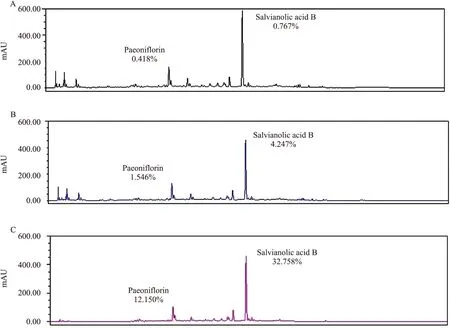
Fig 1 Fingerprint of three kinds preparation of Guanxin ⅡA:fingerprint of CHDG;B:fingerprint of RGX Ⅱ;C:fingerprint of OGX Ⅱ
1.6 模型制作与分组大鼠随机分为生理盐水组(normal saline,NS)、模型组、阳性对照药组(尼可地尔片,Nicorandil,2.70 mg·kg-1)、复方川丹颗粒组(3.19 g·kg-1,相当于生药4.60 g·kg-1)、冠心Ⅱ号精制方组(1.39 g·kg-1,相当于生药4.60 g·kg-1)、冠心Ⅱ号纯化方组(0.27 g·kg-1,相当于生药4.60 g·kg-1)组,每组10只。各组连续灌胃等体积药液,给药7 d,生理盐水组,模型组灌胃等体积纯净水,于末次给药后40 min后,大鼠腹腔注射2% 戊巴比妥钠水溶液(0.2 mL·100 g-1)麻醉,仰位固定于鼠板上,舌下静脉注射pit造模。
急性心肌缺血模型制作方法,大鼠舌下静脉注射pit 0.75 IU·kg-1体质量,恒速缓慢(10 s)注射完毕。大鼠注射pit后心电图的变化一般可分为2期。大鼠的肢体导联与胸导联相似,均无明显的ST段[6],首先,注射后即刻至30 s,T波升高,J点偏移、抬高(>0.1 mV),而J点偏移和抬高(超过0.1 mV),大多数出现在10 s左右,此时心电图的变化最为明显。因此,J点是否偏移是判断大鼠心肌缺血的关键标记,假手术组注射等体积的生理盐水注射液。动物实验过程符合《北京市实验动物福利伦理审查指南》和国家科学技术委员会《关于善待实验动物的指导性意见》的要求。
1.7 指标检测
1.7.1大鼠心电图 麻醉后,固定于鼠板的大鼠四肢皮下插入金属针,连接肢导联,记录多导联心电图。
监测大鼠Ⅰ、Ⅱ、Ⅲ导联心电图,心率(HR)的变化,以P-R起点连线为基线,心电图的纸速为50 mm·s-1,输出频率为50 Hz,增益为10-20 mm·mV-1,待波形稳定后,记录注射pit注射前、注射后10 min内心电图的变化,连续记录5个心电周期,取其平均值。
1.7.2血清标记物检测 CK-MB检测采用免疫竞争法,CTNT检测采用酶联(ELISA)免疫竞争法,检测操作严格按照试剂盒说明书进行。
1.7.3血清抗氧化指标检测 ET-1、CGRP检测采用ELISA免疫竞争法,检测操作严格按照试剂盒说明书进行。SOD活性采用比色法测定,MDA采用比色法测定,在532 nm处为最大吸收峰换算成浓度。CAT采用比色方法测定,通过比色仪在405 nm处测定其生成量,换算CAT的活力。T-AOC采用比色法测定。
1.7.4酶活性指标检测方法 Na+,K+-ATP酶活性,Ca2+,Mg2+-ATP酶活性,均采用比色法,操作严格按照试剂盒说明书进行。

2 结果
2.1 各组冠心Ⅱ号方对pit所致心肌缺血心电图的影响大鼠舌下静脉给予pit 10 min后,模型组大鼠出现心率明显减慢,和假手术组比较差异有显著性(P<0.05),同时心电图的T波低平、倒置及J点偏移和抬高,表明心肌缺血造模成功。和模型组比较,30 s时的尼可地尔组、冠心Ⅱ纯化方组、冠心Ⅱ精制方组具有明显抑制J点偏移和升高的作用(P<0.05),10 min时的尼可地尔组、冠心Ⅱ纯化方组,冠心Ⅱ精制方组和川丹颗粒组具有明显抑制J点偏移和升高的作用(P<0.01,P<0.05),各给药组之间差异无显著性(P>0.05)),见Tab 1,Fig2。
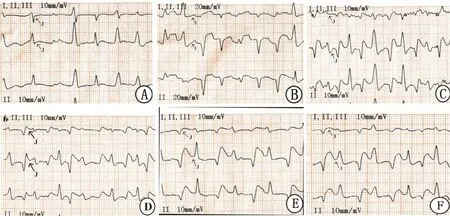
Fig 2 Effects of Guanxin Ⅱ on electrocardiogram J in Pit-induced myocardial ischemic ratsA:NS Group;B:Model Group;C:Nicorandil Group;D:CHDG Group;E:RGX Ⅱ Group;F:OGX Ⅱ Group
2.2 各组冠心Ⅱ号方对血清标记物的影响舌下注射pit 40 min后,大鼠血清cTnT含量明显升高,和假手术组比较差异具有显著性(P<0.05),CK-MB漏出有一定的增加。与模型组比较,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组明显抑制cTnT水平(P<0.05,P<0.05),尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组CK-MB漏出有明显的减少,但差异无显著性(P>0.05),见Tab 2。

Tab 1 Effects of Guanxin Ⅱ formula on ECG of myocardial ischemic rats induced by Pit n=10)
Tab 2 Effects of Guanxin Ⅱ formula on serum CK-MB,cTnT markers in each group of n=10)
2.3 各组冠心Ⅱ号方对氧化应激指标的影响大鼠即刻注射pit后,造成大鼠血清T-AOC、CAT和SOD含量的下降,与假手术组比较,模型组CAT含量下降差异具有显著性(P<0.05)。与模型组比较,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的CAT含量和SOD含量明显升高(P<0.05,P<0.05),各给药之间比较差异无显著性,见Tab 3。
2.4 各组冠心Ⅱ号方对ET-1和NO含量的影响大鼠造模后,和假手术组比较,模型组大鼠血中的ET-1含量明显升高(P<0.01),NO含量明显降低(P<0.01)。和模型组比较,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的ET-1含量得到明显抑制(P<0.01,P<0.01),尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的NO含量明显升高(P<0.01,P<0.01),见Tab 4。
Tab 3 Effects of Guanxin Ⅱ on oxidative stress markers in each group of n=10)

Tab 4 Effects of Guanxin Ⅱ on ET-1,NO markers in each group of rats n=10)
2.5 各组冠心Ⅱ号方对Na+,K+-ATP和Ca2+,Mg2+-ATP酶活性的影响大鼠注射pit后,血清Ca2+,Mg2+-ATP和Na+,K+-ATP活性有不同程度的降低,和假手术组比较,模型组的Ca2+,Mg2+-ATP活性降低,差异有显著性(P<0.05)。和模型组比较,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的Ca2+,Mg2+-ATP的活性明显升高(P<0.05,P<0.05),见Tab 5。

Tab 5 Effects of Guanxin Ⅱ on Na+,K+-ATP,Ca2+,Mg2+-ATP markers in each group of rats n=10)
3 讨论
随着介入心血管病学的快速发展,循证医学已证明介入治疗干预手段的有效性,但直至今日这些干预手段并未带来群体预后的改善,目前的临床实践中,达到早期干预的比例仍然很低[7]。而早期的药物干预具有快速性和便捷性,仍然是目前冠心病早期治疗的重要手段。冠心Ⅱ号方是二十世纪七十年代治疗冠心病心绞痛的经典方剂,也是国家药典收录的中药复方药物,早期运用此方治疗冠心病心绞痛患者疗效明显[1,4]。方剂的现代化研究主要是体现在中药的多种药效物质的提取、分离、鉴定,并明确这些药效物质的作用途径、作用靶点,同时对药物的提取成分进行药理活性筛选以及多靶点的效应对比研究,中药成品的质量、工艺仍有较大的提升空间,是开发现代中药的重要来源[3],也是开发现代中药和传承中医药的有效途径。
早期和现在的学者都对经典名方冠心Ⅱ号方进行了分离提取和药效药理研究,确定了部分有效成分和组分组成[8]。课题组对冠心Ⅱ号进行分离提取,分别采用加热回流提取、精制过滤液、选择性高效纯化制备,最后浓缩喷雾干燥,川丹颗粒、冠心Ⅱ号精制方和冠心Ⅱ号纯化方的生药当量分别为:1.44、3.31和16.74,即1 g样品干粉分别相当于1.44、3.31和16.74 g药材。通过本研究结果可以看出,经过现代工艺提取冠心Ⅱ号样品中的生药含量明显高于川丹颗粒(冠心Ⅱ号方的原制剂),精制过滤和纯化制备工艺能够较大程度上保留指标性成分,川丹颗粒、冠心Ⅱ号精制方、冠心Ⅱ号纯化方的丹酚酸B外标含量分别为0.767%、4.247%、32.758%,芍药苷外标含量分别为0.418%、1.546%、12.15%,精制和优化后其药物的有效成分也有较大的提高,同时服用量也明显减少。现代研究表明,冠心Ⅱ号方中五味药物的有效成分有芍药苷、丹参酮、丹酚酸B、丹参素、阿魏酸和川芎碱等,对缺血、缺氧引起的心肌缩舒功能障碍有良好的改善作用[9-10]。尼可地尔属硝酸酯类化合物(烟浪丁,SIGMART),为作用于平滑肌的钾通道激活剂。近年来研究显示,尼可地尔可解除冠脉痉挛,增加冠脉的血流量,兼有舒张血管的作用,从而改善AMI患者预后[11],是用于治疗心绞痛的新型药物。
垂体后叶素(pituitrin,Pit)是由猪、牛脑垂体后叶中提取的复方水溶性成分,内含催产素和加压素(加压素又称抗利尿素),对平滑肌有强烈的收缩作用,作用快速而持续时间短。利用其对毛细血管和小动脉收缩作用是显著,特别是收缩冠状动脉血管引起血压升高致心肌缺血的特点。大鼠舌下注射后30 s变化最为明显,一般维持10-15 min,是一种广泛的非特定的心肌缺血和心肌损伤[12]。心电图能快速反映心肌缺血的特征变化,注射30 s大鼠心电图显示J点明显偏移、抬高,J、T部分融合或完全融合、倒置,同时P-R及Q-T间期延长,心率减慢,而尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组明显减慢J点偏移、升高,缓解心肌缺血的程度。
肌钙蛋白(Tn)是肌肉组织收缩的调节蛋白,位于收缩蛋白的细肌丝上,在肌肉收缩和舒张过程中起着重要的调节作用,在心肌细胞损伤时从心肌纤维上降解下来,胞质中游离的cTnT迅速释放入血液循环,其可作为早期诊断AMI 的敏感指标[13]。心肌缺血损伤时,CK-MB也从心肌组织中漏出,CK-MB主要存在于心肌细胞的外浆层,CK-MB释放入血后,一般4-6 h开始升高[14]。注射pit后大鼠血清cTnT水平明显升高,由于CK-MB漏出的时效性,其含量有升高的趋势,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组明显抑制cTnT,对CK-MB的漏出有一定抑制。
ET-1和NO均是由血管内皮细胞产生和释放的血管活性物质,ET-1是一种内源性长效血管收缩调节因子,具有收缩血管升血压效应,还可反射性引起心率抑制,造成心肌供血不足。NO是在NOS作用下生成的扩张血管物质,具有选择性舒张作用,可改善血管内皮损伤[15]。Pit作用于心肌组织微血管内皮,造成心肌组织广泛的收缩缺血缺氧,导致许多活性因子释放,如氧化代谢增强、儿茶酚胺水平等升高,进一步导致ET-1含量增高和NO水平降低,加重冠状动脉内皮功能紊乱。尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的ET-1含量得到明显抑制,而NO含量明显升高。
SOD是机体内清除自由基的重要活性物质,具有特殊的生理活性,拮抗因氧自由基升高对组织或细胞造成的损害,还可以及时修复受损细胞。MDA则是影响线粒体呼吸链复合物及线粒体内关键酶活性,是膜脂过氧化最重要的产物之一[16]。CAT广泛存在于红细胞及机体组织内的过氧化体中,主要生理作用就是催化H2O2分解为H2O与O2,促使H2O2减少与O2在铁螯合物作用下的化学反应导致-OH的生成[17]。缺血损伤导致心肌组织发生氧化应激反应,SOD、T-AOC、CAT活性降低,MDA酶活性升高,又负反馈对心肌缺血造成损害,pit引起的急性心肌缺血为短暂性的,大部分氧化应激指标变化尚不明显,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组的CAT含量和SOD含量具有明显升高作用,缓解pit对心肌造成的损害,并对预后起到改善作用。
Na+,K+-ATP酶(钠钾泵),Ca2+,Mg2+-ATP酶(钙泵)分别是存在于组织及细胞膜上的一种蛋白酶,维持着细胞的渗透性,保持细胞的体积。同时维持低Na+,高K+的细胞内环境,是机体代谢反应进行的必需条件。心肌缺血损伤导致血清各种炎性细胞的释放,抑制Na+,K+-ATP酶活性,导致钠钾泵功能降低,细胞内Na+,Ca2+浓度增加[18]。造模后大鼠Ca2+,Mg2+-ATP酶性明显降低,尼可地尔组、川丹颗粒组、冠心Ⅱ精制方组和冠心Ⅱ纯化方组不同程度提高Ca2+,Mg2+-ATP酶的活性,维持Na+,K+-ATP酶性的平衡。
中药复方制剂为多组分和成份复杂体系,建立中药指纹图谱将能较为全面地反映中药及复方制剂中所含化学成分的种类与数量,有助于阐明药物的作用机理,目前中药面临的质量问题,在经典名方研发中可以较好的解决,精制和纯化后的冠心Ⅱ号方有效成分含量较大幅度提升,制备工艺可控,较大程度保留了指标性成分,对pit所致的心肌缺血具有保护作用,其机制涉及抗氧化应激、抑制钙超载、平衡血管稳态、减轻心肌损伤,为进一步的二次研发提供药理学依据。
(课题研究得到山东希力药业有限公司的经费资助和史新灿,罗久朝,史先成工程师的帮助,谨致谢忱!)

