益心泰有效组分对慢性心衰兔心肌组织CaN的影响
魏佳明,李玉莹,李佳玲,李 卉,匡 琳,郭志华,李 雅
(湖南中医药大学 湖南 长沙 410208)
慢性心力衰竭 (chronic heart failure,CHF)是心室充盈或射血能力受损的一组复杂综合征,是世界范围内的公共卫生问题,造成了严重的医疗负担[1]。因此,对其进行积极干预尤为重要。心肌重构是心衰临床进展的关键机制。近年来大量研究显示,钙调神经磷酸酶 (calcineurin,CaN)在心肌重构过程中扮演着重要角色[2]。前期研究表明,益心泰具有抗心衰作用及改善心室重构功能,其机制可能与调节CaN活性有关[3]。中药药效组分制剂为现代中药研究的一大热点,药效组分包括由化合物和单体组成的化学成分,以及由蛋白质、核酸、多糖等共同组成的信息成分。通过研究中药复方有效组分对疾病的影响,有助于打开复方有效的密码,构建中药组效关系,保持其治疗多基因调控的某些复杂疾病与需长期用药的慢性疾病的独特优势,其疗效值得更深入的研究开发和应用。因此,本研究以慢性心衰兔模型作为研究对象,观察兔心肌组织形态学及心功能指标的变化,并检测心肌细胞Ca2+浓度,心肌组织CaN活性、mRNA及蛋白表达水平,深入研究益心泰有效组分 (effective components of Yi-xin-tai,ECYXT)对慢性心衰兔的作用机制。
1 材料与方法
1.1 实验动物体质量(1.5-2.0)kg的普通级健康新西兰兔120只,♀♂各半。购自湖南太平生物科技有限公司,动物许可证编号:SCXK (湘)2015-0004,合格证号:NO.43608300000615,自由进食水,光/暗周期12 h/12 h (光照时间6 ∶00-18 ∶00),室温23 ℃左右,湿度52%-60%。该实验得到湖南中医药大学动物实验伦理审查委员会批准 (LL2018010801)。
1.2 实验药物益心泰有效组分:黄芪、红花、丹参、泽泻、猪苓等购自湖南中医药大学第一附属医院,按照3 ∶1 ∶1.5 ∶1 ∶1配比,采用系统溶剂法与大孔树脂吸附法相结合,对益心泰复方中4个不同极性部位的药效组分进行分离,根据最佳工艺条件,分离得到益心泰有效组分提取液,冷冻干燥得提取物 (含总皂苷372.4 mg·g-1、总黄酮98.3 mg·g-1、总多糖445.8 mg·g-1),益心泰有效组分低、中、高剂量组浓度分别为每日2.1、4.2、8.4 g·kg-1,给药前予以蒸馏水稀释后灌胃;氯沙坦钾:50 mg/片,杭州默沙东制药有限公司,H20000371;丙基硫氧嘧啶:50 mg/片,苏州东瑞制药有限公司,H32020795;乌拉坦:Sigma,94300;生理盐水:500 ml/瓶,四川科伦药业股份有限公司,H51021158;青霉素:160万U/支,山东瑞阳制药有限公司,H37021949。
1.3 实验试剂与仪器多聚甲醛(Sigma,16005);苏木精(Sigma,H9627);伊红(Sigma,E4009);石蜡 (河南天孚化工有限公司);组织钙调神经磷酸酶活性酶连续循环比色法定量试剂盒(赫澎生物,HPBIO-JM6321);RIPA裂解液 (北京索莱宝生物科技有限公司);PMSF (北京索莱宝生物科技有限公司);BSA蛋白定量试剂盒 (北京索莱宝生物科技有限公司);反转录试剂盒 (TaKaRa,RR047A);Trizol (Invitrogen,15596-026);SYBR Premix EX Taq TM II (Takara,DRR820A);RM2235石蜡轮转切片机 (Leica公司);FV3000激光扫描共聚焦显微镜 (OLYMPUS公司);Fluo3/AM (碧云天,S1056);Pluronic-F127 (Sigma,P2443);Sequoia 512超声心动图机 (西门子公司);MK3酶标仪 (Thermo公司);DYY-7C型电泳仪 (北京市六一仪器厂);SYSTEM GelDoc XR+凝胶成像系统 (Bio-Rad公司);iQ5 PCR仪 (Bio-Rad)。
1.4 动物分组及模型制备参考文献[4-5],以腹主动脉缩窄法+丙基硫氧嘧啶灌胃制作兔慢性心衰模型。随机选择实验兔20只作为假手术组,其余100只为模型兔。将兔固定于手术台上,用20%乌拉坦5 mL·kg-1腹腔麻醉。麻醉后在右侧肾动脉分支上方分离腹主动脉,用4号手术线结扎,使腹主动脉缩窄50%左右;假手术组只开放腹主动脉,不结扎。兔腹腔注射青霉素10万U后关腹缝合。术后用开口器和灌胃管对兔行丙基硫氧嘧啶 (PTU)灌胃。假手术组给予生理盐水。灌胃量为兔每日摄食量的0.2%,每日1次,持续6周。造模后d 1,模型兔比较于假手术组出现精神萎靡,抓起反抗降低,心率和呼吸频率升高,耳温和尿量均减少及水肿表现 (Tab 1);同时IVS、LVPW、LVIDs、LVIDd等心脏结构性指标也明显升高,提示了心脏病理性重构的存在;而LVEF、LVFS、E/A比值等心脏收缩功能指标都明显的下降,提示了模型兔心功能下降 (Tab 2)。综上,表明家兔慢性心力衰竭的模型复制成功。将造模成功的模型兔按完全随机设计方法分为HF模型组(17只)、益心泰有效组分低剂量组(17只)、中剂量组(16只)、高剂量组(16只)和氯沙坦钾组(16只),合假手术组(20只),一共6组。

Tab 1 Hair color,mental state,heart rate,respiratory rate,ear temperature,urine volume,edema of rabbits in sham operation group and model group

Tab 2 Ultrasonic examination results of rabbit heart in sham operation group and model group
1.5 干预方法于造模后第1周开始灌胃,根据成人体表面积换算法,结合临床用药经验和既往实验研究,确定益心泰有效组分低、中、高剂量组分别为每日2.1、4.2和8.4 g·kg-1,氯沙坦钾组 (制成氯沙坦钾悬液)2.75 mg·kg-1,假手术组与HF模型组灌服同等容积的蒸馏水,各组灌胃量均为每次10 mL·kg-1,均每日1次,连续4周。
1.6 检测指标及方法
1.6.1一般情况 观察兔毛色、精神状态、心率、呼吸频率、耳温、尿量、水肿等一般情况。
1.6.2心脏超声检测 麻醉满意后将兔平卧位固定,运用西门子Sequoia 512超声心动图机,探头频率3-8 MHz,于心前区取左室长轴最大直径处,M型超声标记室间隔和左室后壁收缩末与舒张末期心内膜位置,随机软件自动计算兔LVEF、LVFS、IVS、LVPW、E/A比值及LVIDs、LVIDd等指标,取5个心动周期读数平均值。
1.6.3心肌组织形态学检查 4%多聚甲醛固定组织,脱水,透明,浸蜡,包埋,切片 (厚4-5 μm),烤片,HE染色,光镜观察并采图。
1.6.4心肌细胞[Ca2+]i浓度 采用荧光负载法测定。酶解法分离心肌细胞,离心后弃上清,细胞沉淀重悬于Joklik培养基,并放入培养瓶中,清洗细胞3次以无菌D’-Hanks液,添加Fluo3/AM (终浓度为4 μmol·L-1)和Pluronic-F127 (终浓度为0.05 %),轻轻震荡孵育45 min,37 ℃,去除负载液,启动共聚焦扫描显微镜,488 nm激光扫描,计算、统计、分析数据,计算公式为[Ca2+]i=Kd[(R-Rmin)/(Rmax-R)](Fmin/f=Fmax),其中Kd为解离常数,F为样品的荧光强度值。
③泄流渠进出水口确定。泄流渠进出水口的布置应有利于进水和出水的衔接,尽量消除回流、涡流的不利影响。泄流渠进口可建成逆坡,防止剧烈冲刷。进出水口方向与主渠道的交角不宜太大。进出水口的高程根据上游库容、上游水位上升趋势、坝体溃决方式、下游防洪标准、泄流渠长度和坡度以及现场施工能力等因素设计选择。
1.6.5心肌组织CaN活性测定 采用酶学比色法。先将试剂盒板条于室温平衡20 min,设置标准品孔、空白孔和检测孔,分别置不同浓度标准品于标准品空中。空白孔不加。在检测孔中加入10 μL样品和40 μL稀释液,在检测孔与标准品孔分别加入100 μL辣根过氧化物酶标记抗体。于37 ℃下孵育1 h,去液体后,将洗涤溶液添加到每个孔中,静置1 min以去除洗涤溶液。反复洗涤5次,加入底物A和B各50 μL到每个孔中,在室温条件下孵育15 min,检测OD值,计算和统计分析。
1.6.6CaN蛋白检测 采用Western blot法测定,液氮研磨心肌组织后,加入裂解液并置于冰上20 min使其充分裂解后,在4 ℃和12 000 r·min-1离心15 min后,保留上清,用BCA法定量蛋白,制备SDS-PAGE浓缩胶与分离胶,上样,电泳,转膜,封闭,配一抗,一抗(1 ∶500),二抗 (1 ∶2 000),显影成像,利用Quantity-One图像分析软件分析各样品目的条带的灰度值,以看家基因GAPDH为内对照,CaN蛋白条带与GAPDH条带灰度值之比(以假手术组作为基础数值)即是目的蛋白的相对表达量。
1.6.7CaN mRNA检测 RT-PCR法测定心肌组织CaN mRNA水平,用TRIzol法提取总RNA,测OD值,检验RNA纯度和浓度。逆转录合成cDNA:配置逆转录反应体系 (20 μL),用去离子水1 ∶3稀释后贮存于-20 ℃冰箱备用。引物设计与合成:CaN:F:5′-ACGGCAGACCCTACAAAG-3′;R:5′-CCCTCAAAGCCTCCATCC-3。PCR反应体系:配置逆转录反应体系(20 μL),置于PCR仪中,95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 20 s,步骤2-4循环40次,72 ℃ 10 min。PCR产物长度391 bp。
1.7 统计学分析不同资料采用不同的统计方法,所有数据均用SPSS 21.0统计处理,计量资料均以处理。多组间比较采用ANOVA法分析,以LSD法进行两组间疗效比较。
2 结果
2.1 各组一般情况比较造模过程中,模型兔共死亡18只,16只死于腹泻,2只死因不明。所有死亡兔进行解剖均可见不同程度的胸腔、腹腔积液及肝脾肿大。用药后,益心泰有效组分低、中、高剂量组及氯沙坦钾组以上情况逐渐较前好转,但是HF模型组没有明显的改变,并且其中部分实验兔较前严重。整个用药过程中HF模型组死亡3只(均死于腹泻),低、中剂量组各死亡2只兔(全部死于腹泻),高剂量组、氯沙坦钾组各死亡1只兔(均因腹泻死亡),假手术组无兔死亡。在症状改善方面,效果最优的为中、高剂量组和氯沙坦钾组,明显强于低剂量组,而HF模型组无改善且较前严重。
2.2 ECYXT对慢性心衰兔心脏超声指标的影响益心泰有效组分低、中、高剂量组与氯沙坦钾组LVEF、LVFS和E/A比值与HF模型组相比均明显提高,差异有显著性(P<0.01)。与低剂量组比较,中、高剂量组和氯沙坦钾组LVEF、LVFS和E/A比值均明显升高,差异有显著性 (P<0.01),而3组之间差异无显著性 (P>0.05)(Tab 3)。

Tab 3 Effects of ECYXT on echocardiographic indexes of CHF rabbits
低剂量组与HF模型组IVS差异无显著性(P>0.05),而中、高剂量组与氯沙坦钾组IVS均明显低于HF模型组(P<0.01)。与低剂量组比较,中、高剂量组和氯沙坦钾组IVS均明显降低 (P<0.01),而3组之间差异无显著性(P>0.05)(Tab 3)。
与HF模型组比较,低、中、高剂量组与氯沙坦钾组LVPW均明显降低 (P<0.01)。与低剂量组比较,中、高剂量组、氯沙坦钾组LVPW均明显降低(P<0.01),而3组之间差异无显著性(P>0.05)(Tab 3)。
与HF模型组比较,低、中、高剂量组与氯沙坦钾组LVIDs均明显降(P<0.01)。与低剂量组比较,中剂量组和氯沙坦钾组LVIDs差异无显著性(P>0.05),而高剂量组LVIDs明显低于低剂量组(P<0.01)。而中、高剂量组与氯沙坦钾组LVIDs差异均无显著性(P>0.05)(Tab 3)。
低、中、高剂量组与氯沙坦钾组LVIDd均明显低于HF模型组(P<0.01)。与低剂量组比较,中剂量组LVIDd差异无显著性 (P>0.05),而高剂量组和氯沙坦钾组LVIDd明显降低(P<0.01)。而中、高剂量组与氯沙坦钾组差异均无显著性(P>0.05)(Tab 3)。
2.3 ECYXT对慢性心衰兔心脏组织形态学的影响HF模型组表现为心肌细胞水肿、坏死,胞核皱缩,间质增宽,少量炎细胞浸润,心肌纤维排列紊乱,部分断裂。各治疗组心肌细胞损伤均较HF模型组有不同程度减轻。低剂量组心肌细胞排列紊乱,纤维断裂,间质增宽,少许炎细胞浸润。中剂量组心肌纤维排列基本正常,少量纤维断裂,心肌细胞轻度水肿,间质增宽,少量炎细胞浸润。高剂量组心肌纤维排列正常,无断裂,无水肿,间质少许炎细胞浸润。氯沙坦钾组:心肌纤维排列正常,无水肿,间质少量炎细胞浸润。假手术组:心肌纤维排列正常,无断裂和水肿,细胞间质无炎细胞浸润 (Fig1)。
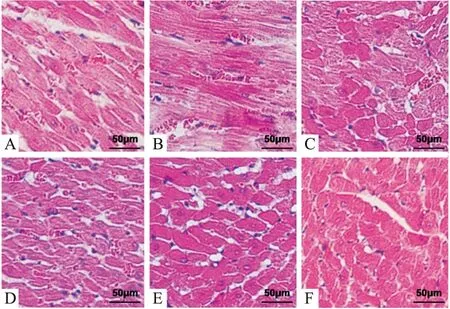
Fig 1 Effect of ECYXT on pathological changes of myocardial tissues in CHF rabbits (HE×400)A:HF model group;B:Low dose group of ECYXT;C:Medium dose group of ECYXT;D:High dose group of ECYXT;E:Losartan potassium group;F:Sham operation group.
2.4 ECYXT对慢性心衰兔心肌细胞[Ca2+]i及心肌组织CaN活性浓度的影响与HF模型组比较,各用药组心肌细胞[Ca2+]i浓度明显降低 (P<0.01)。并且中、高剂量组和氯沙坦钾组心肌细胞[Ca2+]i浓度均低于低剂量组 (P<0.01)。而中、高剂量组与氯沙坦钾组3者之间心肌细胞[Ca2+]i浓度差异均无显著性 (P>0.05)(Tab 4)。
与HF模型组比较,各用药组心肌组织CaN活性明显降低,与HF模型组比较,差异有显著性 (P<0.01)。与低剂量组比较,中、高剂量组和氯沙坦钾组心肌组织CaN活性均明显降低 (P<0.01)。而中、高剂量组与氯沙坦钾组心肌组织CaN活性差异均无显著性 (P>0.05)(Tab 4)。
2.5 ECYXT对慢性心衰兔心肌组织CaN蛋白及mRNA表达的影响与HF模型组比较,各用药组CaN蛋白表达均降低,差异有统计学意义(P<0.01)。与低剂量组比较,中、高剂量组和氯沙坦钾组心肌组织CaN蛋白表达均明显降低(P<0.01)。而中、高剂量组与氯沙坦钾组心肌组织CaN蛋白表达差异均无显著性(P>0.05)(Fig2,Tab 5)。
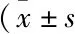
Tab 4 Effects of ECYXT on [Ca2+]i concentration and CaN activity of myocardial tissues in CHF rabbits

Fig 2 Effects of ECYXT on expression of CaN protein of myocardial tissues in CHF rabbitsA:Sham operation group;B:HF model group;C:Low dose group of ECYXT;D:Medium dose group of ECYXT;E:High dose group of ECYXT;F:Losartan potassium group.
与HF模型组比较,各用药组CaN mRNA水平均降低,差异有统计学意义(P<0.01)。与低剂量组比较,中、高剂量组和氯沙坦钾组心肌组织CaN mRNA水平均明显降低 (P<0.01)。而中、高剂量组与氯沙坦钾组心肌组织CaN mRNA水平差异均无显著性(P>0.05)(Tab 5)。

Tab 5 Effects of ECYXT on level of CaN mRNA and protein expression of myocardial tissues in CHF rabbits
3 讨论
慢性心力衰竭是多种心血管疾病的终末期表现和最主要的死因,主要表现为呼吸困难、体力活动受限和体液潴留,已成为严重影响人民生命健康的公共卫生问题。目前对于心衰的治疗目标在改善患者症状的基础上,更注重提高患者生活质量,遏止心肌重构的进一步发展。近年来,中医药治疗CHF在延缓症状、提高患者的生活质量、增延寿命、减少不良反应等方面表现出一定疗效。同时,对心衰进行原创中药研究契合国家中医药发展战略需求导向。
益心泰为临床科研方,由黄芪、红花、丹参、泽泻、猪苓等药伍用而成,功在益气活血利水。本方以补气、活血、利水为主,制方特点重在君以黄芪补心、肺、脾之气。臣以丹参、红花活血化瘀,行血中之滞。佐用泽泻、猪苓利水消肿。因方中红花、丹参归心经,故不再配用使药。经过二十余年的临床用药证明其具有抗心室重构作用,且安全、有效,无不良反应,值得临床推广应用。现代研究表明,益心泰能降低慢性心衰兔LVPW、IVS、LVIDs、LVIDd,升高LVEF、LVFS、E/A比值,降低血清BNP水平,说明益心泰可以改善心肌重构,提高心功能[3]。同时其还可以降低肾髓质水通道蛋白及其mRNA表达量,增加尿量,发挥利水作用,从而改善慢性心力衰竭[6]。益心泰还可降低慢性心衰大鼠心肌细胞内[Ca2+]i含量、Ca2+-ATP酶活性,上调SERCA2a蛋白表达,抑制钙超载[7]。研究表明,黄芪多糖能通过抑制Ca2+-NFATc3-CaMKII信号通路,进而起到改善心衰的效果[8]。丹参多酚可以直接对心肌细胞发挥保护作用[9]。红花提取物可抑制H9C2细胞中的BAD和Bax两个促凋亡基因表达,有效抑制AngII诱导的细胞凋亡[10]。
本研究采用腹主动脉缩窄法+丙基硫氧嘧啶灌胃制作兔慢性心衰模型,深入探讨益心泰有效组分对慢性心衰兔心肌组织CaN的影响。CaN作为一种丝/苏氨酸磷酸酶,可通过影响细胞重构、功能重构及心肌细胞凋亡等多方面干涉心肌重构。研究表明,CaN介导的信号通路激活与心肌细胞内Ca2+升高密切相关,当心肌细胞内Ca2+浓度增加时可激活CaN,进一步启动向核内传递的信号通路,经过一系列反应促进心肌肥厚表型的再表达。与此同时,也可导致细胞膜表面的钙处理蛋白功能失常,其中心肌肌浆网钙泵的失常可以直接影响心肌舒缩作用于功能重构[1]。此外,活化的CaN能促进凋亡蛋白Bad表达,抑制抗凋亡蛋白Bcl-2、Bax表达,加速细胞凋亡。由于以上种种原因,通过降低细胞内Ca2+含量进而抑制CaN活化成为改善心肌重构、提高心功能的有效举措。研究选用氯沙坦钾作为阳性对照药,氯沙坦能下调心衰时心肌细胞内钙离子浓度[11-12],且可以改善心肌重构。心衰时肾素-血管紧张素(RAS)系统被激活,RAS的主要活性肽血管紧张素Ⅱ可通过与1型AngⅡ受体结合,引起细胞钙超载进而启动细胞凋亡,及促进心肌肥大和炎症反应,导致心肌重构。研究表明,氯沙坦对心衰时心功能、心脏重构的逆转作用可能与其阻断AngⅡ与AT1R[13-14]、抑制炎症反应[15]及恢复肌浆网和肌纤维功能有关[16]。本研究结果显示,与假手术组比较,HF模型组的LVEF、LVFS、E/A值均明显降低(P<0.01),心肌细胞内Ca2+浓度,CaN活性、mRNA及蛋白表达明显升高 (P<0.01),提示HF兔心功能下降。与HF模型组相比,各给药组LVEF、LVFS、E/A均有明显升高(P<0.01),心肌细胞内Ca2+浓度与心肌组织CaN活性、mRNA及蛋白表达明显降低 (P<0.01),说明益心泰有效组分能下调心肌细胞内Ca2+浓度与心肌组织CaN活性、mRNA及蛋白表达,提高心功能。且发现各治疗组均能不同程度减轻心肌细胞水肿、坏死、细胞核皱缩,减少纤维断裂及炎性细胞浸润,从病理形态学的角度说明益心泰有效组分能改善心肌细胞损伤程度。进一步研究不同剂量的区别,笔者对益心泰有效组分各剂量组进行比较发现,中、高剂量组和氯沙坦钾组LVEF、LVFS和E/A比值均明显高于低剂量组 (P<0.01),且心肌细胞内Ca2+浓度与心肌组织CaN活性、mRNA及蛋白表达均明显低于低剂量组 (P<0.01),说明益心泰有效组分中、高剂量治疗HF疗效明显优于低剂量。以上结果表明益心泰有效组分能通过降低心肌细胞内Ca2+含量,进而抑制心肌组织CaN活性,抑制心肌组织CaN mRNA及蛋白的表达,改善心肌重构,改善心衰。Yang等[17]在研究芪参颗粒对结扎左冠状动脉前降支大鼠心衰模型的作用机理时,发现芪参颗粒可抑制胞内高Ca2+浓度激活的关键酶CaN活性及抑制CaN蛋白的表达。Wang等[18]的研究发现CaN抑制剂环孢素A可阻断由苯肾上腺素诱导的新生大鼠心肌细胞内Ca2+升高引起的CaN活性提高及CaN蛋白质水平上调。本研究结果中,益心泰有效组分对心肌细胞内Ca2+浓度与心肌组织CaN活性及CaN蛋白表达的调节作用与以上研究结果具有一致性。
综上,本研究通过观察益心泰有效组分对慢性心力衰竭兔模型进行干预,比较各组兔心肌组织组织形态学,心功能指标,心肌细胞内Ca2+浓度,心肌组织CaN活性、CaN mRNA及蛋白表达,结果表明益心泰有效组分能提高心功能,其机制可能是通过抑制CaN活性,抑制CaN mRNA及其蛋白表达,改善心肌重构,进而改善心衰。且不同剂量均能改善心肌重构,防治心衰的进展,但低剂量效果欠佳,而中、高剂量效果明显。

