地西他滨逆转肺腺癌厄洛替尼耐药的作用及机制
胡春生,唐 艳,秦红霞,杨东林,黄玖红
[重庆文理学院药学院(创新靶向药物国际研究院),创新靶向药物国家地方联合工程中心,重庆 402160]
表皮生长因子受体(epidermal growth factor receptor,EGFR)在非小细胞肺癌发生、发展过程中起重要作用。我国约40%的肺腺癌患者发生EGFR突变,此类患者对酪氨酸激酶抑制剂(tyrosine kinase inhibitorsn,TKI)具有良好的反应性,因此临床上已将EGFR-TKI作为靶向药物治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)患者EGFR阳性突变的一线治疗方案。然而,大部分患者在接受第一、二、三代EGFR-TKI治疗以后,约10-12个月出现耐药现象,制约了EGFR-TKI在临床上继续使用[1]。
近年来,研究发现表观遗传机制在基因转录活性调控方面起重要作用。DNA 甲基化异常与多种疾病的发生密切相关,目前研究认为,CpG岛甲基化在细胞分化、基因表达调控、基因突变、基因印记等多方面起重要作用。DNA甲基化在肿瘤中处于异常状态,导致肿瘤转移、耐药等。研究表明,特定基因启动子区的超甲基化将引起EGFR-TKI耐药[2]。地西他滨(decitabine,DE)是DNA甲基转移酶抑制剂,常常用于治疗骨髓增生异常综合征[3],但对逆转肺腺癌EGFR-TKI耐药研究尚少,且其作用机制仍不十分清楚。因此,本文考察了地西他滨对肺腺癌HCC827厄洛替尼(erlotinib,ER)耐药细胞的增殖、迁移、侵袭抑制及细胞周期阻滞的作用,并探讨其主要作用机制。
1 材料与方法
1.1 实验材料及仪器
1.1.1细胞株 人肺腺癌细胞株HCC827/ER耐药细胞,采用厄洛替尼低浓度梯度递增诱导法由重庆文理学院药学院建立并保存,采用MTT法检测其耐药倍数为350倍。
1.1.2试剂 地西他滨(S1200,Selleck)、厄洛替尼(S1023,Selleck);RPMI 1640培养基(SH30809.01,HyClone);胎牛血清(NTC-HK022,Natocor);青链霉素(SV30010,HyClone);胰蛋白酶(2046781,Gibco);甲基化阳性和阴性对照基因组(3522和3521,Takara);PCR试剂(RR001,TaKaRa);基因组DNA提取试剂盒(DP304,天根生化科技有限公司)。
1.1.3仪器 细胞培养箱(Thermo Model 3111);荧光显微镜(OLYMPUS IX73);多功能酶标仪(BioTek Cytation 5);凝胶成像系统(天能Tanon-5200 Multi);Western blot条带激光扫描仪(LI-COR Odeyssey)。
1.2 实验方法
1.2.1MTT法测定细胞增殖 将对数生长期的HCC827/ER细胞用胰酶消化下来,调整细胞浓度为6×107个·L-1,向96孔板中加入100 μL细胞悬液,CO2培养箱中孵育过夜使细胞贴壁;向每孔培养基中加入终浓度为0、0.05、0.5、1、10、25、50 μmol·L-1ER及0、5、10 μmol·L-1DE处理48 h;每孔中加入10 μL MTT试剂后继续培养4 h;弃掉上清,加入200 μL DMSO,摇床80 r·min-1振摇30 min;通过酶标仪测定570 nm吸光值(optical density,OD值),细胞增殖率/%=(OD实验-OD空白)/(OD对照-OD空白)×100%。
1.2.2BrdU荧光染色 将HCC827/ER细胞接种于12孔板中,将细胞分成ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+4组(ER-、DE-表示加入DMSO,ER+表示加入5 μmol·L-1ER,DE+表示加入10 μmol·L-1DE),将BrdU加入细胞培养液中,终浓度为5 mg·L-1,继续培养48 h。吸弃培养基,4%多聚甲醛室温固定30 min,PBS洗涤2次,用0.1%TritonX-100和10%山羊血清封闭1 h,弃掉封闭液,加入兔抗BrdU一抗4 ℃孵育过夜,PBS漂洗后加入山羊抗兔二抗(Cy3标记),避光室温孵育2 h,PBS洗涤后加入DAPI染细胞核,显微镜下观察、拍照。每组随机拍5个视野,计算BrdU表达阳性率。
1.2.3克隆形成 将HCC827/ER细胞按1 000个/孔接种于6孔板中,将细胞分成ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+4组,继续培养14 d。加入4%多聚甲醛固定细胞,PSB洗涤,然后加入1 mL结晶紫溶液室温染色2 min,吸弃染液并用ddH2O洗涤5次。置于扫描仪中拍摄图片,并进行克隆数分析。
1.2.4细胞划痕和侵袭 细胞划痕:使用对数生长期HCC827/ER细胞,接种于12孔板中继续培养待细胞铺满细胞板时,用细胞划痕工具沿孔中线划线,于划线后0、12、24 h显微镜下观察拍照。细胞侵袭:将200 μL无血清培养基稀释的对数期细胞加入附有Matrigel的Transwell小室,下室加入800 μL完全培养基,并按ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+分组加入相应药物继续培养24 h,取出Transwell小室,弃去培养基,并用无菌棉签擦拭掉上室底细胞,4%多聚甲醛室温固定,结晶紫染色后,置于显微镜下观察计数。
1.2.5DNA的硫化修饰及甲基化特异性PCR 收集HCC827/ER细胞,利用基因组DNA提取试剂盒提取DNA并定量。取1 μg基因组DNA,加入去离子水补足20 μL,采用甲基化DNA检测试剂盒对DNA进行处理,简要步骤如下,向上述DNA样品中加入2.2 μL的M-Dilution buffer,42 ℃水浴30 min,继续加入220 μL CT conversion reagent混匀,80 ℃避光孵育60 min,再加入480 μL M-buffer PA,然后通过DNA吸附柱纯化修饰后的DNA,最后溶于20 μL去离子水中。以修饰后的DNA为模板,LMNA甲基化引物(M):UP 5′-TTTACGTTTGTTAGGAGTA AGTCGA-3′,Down 5′-ATAACCGACAAATTAACAAC GCT-3′。LMNA非甲基化引物(U):UP 5′-TTTATG TTTGTTAGGAGTAAGTTGA-3′,Down 5′-CCATAACC AACAAATTAACAACACT-3′,进行甲基化特异性PCR。PCR条件为:95 ℃ 预变性5 min;95 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s,共35个循环;1%琼脂糖凝胶电泳,80 V,30 min。凝胶置于凝胶成像系统中拍照。
1.2.6Western blot分析蛋白表达 使用RIPA裂解液(含蛋白酶抑制剂)分别提取ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+4组HCC827/ER细胞的总蛋白,并用BCA蛋白检测试剂盒进行蛋白定量。上样20 μg总蛋白进行10% SDS-PAGE胶电泳;采用湿转方法(100 V,120 min)将PAGE胶上的蛋白转印至PVDF膜上,然后5%脱脂牛奶室温封闭2 h,TBST洗涤5次,每次2 min;laminA/C、CyclinB1、CyclinA2、CyclinD1、CDC2、CDK4、CDK6一抗4 ℃孵育过夜,TBST洗涤5次,每次2 min;对应IRDye标记二抗稀释比例为1 ∶10 000,室温孵育1 h,TBST洗涤5次,每次2 min;采用LI-COR Odeyssey激光扫描仪检测目的条带并分析检测结果。

2 结果
2.1 地西他滨增强HCC827/ER细胞对厄洛替尼的敏感性MTT法检测结果显示,1、2.5、5、10、20、30、50、100 μmol·L-1的地西他滨处理HCC827/ER细胞48 h的抑制率都在20%左右,且无剂量依赖效应(Fig1A),因此选择5、10 μmol·L-1地西他滨用于联合用药实验。当地西他滨联合不同浓度厄洛替尼(0.05、0.1、0.5、1、5、10、25、50 μmol·L-1)处理耐药细胞,其细胞抑制率都在50%左右,增加HCC827/ER细胞对厄洛替尼的敏感性,且无剂量依赖效应(Fig1B)。利用Compusyn软件计算联合用药的联合指数(combination index,CI值),结果显示CI<1(协同),结果表明地西他滨增强厄洛替尼抑制HCC827/ER耐药细胞增殖的作用。
2.2 地西他滨联合厄洛替尼抑制HCC827/ER细胞迁移和侵袭细胞划痕实验结果显示(Fig2A、2B、2C),划痕12 h后,细胞伤痕愈合率在ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+组分别为(57.3±4.2)%、(49.0±6.6)%、(34.7±2.1)%、(17±2.5)%;划痕24 h后,各组细胞伤痕愈合率分别为(96.7±5.8)%、(76.3±1.5)%、(57.3±2.1)%、(45.7±1.5)%。以上结果表明,地西他滨具有抑制HCC827/ER细胞迁移的作用。当地西他滨与厄洛替尼联合使用时可显著抑制HCC827/ER迁移,与单独使用地西他滨相比差异具有显著性。另外,通过细胞侵袭实验(Fig2D、2E),在ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+组HCC827/ER细胞穿过Transwell膜的数量分别为501±9、339±12、253±20、63±15。与DMSO组相比,单独使用地西他滨对HCC827/ER细胞侵袭能力具有一定的抑制作用,与厄洛替尼联合使用后显著抑制HCC827/ER细胞侵袭(P<0.01)。
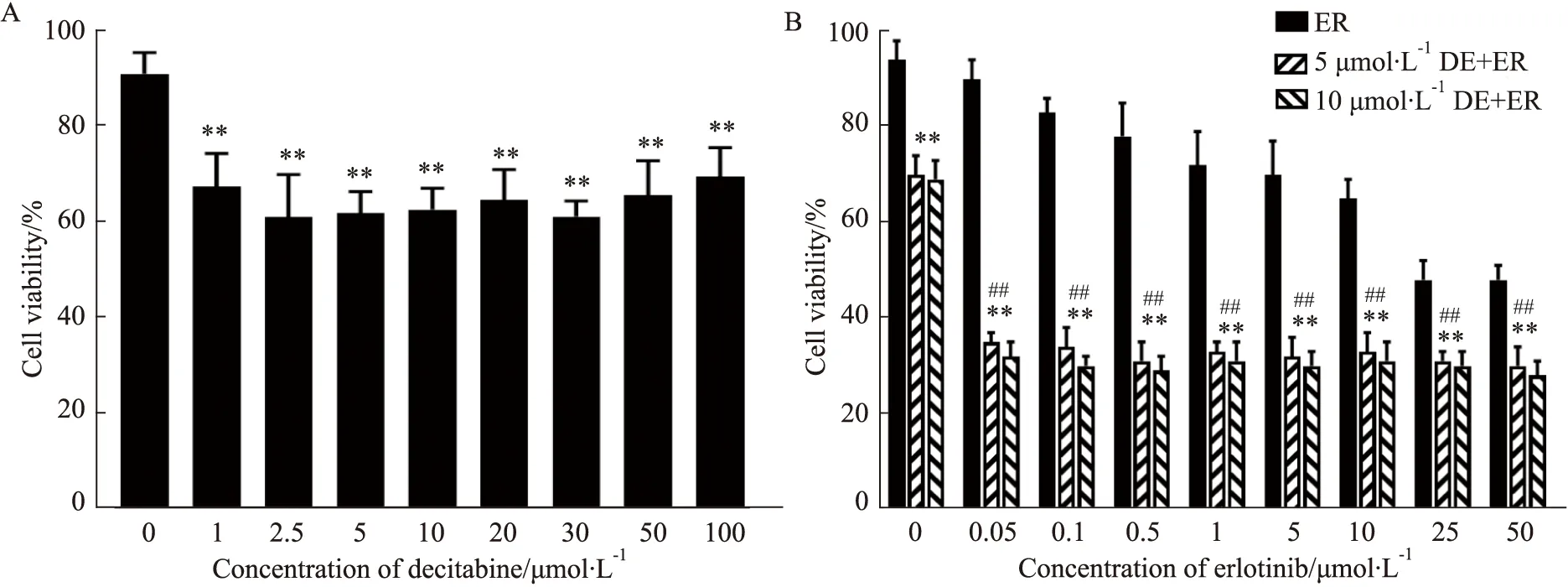
Fig 1 Decitabine enhanced anti-cancer effect of erlotinib to lung adenocarcinoma HCC827/ER n=6)A:The effect of decitabine on HCC827 and HCC827/ER cell viability.**P<0.01 vs DMSO group;B:The effect of decitabine in combination with erlotinib on cell viablility in HCC827/ER cells.**P<0.01 vs ER group;##P<0.01 vs only 5 μmol·L-1 or 10 μmol·L-1 DE group.

Fig 2 Effect of decitabine in combination with erlotinib on cell migration and invasion in HCC827/ER cells n=3)A:Decitabine,erlotinib alone or both together on the migration in HCC827/ER cell was detected by wound healing assay (×10);B,C:The percentage of wound healing area was analyzed at 12 h and 24 h after scratch;D:Decitabine,erlotinib alone or both together on the invasion in HCC827/ER cell was detected by Transwell(×20);E:The number of invasion cells was analyzed.*P<0.05,**P<0.01 vs ER-/DE-group.

Fig 3 Effect of decitabine in combination with erlotinib on cell proliferation ability and clonogenicity in vitro n=3)A,B:The cell proliferation ability was detected by BrdU assay(×20);C,D:Colony formation was performed with HCC827/ER cell for two weeks.**P<0.01 vs ER-/DE- group;##P<0.01 vs ER+/DE- or ER-/DE+ group.
2.3 地西他滨联合厄洛替尼抑制HCC827/ER细胞增殖及克隆形成通过BrdU参入实验(Fig3A、3B),BrdU/DAPI的比率在ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+组分别为0.64±0.08、0.39±0.01、0.53±0.19、0.20±0.04。以上结果表明,单独应用5 μmol·L-1厄洛替尼可抑制HCC827/ER细胞增殖,联合地西他滨后可显著抑制HCC827/ER细胞增殖(P<0.01),然而单用地西他滨(10 μmol·L-1)对耐药细胞增殖抑制不明显。进一步通过克隆形成实验结果显示(Fig3C、3D),在ER-/DE-、ER+/DE-、ER-/DE+、ER+/DE+组中克隆数分别为216±15、101±9、129±11、52±8。与厄洛替尼(5 μmol·L-1)和地西他滨(10 μmol·L-1)单药组相比,联合用药组细胞细胞集落数量和大小形态均小于单药处理组。地西他滨联合厄洛替尼对HCC827/ER细胞克隆形成率明显下降,表明两药联合对HCC827/ER细胞的增殖和成瘤能力具有明显抑制作用。
2.4 地西他滨促进核纤层蛋白laminA/C表达甲基化特异性PCR检测了laminA/C基因启动子区甲基化情况(Fig4),在HCC827/ER细胞中laminA/C基因启动子区甲基化水平明显高于HCC827亲本细胞,Western blot结果显示在蛋白水平上,HCC827/ER细胞中laminA/C蛋白表达低于HCC827细胞,这表明启动子区高甲基化抑制了laminA/C的蛋白表达。向HCC827/ER细胞中加入地西他滨后,抑制了laminA/C启动子区甲基化,促进laminA/C蛋白表达,从而增强了耐药细胞对厄洛替尼的敏感性。

Fig 4 Effect of decitabine in combination with erlotinib on methylation of laminA/C promoter and protein expressionA:Expression of laminA/C protein significantly decreased in HCC827/ER cells compared to HCC827 cells;B:Methylation analysis was detected by MSP.“+”:Hypermethylation of the genome,“-”:Low methylation of genome,“M”:Methylation,“U”:Unmethylation;C:LaminA/C protein was detected in HCC827/ER cells treated with decitabine or erlotinib.

Fig 5 Effect of decitabine in combination with erlotinib on cell cyclin related protein expression
2.5 地西他滨联合厄洛替尼对细胞周期蛋白的抑制作用如Fig5所示,在联合地西他滨和厄洛替尼的HCC827/ER细胞中,细胞周期蛋白CyclinA2、CyclinB1、CyclinD1表达下调,同时协同蛋白CDC2、CDK4、CDK6表达也下调;周期抑制P21蛋白表达上调。结果表明联合地西他滨与厄洛替尼可通过细胞周期阻滞,抑制细胞增殖,促进HCC827/ER耐药细胞死亡。
3 讨论
本课题组研究发现,核纤层蛋白laminA/C在肺腺癌HCC827/ER厄洛替尼耐药细胞株中的表达显著低于亲本细胞HCC827。在此基础上,通过甲基化特异性PCR发现耐药细胞中laminA/C启动子区甲基化修饰高于亲本细胞,且地西他滨能够抑制laminA/C启动子区甲基化修饰,促进laminA/C蛋白表达,逆转HCC827/ER细胞对厄洛替尼的耐药。以上结果表明超甲基化修饰抑制laminA/C蛋白表达,从而促进细胞厄洛替尼耐药。本研究通过深入研究去甲基化酶抑制剂地西他滨逆转肺腺癌厄洛替尼的耐药及机制,以期为肺腺癌患者EGFR-TKI耐药后精准治疗提供理论基础。
非小细胞肺癌EGFR-TKI获得性耐药机制涉及多基因、多途径的复杂调控过程,部分耐药机制尚不明确。已有大量文献报道EGFR-TKI耐药机制主要集中在以下几个方面[4-8]:(1)EGFR基因的二次突变(T790M突变、C797S突变等),其中第一、二代EGFR-TKI发生T790M突变。针对T790M突变的第三代EGFR-TKI药物在使用10个月左右患者发生C797S突变,病情再次出现进展;(2)c-MET及HER2原癌基因扩增,该类基因扩增可导致下游PI3K/AKT信号通路异常活化引起肿瘤对EGFR-TKI耐药;(3)K-Ras基因突变,其基因的活化突变会导致患者对EGFR-TKI耐药;(4)PTEN功能缺陷,其抑癌作用丧失,导致EGFR-TKI无法下调凋亡基因,从而引起肿瘤耐药;(5)上皮间质转化,在耐药发生过程中,伴随着上皮细胞向间质细胞转化的形态学改变,同时伴有上皮标志物减少和间质标志物增多。本课题组前期研究和相关文献报道显示,肺腺癌HCC827细胞EGFR-TKI耐药后发生EMT转化,主要表现E-cadherin表达降低,N-cadherin和vimentin表达上调[9]。同时,本研究结果显示,HCC827/ER耐药细胞中核纤层蛋白laminA/C表达显著低于亲本细胞株,该发现提示laminA/C可能参与EMT过程介导EGFR-TKI耐药。
本研究发现,利用地西他滨处理HCC827/ER耐药细胞以后,提高核纤层蛋白laminA/C表达,可以逆转HCC827/ER对厄洛替尼的耐药性,降低耐药细胞增殖、迁移侵袭能力。laminA/C的研究主要集中在早老症上,但近年来研究发现肿瘤中的laminA/C表达量明显低于癌旁组织或正常组织,在肿瘤的发生、转移和侵袭过程中发挥着重要作用[10-13]。Nardella和Cicchillitti课题组都发现laminA/C的低表达增加肿瘤细胞的恶性程度[11,14]。Zhang等[15]通过上调乳腺癌细胞laminA/C表达引起细胞骨架排列改变促进悬浮乳腺癌细胞快速贴壁,表明laminA/C对肿瘤转移具有抑制作用。既往的研究发现,在非小细胞肺癌患者的基因组中存在高甲基化修饰。因此,非小细胞肺癌PC9/GR耐药细胞株用去甲基化药物5-Aza-cdR处理以后,可恢复对吉非替尼的敏感性,这可能抑制EGFR启动子区甲基化水平有关[16]。另外,联合使用去甲基化药物5-Aza-cdR可以增强肺腺癌原发耐药细胞株H1650、H1299对吉非替尼的敏感性[17]。laminA/C在肺腺癌中呈现表达降低的趋势,这与其基因启动子区高甲基化相关。本研究发现在耐药细胞中laminA/C启动子区甲基化水平高于亲本细胞,抑制laminA/C蛋白表达导致HCC827细胞对厄洛替尼产生耐药。利用地西他滨处理耐药细胞后可抑制laminA/C启动子区甲基化水平,增加laminA/C蛋白表达,逆转HCC827/ER细胞对厄洛替尼的耐药性,但laminA/C在调控肺腺癌EGFR-TKI耐药中的机制还需深入研究。
EGFR受体被配体激活后,引起下游信号通路PI3K/AKT、Ras/MEK/MAPK等调控细胞增殖与分化、迁移与侵袭等[18]。HCC827/ER耐药细胞中,细胞周期蛋白相关蛋白CyclinA2、CyclinB1、CyclinD1、CDK4、CDK6表达上调,促进耐药细胞增殖;单独使用厄洛替尼或地西他滨处理HCC827/ER耐药细胞,其相关周期蛋白表达与DMSO对照组相比无明显差异,但地西他滨联合厄洛替尼可显著抑制周期相关蛋白的表达,促进周期抑制P21蛋白表达,使耐药细胞周期受到阻滞,引起细胞死亡。
综上所述,本研究发现地西他滨可逆转肺腺癌HCC827/ER细胞对厄洛替尼的耐药性,主要通过抑制laminA/C启动子区DNA甲基化水平,促进laminA/C蛋白表达,对细胞周期进行调控,抑制耐药细胞增殖、迁移和侵袭,为非小细胞肺癌EGFR-TKI耐药后用药提供理论依据。

