环状RNAs在心肌纤维化中的作用机制研究进展
吉东妮,张明宇,张 荣,王晓涵,金赛迪,官晓翔,许超千
(哈尔滨医科大学药学院药理学教研室,省部共建生物医药国家重点实验室,黑龙江 哈尔滨 150081)
1 CircRNAs简介
1.1 CircRNAs的生物起源CircRNAs是一种新的非编码环状RNA,其长度从100碱基到几千碱基,存在于许多物种中,例如:古生菌、真菌、动植物等。CircRNAs是由部分蛋白质编码基因或其它转录本反向剪接或环化而产生的。在不同的剪接形式下,单个基因位点可以通过选择性的反向剪接位点选择产生不同的circRNAs[1-2]。共价闭合的外显子circRNAs是由外显子的3’端与同一外显子或上游外显子的5’端连接产生的,形成一个封闭的RNA环,区别于其他线性RNA分子[3]。CircRNAs的共价闭环结构,也称为“反向剪接”[4]。尽管circRNAs的转录效率低于线性RNA,但由于其具有较高的稳定性和较长的半衰期,circRNA的数量仍然很多[5]。CircRNAs包括3种类型:外显子环状RNAs(EcircRNAs)、内含子环状RNAs(CiRNAs)和外显子-内含子环状RNAs(EIciRNAs)。外显子环状RNAs为大多数circRNAs类型,占已知circRNAs的80%以上,其主要位于细胞质中,有三种形成模式:套索驱动环化、内含子配对驱动环化和复制驱动环化。由于它们都是由外显子剪接而形成,因此外显子环状RNAs只由外显子序列组成。内含子环状RNAs主要定位于细胞核,其形成则主要依赖于一致的RNA基序和分支点,并且只由内含子序列组成。外显子-内含子环状RNAs主要存在于细胞核,由外显子序列和内含子序列组成。由于外显子-内含子环状RNAs与RNA聚合酶Ⅱ有关,因而其通常被认作是转录调控因子[4,6]。
1.2 CircRNAs的作用方式大量研究表明,circRNAs功能较为复杂。其可以作为吸附海绵,竞争性吸附内源RNAs、miRNA或者蛋白质,也可以翻译产生多肽,还可以参加转录调节和剪接过程。环状RNA主要具有以下作用方式:(1)吸附miRNA:CircRNAs通过吸附miRNA,阻断miRNA和其靶基因相互结合,因而在转录调控中产生重要的影响[7]。Liu等[8]发现在葡萄膜黑色素瘤细胞系和组织中,circ_0119872表达升高,过表达circ_0119872可促进葡萄膜黑色素瘤细胞的恶性转化,但沉默circ_0119872则可抑制其恶性转化;进一步研究发现,circ_0119872通过调节miR-622/G3BP1轴以及其下游Wnt/β-catenin和mTOR信号通路促进葡萄膜黑色素瘤的发展。(2)与蛋白结合:鉴于保守的基因组区域含有许多circRNAs,并且这些区域富含蛋白质结合位点,因而,circRNAs也有可能作为蛋白质海绵,起到抑制蛋白质功能的作用。Xu等[9]证实circRNA-SORE在对索拉非尼耐药的肝癌细胞中表达升高,而circRNA-SORE的缺失提高索拉非尼对细胞的杀伤力。进一步机制研究表明,circRNA-SORE与细胞质中的主要致癌蛋白YBX1结合,从而阻止YBX1移位到细胞核与PRP19相互作用,最终阻断PRP19介导的YBX1降解。(3)编码多肽:环状RNAs是一种具有共价闭合环的圆形RNA,因而最开始被分类为非编码RNA。然而,近年研究发现,有些细胞质中的circRNAs可以翻译多肽。具有翻译功能的circRNAs分子,其具有内部核糖体进入位点(IRES)元件或原核核糖体结合位点。Jiang等[10]证实circMAPK1在胃癌组织中表达降低。进一步研究发现,circMAPK1可编码一个全长为109个氨基酸的新蛋白MAPK1-109aa。MAPK1-109aa通过抑制MAPK信号通路的激活,从而抑制胃癌的进展。(4)影响宿主基因的转录调控:研究发现,定位于细胞核中的circRNAs可能具有调控其宿主基因转录的功能。Santer等[3]发现circPAIP2可以与U1小核糖核蛋白相互作用,从而增强RNA聚合酶Ⅱ的活性,促进亲本基因转录。
1.3 CircRNAs与多种疾病相关目前,对circRNAs的研究还不是特别深入,但其表现出的稳定性好、保守性高等特性说明其在生物体的病理生理过程中发挥重要的作用,并且很有可能作为一种新型生物标志物应用于临床。大量研究发现,circRNAs参与调控多种疾病的发生发展。例如癌症、神经发育、骨相关疾病、糖尿病、心血管疾病等。尤其在心血管疾病方面,Zhai等[11]发现下调circ_0060745基因可能通过抑制NF-κB活化来抑制心肌细胞凋亡和炎症以减轻急性心肌梗死。
2 CircRNAs在心肌纤维化中的作用及机制
心肌纤维化是许多心血管疾病如心肌梗死、高血压和冠心病等的重要病理表现,其主要特征是心脏成纤维细胞的活性增强,心脏成纤维细胞向收缩性和分泌性的肌成纤维细胞转分化,引起ECM蛋白增多。然而,实验结果证明,过多的产生胶原蛋白可能会减少心脏顺应性,最后导致收缩和舒张功能降低。在心血管疾病中,心肌纤维化可以划分为3个阶段:轻度弥漫性纤维化、重度弥漫性纤维化和节段性纤维化[12-13]。鉴于circRNAs可以抵抗核糖核酸外切酶R,具有较高的稳定性,及其具有器官特异性高表达等特性[7]。Jiao等[13]提供心肌纤维化中差异表达的circRNA表达谱,并进一步通过预测的circRNAs相关ceRNA网络和生物信息学分析,揭示circRNAs在心脏纤维化中发挥重要的潜在作用。本文对circRNAs在心肌纤维化过程中的最新研究进展进行了详细阐述,以更好的阐述circRNAs在心血管疾病中的潜在治疗作用。
2.1 CircRNAs通过吸附miRNA参与调控心肌纤维化Tang 等[14]发现circRNA_000203通过吸附miR-26b-5p上调Col1a2和CTGF的表达,从而增强心脏成纤维细胞的纤维化表型,最终导致心肌纤维化。Zhu等[15]证实在TGF-β诱导的心肌纤维化模型中,circNFIB表达下调,过表达circNFIB可减轻纤维化程度。进一步研究发现,circNFIB通过海绵吸附miR-433,从而减轻其促进成纤维细胞增殖的作用。Sun等[16]发现过表达circ_LAS1L可促进SFRP5表达,抑制α-平滑肌肌动蛋白、Ⅰ型胶原和Ⅲ型胶原的表达,从而抑制心脏成纤维细胞的增殖和迁移。进一步机制研究发现,circ_LAS1L通过靶向miR-125b/SFRP5轴调控心脏成纤维细胞的生物学特性。Zhang等[17]发现circ_BMP2K通过海绵吸附miR-455-3p,从而解除其对SUMO1抑制作用,最终抑制心脏成纤维细胞的活化、生长和迁移。Li等[18]证实在心肌缺血/再灌注(I/R)的小鼠模型中,敲减circNCX1明显减少胶原面积,改善心脏功能,进一步机制研究发现,circNCX1通过海绵吸附miR-133a-3p来调节心肌纤维化。
2.2 CircRNAs通过与蛋白相互作用参与调控心肌纤维化研究发现,circRNAs可通过RNA结合蛋白作为蛋白质海绵、诱饵、支架或招募者等。CircRNAs与蛋白质之间的相互作用可改变蛋白质之间的相互作用、系留或隔离蛋白质、招募蛋白质到染色质、形成circRNA-蛋白质-mRNA三元复合物以及影响蛋白质的移位或重新分配[19-22]。CircRNAs-蛋白质相互作用是与心肌纤维化相关的另一个分子机制。Garikipati 等[23]发现在心肌梗死后小鼠心脏和缺血性心肌病患者的心脏组织中,circFndc3b表达降低,过表达circFndc3b可通过促进心肌梗死区新生血管和减轻梗死区纤维化而发挥心脏保护作用。进一步的研究发现circFndc3b与FUS蛋白相互作用,调节VEGF的表达和信号转导,从而减少心肌梗死后的心肌纤维化。Zeng 等[24]证实circ-Amotl1在新生儿心脏组织中高表达,异位表达circ-Amotl1可逆转阿霉素诱导所致的左心室增大及胶原染色增加等。这些结果表明circ-Amotl1可能在阿霉素诱导的心肌病中起到心肌保护作用。进一步机制研究发现,circ-Amotl1与PDK1和AKT1相互作用,促进AKP和PDK1的核转位,减轻纤维化。Wu等[25]通过环状测序,发现hsa_cic_0002320为circYap的一种亚型并且其在人心脏组织中高表达。进一步研究发现,心肌肥厚患者心脏中该亚型水平明显降低。在压力超负荷的小鼠模型中,横断性主动脉缩窄(TAC)小鼠心脏的circYap水平降低。注射circYap质粒后,TAC小鼠心肌纤维化减轻,心功能改善,心脏circYap水平升高。原肌球蛋白-4(TMP4)和γ-肌动蛋白(ACTG)在心肌细胞和小鼠心脏组织中与circYap结合。这种结合导致TPM4与ACTG的相互作用增加,从而抑制肌动蛋白聚合和随后的纤维化。
2.3 CircRNAs通过其他作用方式参与调控心肌纤维化Si等[26]证实在心肌梗死后,过表达circHipk3可减轻心功能障碍及纤维化面积,显著恢复心功能。进一步研究发现,Gata4与circHipk3启动子中的特定位点结合,并可正向调控circHipk3的表达。CircHipk3分别通过激活Notch1信号和抑制miR-133a活性来促进心肌细胞增殖和血管生成。Huang等[27]发现circNfix在人类、大鼠和小鼠的成年心脏中高表达。进一步研究发现,敲除circNfix可减轻心肌梗死后的纤维化程度及心功能不全,进一步的机制研究发现,circNfix增强YBX1与Ned4l的相互作用,促进YBX1降解以及circNfix还可作为miR-214的海绵,从而抑制miR-214活性。
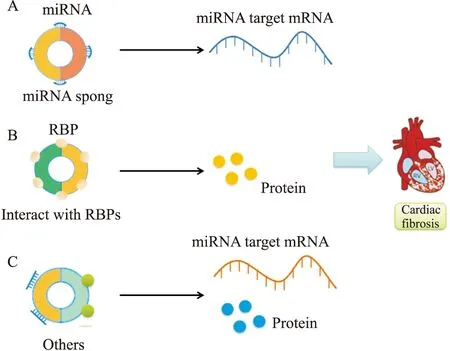
Fig 1 CircRNAs regulated mode of action of myocardial fibrosisA:CircRNAs participate in the regulation of myocardial fibrosis by adsorbing miRNAs;B:CircRNAs participate in the regulation of myocardial fibrosis by interacting with proteins;C:CircRNAs participate in the regulation of myocardial fibrosis through other modes of action.
3 总结与展望
鉴于目前对纤维化病理生理学和成纤维细胞生物学的了解尚不够全面,当前还缺乏治疗心肌纤维化有效的临床手段与措施。CircRNAs最初被证明是异常剪接的副产品,但随着circRNAs的研究不断深入,逐步发现circRNAs具有多种生物学功能。研究发现,在基因的表达调控,翻译和mRNA竞争中,circRNAs被证实是发挥着重要的调控作用,有可能是疾病的潜在治疗靶点和生物标志物[28]。在非编码RNAs中,由于circRNAs具有保守性好、稳定性高等特征,使circRNAs比其他ncRNAs在诊断和治疗疾病方面更有效[7]。总之,尽管对于circRNAs的了解仍处于早期阶段,包括circRNAs的表达模式、它们在疾病状态中的调控、病理生理作用以及用于治疗或诊断目的的潜在用途。但研究发现,环状RNA参与调控心肌纤维化,在心肌纤维化中发挥重要的作用[29]。如上所述,虽然circRNAs在心肌纤维化中的研究成果并不多,但现有研究结果充分表明circRNAs在心肌纤维化中发挥重要的调控作用,circRNAs极有可能成为心肌纤维化治疗和预防的潜在靶点。

