AngioJet流变抽栓系统联合导管接触性溶栓治疗急性高危肺动脉栓塞的疗效
侯 欣 金 松 王凯峰 杨 婷
佳木斯大学附属第一医院血管外科,黑龙江 佳木斯 154000
急性肺动脉栓塞 (acute pulmonary embolism,APE)是静脉血栓栓塞的并发症之一。造成肺栓塞(pulmonary embolism,PE)的栓子大部分来源于下肢深静脉,栓子经静脉回流阻塞至肺动脉主干及其分支,其病理生理学基础是右心功能不全和血流动力学不稳定,严重影响患者的循环功能及肺的气体交换。在发达国家,PE已成为心血管疾病患者的第三大死亡原因,美国每年新发病例60万,院内发病率无明显变化的患者占0.4%[1]。APE治疗的紧迫性和程度根据肺动脉闭塞程度及血流动力学和心肺后遗症的严重程度进行分级。但是,无论以右心功能不全,还是以休克为临床症状,迅速减少血栓负担和改善血流动力学障碍是治疗的目的。目前,尽管指南推荐对血流动力学不稳定的PE患者行静脉溶栓治疗,但超过40%以上的APE患者伴有溶栓禁忌证或溶栓失败,且溶栓治疗并不能降低病死率和复发率[2]。AngioJet流变抽栓系统(AngioJet rheolytic thrombectomy,ART)和导管接触性溶栓(catheter directed thrombolysis,CDT)治疗PE取得了良好的疗效[3-4],但哪些患者能够从ART联合CDT的治疗中获益仍不明确,而且目前国内尚缺乏相关的临床研究。本研究对ART联合CDT治疗高危APE患者的临床效果进行探讨,以期为其临床治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年9月至2020年12月佳木斯大学附属第一医院收治的20例严重APE患者的临床资料。20例严重APE患者中,男性9例,女性11例;年龄56~84岁,平均(71.1±6.40)岁;临床症状主要为不同程度的胸闷、胸痛、呼吸困难,其中10例患者出现低血压、晕厥、休克;除4例患者无特殊病史外,其他患者均存在形成PE的诱因或危险因素,包括外科手术后(3例)、骨折(4例)、既往有深静脉血栓形成(deep venous thrombosis,DVT)病史(6例)、长期卧床(2例)、乳腺癌(1例)。术前心脏超声检查结果显示所有患者均存在不同程度的右心室扩大,右心室与左心室内径的比值为1.11~1.85,平均(1.45±0.23)。术前,14例患者出现血清脑利钠肽(brain natriuretic peptide,BNP)或N末端B型利钠肽原(N-terminal prohormone of brain natriuretic peptide,NT‐proBNP)升高(BNP>90 pg/ml或NT-proBNP>500 pg/ml);5例患者伴有不同程度的心肌损伤表现,即心肌肌钙蛋白T大于0.15 ng/ml。11例患者经超声检查确诊为下肢DVT。20例患者入院后均行肺动脉计算机断层扫描血管成像(computer tomography angiography,CTA)检查确诊为APE,其中,双侧肺动脉主干栓塞13例,左侧肺动脉栓塞4例,右侧肺动脉栓塞3例;大面积肺栓塞(massive pulmonary embolism,MPE)患者12例,次大面积肺栓塞(submassive pulmonary embolism,SMPE)患者8例,分别作为MPE组和SMPE组。
1.2 介入治疗前准备
20例严重APE患者均行术前准备,完善心脏彩色多普勒超声检查及下肢血管超声检查、心电图、心肌酶谱、肺动脉CTA检查、动脉血氧分压、血氧饱和度及凝血功能检查。完善检查后患者进入重症医学科予以生命支持、全身抗凝治疗,并经外周血管建立溶栓通道,使用尿激酶进行系统溶栓治疗。20例严重APE患者中,13例患者行气管插管辅助呼吸,4例患者经鼻导管吸氧法高浓度吸氧,3例患者行不同剂量的血管活性药物支持治疗。期间监测患者凝血功能和生命体征及时调整治疗方案。
1.3 介入治疗
1.3.1 适应证
(1)经肺动脉CTA检查明确诊断为PE;(2)患者入院后经外周静脉通道系统溶栓治疗12 h后的临床症状改善不明显或伴有溶栓绝对禁忌证;(3)患者要求行ART联合CDT治疗或同意行ART联合CDT治疗,并签署手术同意书;(4)根据PE的严重程度将APE患者进行分级,分为MPE和SMPE。MPE的主要表现为血流动力学不稳定和全身低血压[收缩压<90 mmHg(1 mmHg=0.133 kPa)且持续超过15 min,血压降超过基线40 mmHg或需要行血管活性药物支持治疗]。SMPE无全身低血压表现(收缩压>90 mmHg),但伴有右心室功能障碍或心肌坏死,且存在严重呼吸困难、心动过速等临床表现[5]。
1.3.2 方法
若患者术前的下肢静脉超声检查结果提示存在DVT,术中首先置入可回收下腔静脉滤器,预防下肢DVT脱落从而造成二次栓塞。术前,通过肺动脉CTA确定栓塞部位作为目标血管,重点治疗肺动脉主干和肺动脉一级分支血管的血栓。手术均于数字减影血管造影(digital subtraction angiography,DSA)机下进行。全身肝素化后,患者取平卧位,给予心电监测并吸氧;进行基础麻醉及局部麻醉。穿刺区优先选择穿刺难度较小、安全性较高的健侧股总静脉,若患者的双侧股总静脉存在大量血栓导致穿刺困难,可以选择右侧颈总静脉进行穿刺。采用Seldinger法穿刺健侧股总静脉,成功置入6 F静脉鞘管后行静脉造影检查,评估腔内血栓情况,并确定滤器释放位置。下腔静脉滤器装置由鞘管内0.035英寸亲水性涂层导丝引导到预定位置,滤器释放后,拔除鞘芯,利用装置外鞘造影明确滤器的位置和展开情况,确认滤器位置满意后置入鞘芯,推送下腔滤器装置外鞘越过滤器释放位置,防止后续操作造成滤器位置改变。拔除鞘芯后导入0.035英寸导丝引导4 F的 C2导管进入肺动脉主干,撤出C2导管更换猪尾导管行肺动脉造影明确肺动脉血栓累及的部位及范围。路图下,经带亲水涂层的可控导丝置入AngioJet血栓去除术装置连接血栓抽吸控制系统,于抽吸模式下缓慢操作抽栓导管,前进2 mm后退1 mm,推进速度控制在2 mm/s,反复抽吸2~3次。抽吸血栓结束后,更换猪尾导管造影检查评估血栓清除情况,血栓清除不满意之处给予局部喷淋30万IU的尿激酶(配100 ml生理盐水)后等待20~40 min,然后使用AngioJet吸栓导管再次抽吸血栓,完成整个抽栓过程后再次行肺动脉造影检查,直至左、右肺动脉主干动脉造影剂充盈(至少开通50%)。对于开通效果欠佳的肺叶,路图下,交换带有亲水涂层的可控导丝,经导丝交换溶栓导管,并将溶栓导管留置肺动脉主干或次级肺动脉中进行CDT治疗,溶栓导管体外段固定,防止患者活动时造成体内段位移或脱落。术后,患者转入重症医学科,经肺动脉溶栓导管体外端进行溶栓:24 h持续泵入12 500单位肝素钠进行抗凝治疗;给予瑞替普酶溶栓治疗,其中每6 mg于6 h内持续泵入,每3 h检测进行一次凝血功能检查,在活化部分凝血活酶时间(activated partial thromboplastin time,APTT)和凝血酶原时间(prothrombin time,PT)均小于2.5倍正常值的情况下,继续上述方案治疗24~48 h。24~48 h后,当患者的临床症状及临床相关检查结果改善,再次行肺动脉造影明确溶栓情况,根据肺动脉造影结果调整溶栓导管的位置或疗效满意后撤除溶栓导管。若患者的临床症状改善不明显,将瑞替普酶剂量调整为3 mg,继续溶栓24~48 h。撤除溶栓导管后,患者可转入普通病房,根据凝血功能和患者生命体征调整抗凝药物的剂量和使用时间。
1.3.3 术后处置
院内,术后每日皮下注射那曲肝素钙6150 IU,每12小时1次。监测患者的临床症状、凝血功能变化情况,将APTT维持在正常值(28.0~43.5 s)的1.5~2.0倍,PT维持在正常值(11.0~15.0 s)的1.5~2.5倍,纤维蛋白原降至1.0~1.5 g/L。院外,建议患者规律口服利伐沙班20 mg/d,共服用6~12个月。
1.4 观察指标及随访
收集患者入院后和术后48 h的辅助检查结果,主要包括心脏超声评估平均肺动脉压(mean pulmonary artery pressure,MPAP)、动脉血氧分压(arterial partial pressure of oxygen,PaO2)、血氧饱和度(oxygen saturation,SaO2)、监测血流动力学参数(包括收缩压、心率)用于计算休克指数(shock index,SI);SI=心率/收缩压。采用Miller指数(Miller index,MI)评估肺栓塞阻塞程度。根据手术造影结果和严重并发症发生情况观察技术成功率和手术成功率。技术成功定义为抽栓导管成功进入病变部位并完成抽栓;手术成功定义为抽栓导管在病变部位完成抽栓,且术中及术后未发生严重不良事件。严重不良事件包括所有原因导致的死亡,包括需要药物和电复律等处理的严重心律失常、心脏骤停、大量出血(血红蛋白降低超过5 g/dl,需要输血或再次手术)、脏器出血及颅内出血。记录ART术中AngioJet导管抽栓的累计激活时间、术后患者停留在重症监护治疗病房(intensive care unit,ICU)的时间及术后肾功能不全(肌酐值升高>25%或需要透析治疗)的发生情况。术后1、3个月对全部患者进行电话随访,了解患者有无不适症状、心肺功能不全的表现及严重不良事件发生;术后6个月患者进行门诊复查,行心脏超声、肺动脉CTA检查,了解患者的心肺功能和肺动脉内血栓情况。
1.5 统计学方法
应用SPSS 26.0软件对数据进行统计学分析,符合正态分布的资料以(±s)表示,组间比较采用两独立样本t检验;组内比较采用配对t检验;计数资料以n(%)表示;P<0.05为差异有统计学意义。
2 结果
2.1 临床指标的比较
术后,MPE组患者的SI、MI、MPAP均较术前明显降低,PaO2、SaO2均较术前明显升高,差异均有统计学意义(t=11.371、23.732、10.412、22.090、8.249,P<0.01);SMPE患者的SI、MI、MPAP均较术前明显降低,PaO2、SaO2均较术前明显升高,差异均有统计学意义(t=4.583、18.364、12.427、28.008、10.499,P<0.01)。(表1)
表1 两组患者手术前后SI、MI、MPAP、PaO2和SaO2的比较(±s)
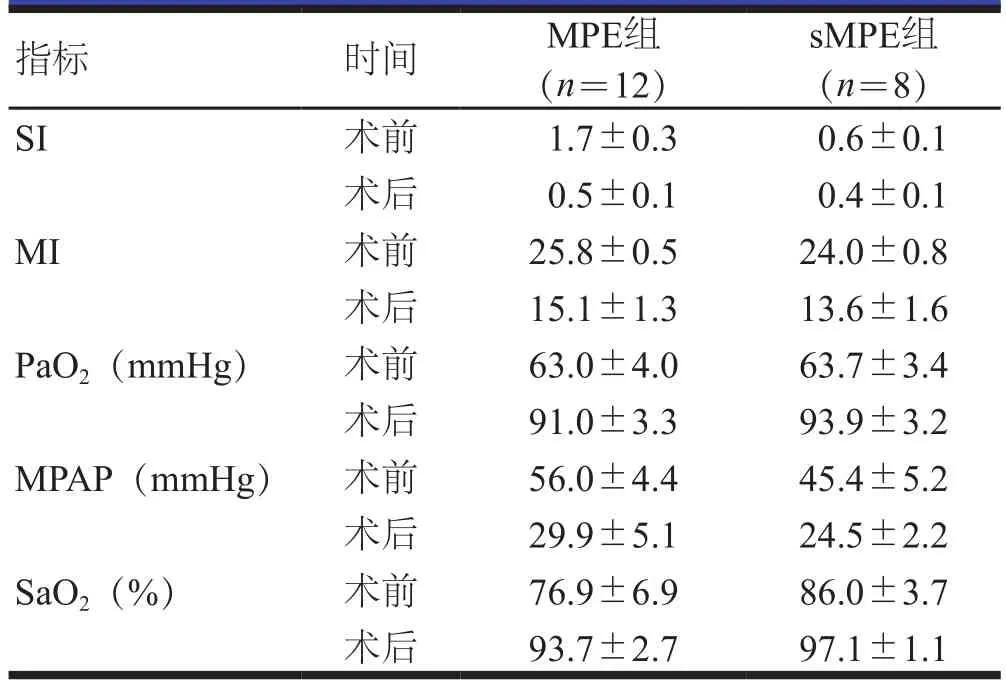
表1 两组患者手术前后SI、MI、MPAP、PaO2和SaO2的比较(±s)
指标 时间 MPE组(n=12)sMPE组(n=8)SI 术前 1.7±0.3 0.6±0.1术后 0.5±0.1 0.4±0.1 MI 术前 25.8±0.5 24.0±0.8术后 15.1±1.3 13.6±1.6 PaO2(mmHg) 术前 63.0±4.0 63.7±3.4术后 91.0±3.3 93.9±3.2 MPAP(mmHg) 术前 56.0±4.4 45.4±5.2术后 29.9±5.1 24.5±2.2 SaO2(%) 术前 76.9±6.9 86.0±3.7术后 93.7±2.7 97.1±1.1
2.2 手术及并发症发生情况
所有患者均成功完成了术中肺动脉造影并进行栓塞部位的AngioJet抽栓治疗,技术成功率为100%(20/20)。所有患者术中均出现一过性心动过缓,立即停止抽栓操作,并立即静脉推注阿托品0.5 mg,心动过缓症状于5~8 min内恢复至正常心率。术中,所有患者均出现了不同程度的心律失常。2例MPE患者出现了严重心律失常;1例经麻醉医师评估并给予积极处理后建议停止ART操作,立即留置溶栓导管后转入ICU;1例患者于手术室处置后心律失常症状得到控制并继续行吸栓治疗。术中,3例(MPE患者2例,SMPE患者1例)患者出现心脏骤停,经术中抢救后恢复正常心率,停止ART操作继续留置溶栓导管完成手术。术中及术后无大出血患者出现(仅1例SMPE患者于术后第2天出现牙龈出血);术后,6例患者出现一过性血尿症状,经水化治疗后症状改善,无肾功能损伤表现。所有患者的手术成功率为75%(15/20)。术中,MPE组患者的ART激活时间和术后停留ICU时间均长于SMPE组患者,差异均有统计学意义(P<0.05);MPE组与SMPE组患者的手术成功率、CDT溶栓时间及术中严重心律失常、心脏骤停的发生率比较,差异均无统计学意义(P>0.05)。(表2)
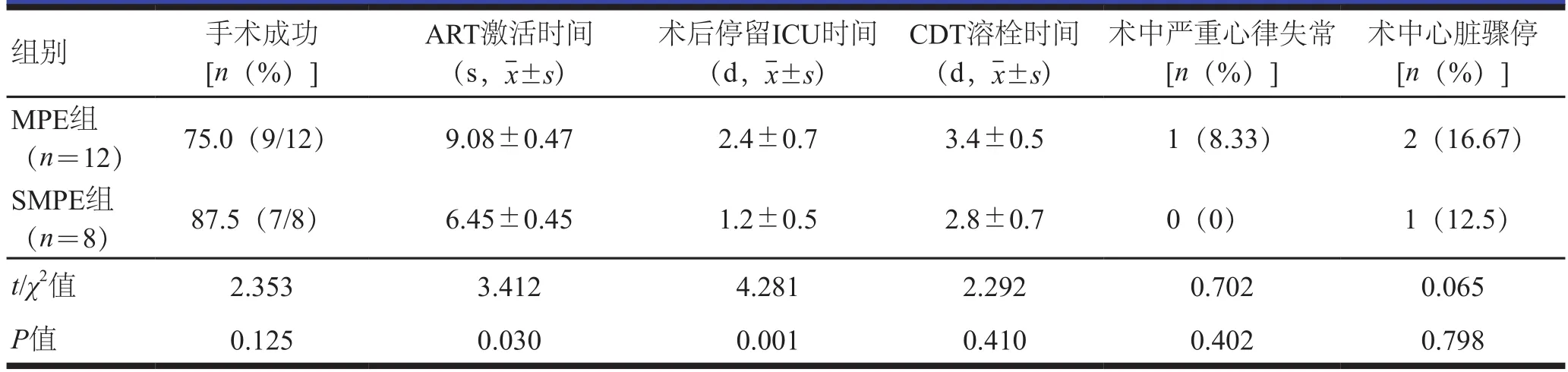
表2 MPE、SMPE患者的手术及并发症发生情况
2.3 随访
20例严重APE患者均顺利出院并完成随访,随访时间为3~8个月,平均(6.3±0.7)个月。随访期间,1例MPE患者术后3个月因车祸意外死亡导致随访终止,其余患者出院后均未出现胸闷、呼吸困难等症状。术后6个月,肺动脉CTA检查结果证实6例患者的肺动脉主干及其次级动脉未见明显血栓残留,13例患者肺动脉主干的血栓较术前明显减少。
2.4 典型病例
患者孙某,男性,61岁,因右下肢腓骨骨折内固定术后2个月,突发呼吸困难2小时入院。辅助检查:血压82/57 mmHg,SaO292%,肺动脉CTA提示双侧肺动脉栓塞;超声提示左下肢DVT。确诊为APE,入ICU经外周尿激酶系统溶栓效果不佳,行ART联合CDT综合治疗,术中置入下腔静脉滤器,见图1。
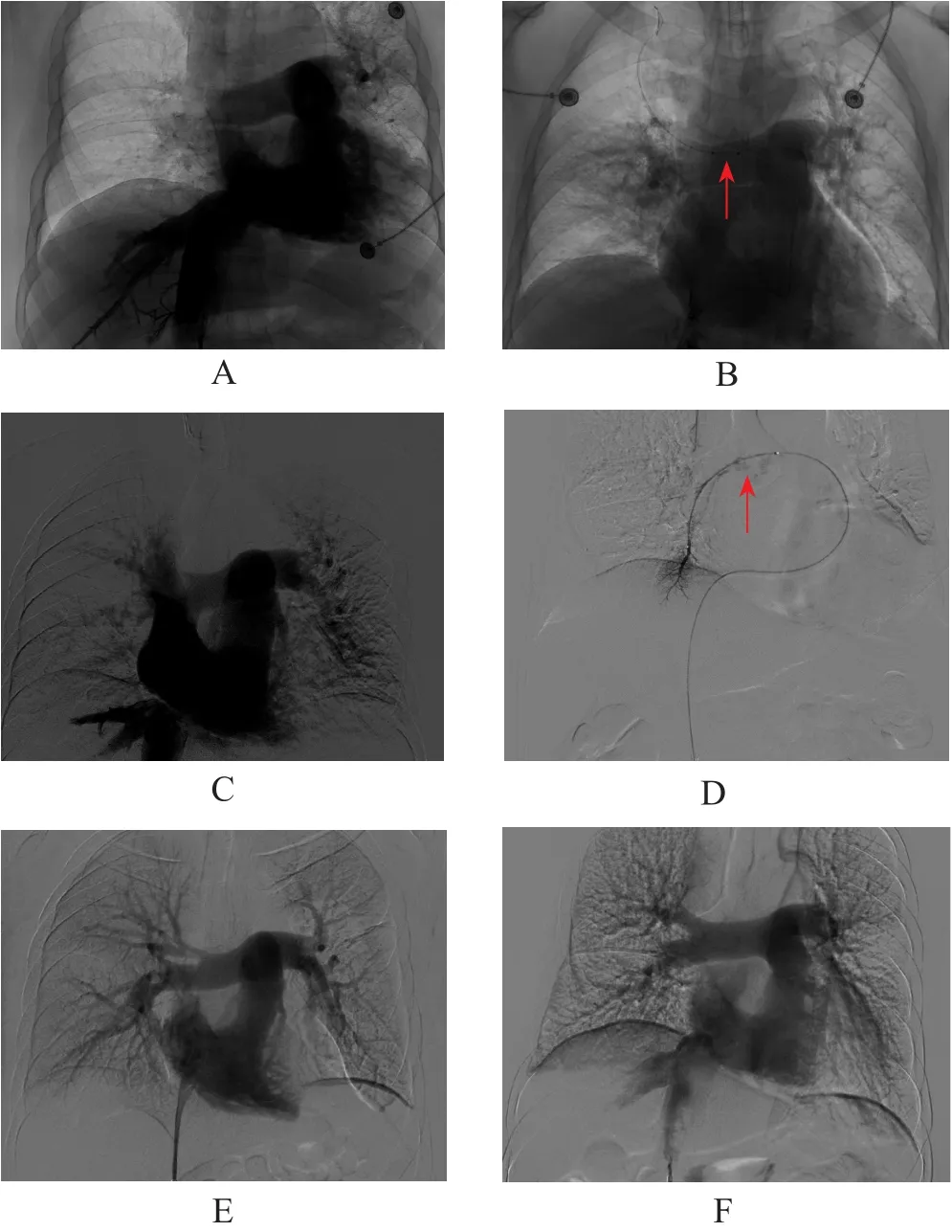
图1 典型病例
3 讨论
PE是一种常见且潜在致命的疾病。研究发现,接受治疗PE患者的平均短期病死率不到5%[6–8]。APE患者的短期预后很差,大部分APE患者在门诊或住院接受初始治疗。2008年欧洲急性肺栓诊断和管理指南根据临床表现及严重程度对PE进行风险分级,包括低风险PE、中风险或SMPE、高风险或MPE。MPE患者多伴有严重的并发症,而且病情进展更加迅速,住院期间的病死率达60%,死亡多发生于症状出现的1 h内,因此,发病后能否积极处置是MPE患者能否生存的关键[9]。SMPE虽然不伴有休克的表现,但其30 d内的病死率仍为15%~20%,并在疾病的发展过程中可出现严重的肺动脉高压和右心功能衰竭[10]。本研究中,患者术前的PaO2、SaO2均较低,心脏超声检查结果显示所有患者均存在不同程度的右心室扩大,部分患者存在BNP和CTnI异常升高,这些不仅提示患者具有右心功能不全和心肌受损的表现,也提示了患者预后不良。
尽管全身静脉溶栓是一种被推荐的MPE疗法,但这种方法的临床益处尚未完全证实[11]。根据国际肺栓塞注册合作研究(International Pulmonary Embolism Registration Cooperative Research,ICOPER)登记的数据,全身静脉溶栓治疗并不能明显降低MPE患者的病死率。研究发现,接受溶栓治疗患者90 d病死率为46.3%,而未接受溶栓治疗的患者90 d病死率为55.1%。肺栓塞的复发未因溶栓而改变,接受溶栓组与未接受溶栓组患者的复发率均为12%[12]。全身溶栓治疗MPE的临床疗效不佳可能与闭塞性肺动脉高压难以获得通畅有关,因此,2014年欧洲心脏病学会指南建议对高危APE患者采用手术取栓或导管引导治疗作为全身溶栓的替代方案[13]。
对于所有疑似APE的患者应该立即给予抗凝治疗[14],对于血流动力学不稳的的APE患者应该采取更加积极的治疗措施。随着血管腔内介入治疗的发展,CDT、经皮机械性血栓清除术(percutaneous mechanical thrombectomy,PMT)、腔静脉滤器置入和经皮机械性碎栓等腔内介入技术已成为APE的主要治疗手段[15]。根据欧洲心脏病学会发布的指南,全身性低血压和休克是APE患者接受紧急溶栓治疗的公认适应证[16-18]。同时,对于血流动力学稳定的SMPE患者,肺动脉循环中存在大量的血栓,若不能进行及时、有效的清除,患者预后通常较差。因此,无论对于MPE还是SMPE的患者,迅速减少血栓负担、恢复肺动脉内血流动力学是整个治疗的关键。
AngioJet作为一种新型的血栓清除技术,具有微创、安全、有效等特点,越来越受到临床重视,其工作流程是首先开启喷药模式,可以使溶栓药物在高压喷射下击碎血栓,使药物与血栓内部充分接触,发挥最大溶栓药效,后调整为抽吸模式,利用导管头端形成负压持续抽吸血栓,使阻塞的血管立即通畅[19]。AngioJet装置在快速对肺动脉内血栓进行清除的同时,可以破坏完整的血栓,后续喷淋的溶栓药物可以直接与血栓内部接触,提高溶栓效率,减少溶栓药物使用剂量,降低全身脏器出血的风险。本研究中,16例无绝对溶栓禁忌证的患者均进行了局部喷淋溶栓治疗,未发生严重的出血事件。ART易于操作,技术成功率高。本研究结果显示,虽然患者有溶栓禁忌证或溶栓失败,ART仍然能够安全、有效地治疗MPE和SMPE患者。本研究中的患者经过ART治疗均有效,临床症状改善明显,PaO2升高,MPAP降低,影像学表现改善明显;另外,SMPE患者主要表现为肺动脉高压和右心负荷加重,经ART治疗后,PAP降低更加明显;而MPE患者血栓阻塞的范围更加广泛,经ART治疗可更多地减少血栓负担,MPE组患者的MI和SI改善得更加明显,提示对于血流动力学不稳定的MPE患者,ART治疗更能有效地挽救生命[12]。
AngioJet抽栓系统主要作用于肺动脉主干或次级动脉,要求血管直径>3 mm,否则操作中可能导致肺动脉血管破裂。ART激活时间要密切关注患者的生命体征变化,并做好及时停止操作并进行抢救的准备。同时严格限制激活时间,单次连续激活时间应小于10 s,过长时间的激活可能造成严重的心律失常、心脏骤停或呼吸困难,从而诱发心力衰竭或呼吸功能不全。在实际抽吸过程中,所有患者术中均出现一过性心动过缓及心律失常,尤其是抽吸持续时间超过7~10 s,这些循环失代偿的临床症状在最初抽吸的6~8 s时出现,然后再次激活时缩短至2~4 s再次出现。其原因可能是由于碎栓过程中产生的腺苷和缓激肽等成分可激活肺动脉和右心室张力感受器导致心律失常和低血压[20];也可能是长时间的激活使吸栓导管产生了热效应刺激,使心脏生理功能紊乱。DSA观察下,当导管走行在右心房中时更容易出现心动过缓,这可能也与导管刺激心房壁的牵张反射器使迷走神经兴奋而致使心率一过性降低有关。与ART相关的并发症还包括高血钾和血红蛋白尿症,这与术中大量红细胞破坏等因素相关,因此,建议只要术中患者的PE症状改善即可停止抽栓,尽量减少激活时间。其他并发症包括肾功能不全。对于轻微并发症,不需要特殊处置,可自行消失。
溶栓是中高危APE患者的一线治疗方法[21]。瑞替普酶是将纤溶酶原转化为纤溶酶,纤溶酶降解纤维蛋白以溶解血栓。外周静脉给药是一种有效的治疗方法,但存在较高的大出血风险,包括颅内出血、脏器出血,这可能危及生命或导致永久性神经功能缺损。CDT输注溶栓剂时,将带有一个或多个侧孔的导管直接导入血栓,使血栓局部保持较高的药物浓度,同时全身能够保持较低的血药浓度。与全身溶栓相比,CDT可以提高局部血栓内溶栓剂的浓度,减少总给药剂量,降低出血并发症发生率。CDT导管的管径更小,主要用于开通ART流变抽栓系统不能直接处理的次级肺动脉。CDT可以使次级肺动脉内的血栓迅速消溶,及时改善肺血流和右心功能,减少或避免休克或低血压的发生,降低患者病死率及后期慢性血栓栓塞性肺动脉高压的发生率[22]。单独CDT治疗受限于需要较长的给药时间,在完成溶栓方案后,进行重复静脉造影检查,以确定狭窄或血栓残留区域,为后续撤除导管和移动导管提供依据。同时,CDT治疗需要在ICU进行监测,额外医疗费用增加。与单独的全身治疗和CDT治疗相比,将ART与CDT联合使用可以减少溶栓输注次数和总剂量。不需要长时间的溶栓药物输注和ICU监测。然而,目前支持使用这些血管内技术的证据较少,需要更多的研究来明确证明其有效性和安全性。
综上所述,在选定的患者中,采用ART联合CDT治疗APE是一种简单、安全且耐受性良好的治疗方式,无论是MPE还是SMPE患者都有较高的手术成功率和较低的并发症发生率。对于存在其他治疗禁忌证的APE患者,以及经标准抗凝治疗和溶栓治疗未发生改善的APE患者,但仍表现出严重循环衰竭症状的患者,建议更多地采用此方法。本研究存在一定的不足之处,如样本量少,需要进一步的多中心前瞻性研究以提供更多的临床证据;随访时间较短,不能分析ART联合CDT治疗对APE患者长期生存情况的影响,期待更多的长期观察研究为ART联合CDT治疗APE的远期疗效提供客观依据。

