超声刀辅助颈动脉体瘤切除术的疗效观察
闻荻豪 孙羽东 李 昱 朱 江 王诗颖 魏小龙 赵志青 吴雅妮
1解放军海军军医大学第一附属医院血管外科,上海 200433
2解放军海军军医大学第一附属医院甲乳外科,上海 200433
颈动脉体瘤(carotid body tumor,CBT)是一种罕见的肿瘤,由颈动脉体的副神经节细胞异常增殖引起[1]。CBT属于副神经节瘤,而副神经节瘤的总体发病率较低,仅占头颈部肿瘤的0.6%[2-3]。而副神经节瘤并不完全是良性肿瘤,研究显示该疾病的恶性率为6%~19%[4]。CBT主要的治疗方法是手术切除,由于CBT附着于颈动脉的外膜,且肿瘤具有高度血管化的特点,通常涉及颅神经,而手术视野暴露仅在有限的范围内,因此手术难度较高。手术切除后的并发症发生率较高,如神经损伤、脑卒中和出血性休克等。超声刀是利用刀头超声高频振动,使组织产生局部高温,加速蛋白变性凝固,完成切割的同时快速热凝血管,热损伤范围小,烟雾少,能更好地保护手术视野等[5]。目前超声刀广泛应用于各种头颈部外科手术中,并具有减少术中出血量、降低术后并发症发生率等明显优势[6-7],解放军海军军医大学第一附属医院自2017年开始利用超声刀独特的优势辅助切除CBT。目前应用超声刀治疗CBT鲜少报道,因此本研究回顾性分析超声刀辅助下行CBT切除术后患者的临床效果及预后,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年5月至2020年5月在解放军海军军医大学第一附属医院进行治疗的CBT患者临床资料。纳入标准:(1)根据术前检查及术后病理诊断为CBT患者;(2)在本中心实施CBT切除术;(3)均行颈动脉计算机体层血管成像(computed tomography angiography,CTA)、磁共振血流成像(magnetic resonance angiography,MRA)和(或)彩色多普勒超声检查。排除标准:(1)患有恶性肿瘤者;(2)合并严重器质性疾病患者;(3)术行前栓塞者;(4)既往颈部手术史患者。根据纳入与排除标准,纳入96例患者,根据手术方式不同,分为常规手术组(n=56)和超声刀辅助组(n=40)。根据影像测量肿瘤直径将颈动脉体瘤进行shamblin分型[8],超声刀辅助组Ⅰ型患者10例,Ⅱ型患者16例,Ⅲ型患者14例;常规手术组Ⅰ型患者11例,Ⅱ型患者19例,Ⅲ型患者26例;两组患者临床特征比较,差异无统计学意义(P>0.05,表1),具有可比性。
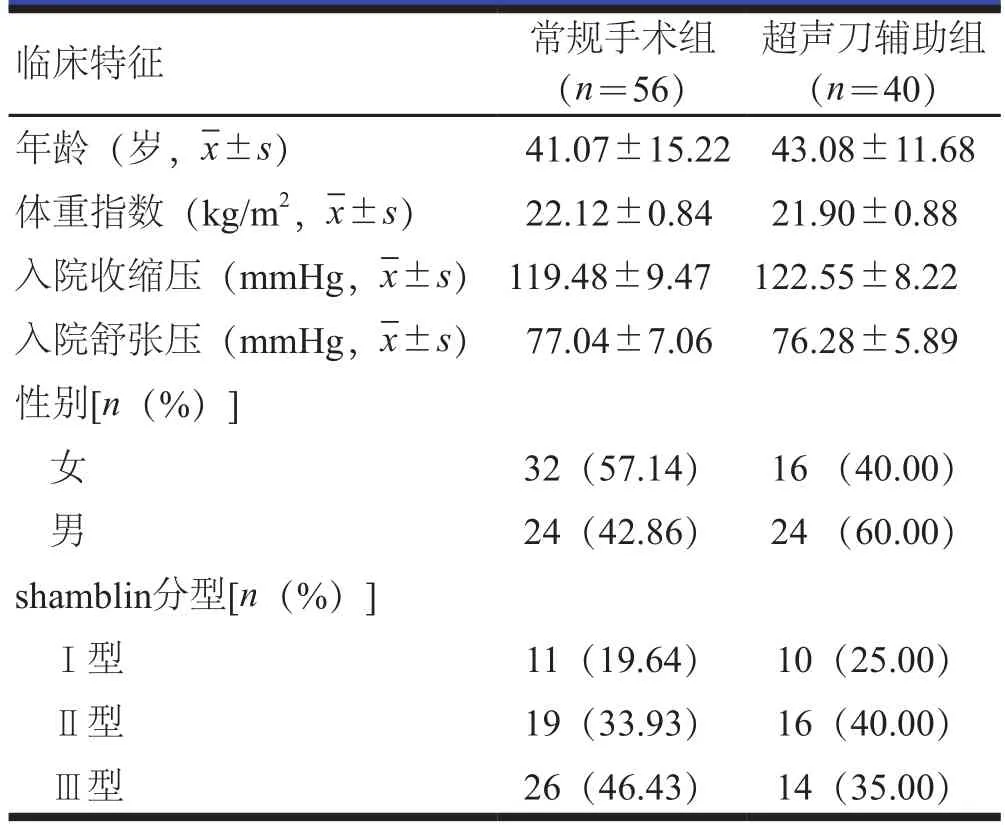
表1 两组患者临床特征
1.2 术前准备
所有患者均在术前进行影像学检查及实验室检查,并对心肺功能及全身情况进行系统评估,并制定完备的手术方案。关于术前栓塞存在较多争议,鉴于术前栓塞可能减少术中出血影响本研究的结果,因此所有患者均未行术前栓塞,行I期手术。CBT的滋养血管多数来源于咽升动脉,但大部分CBT由多血管供血[9],故术前根据影像学判断CBT主要滋养血管,并由经验丰富的血管外科医师评估术中是否需要行血管重建。
1.3 手术过程
患者均气管插管行全身麻醉,根据shamblin分型并结合肿瘤直径于颈部胸锁乳突肌前缘作斜行切口,依次分离皮下组织、颈深筋膜、胸锁乳突肌前缘,暴露颈血管神经鞘并显露瘤体,沿瘤体后壁钝性分离出迷走神经并悬吊,再依次剥离显露颈内动脉和颈外动脉血管壁,将瘤体与血管壁相分离,最后沿颈动脉体瘤下极将颈动脉分叉与瘤体剥离,予以血管缝线缝扎颈动脉滋养血管,再将血管壁上残留的包膜剥离,充分止血后关闭颈动脉鞘,放置引流管,逐层对位关闭手术切口。超声刀辅助组在常规手术组操作基础上,在显露瘤体后开始使用超声刀进行外膜组织的切开与分离,以及手术区域淋巴结的清扫;常规手术组采用电刀、双极电凝配合精细组织剪剥离瘤体,手术均由本中心同一技能娴熟的手术团队进行。
1.4 观察指标及判定标准
统计并比较两组患者的手术情况(术中出血量、手术时长、术中血管重建情况和住院时间)和不良事件(短暂性颅神经损伤和永久性颅神经损伤)。短暂性颅神经损伤及永久性颅神经神经损伤以损伤在术后6个月是否恢复进行区分[10-11]。统计两组shamblin分型为Ⅲ型患者的术中出血量、并发症和不良事件。
1.5 随访
术后3个月、6个月、12个月进行到院复查或电话随访,随访及并发症评估均由一名经验丰富血管外科医师进行。
1.6 统计学方法
应用SPSS 23.0统计软件对数据进行分析,计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以n(%)表示,组间比较采用χ2和Fisher检验;非正态分布资料以M(P25,P75)表示,组间比较采用秩和检验;当P<0.05为差异有统计学意义。
2 结果
2.1 手术情况与并发症发生率比较
超声刀辅助组患者手术时间及住院时间短于常规手术组患者,术中出血量少于常规手术组患者,短暂性及永久性神经损伤发生率低于常规手术组患者,差异有统计学意义(P<0.05);两组患者术中血管重建率比较,差异无统计学意义(P>0.05)。(表2)
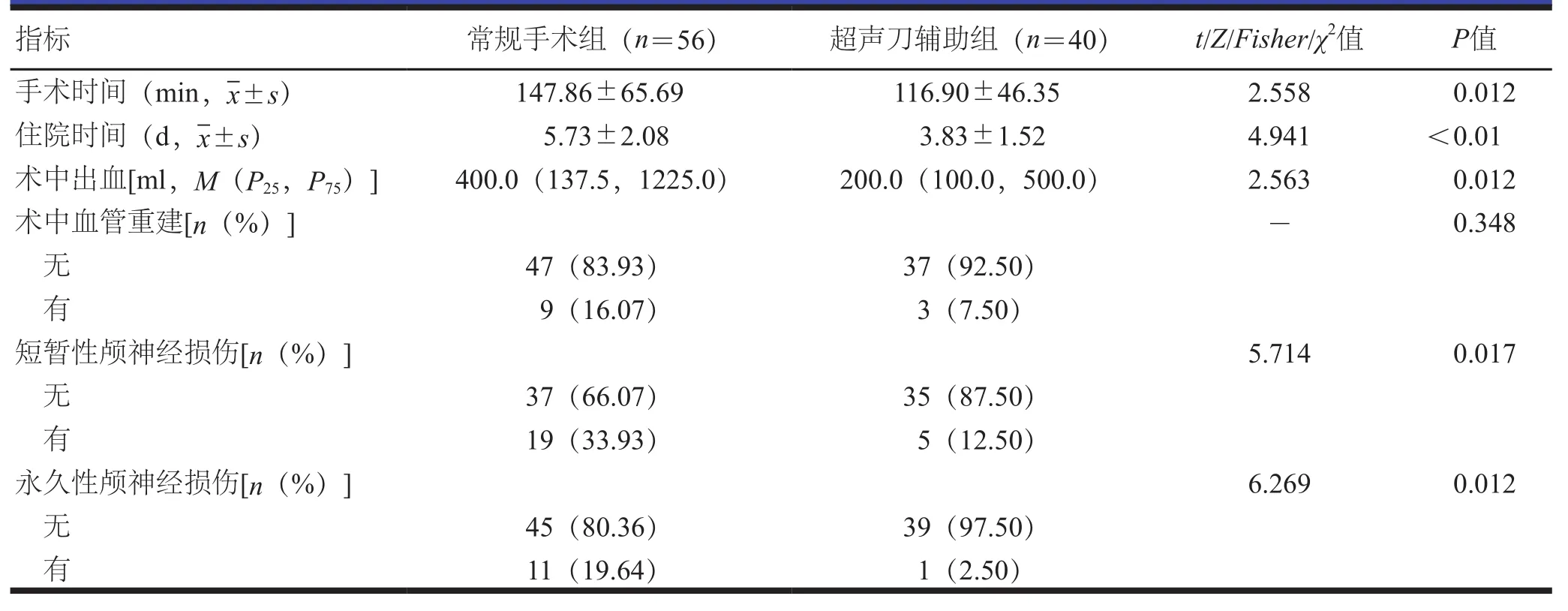
表2 两组患者手术情况及并发症发生率比较
2.2 Ⅲ型患者术中出血量及并发症发生率比较
超声刀辅助组shamblin分型为Ⅲ型患者的术中出血量低于常规手术组shamblin分型为Ⅲ型患者,短暂性及永久性颅神经损伤发生率均低于常规手术组shamblin分型为Ⅲ型患者,差异有统计学意义(P<0.05)。(表3)
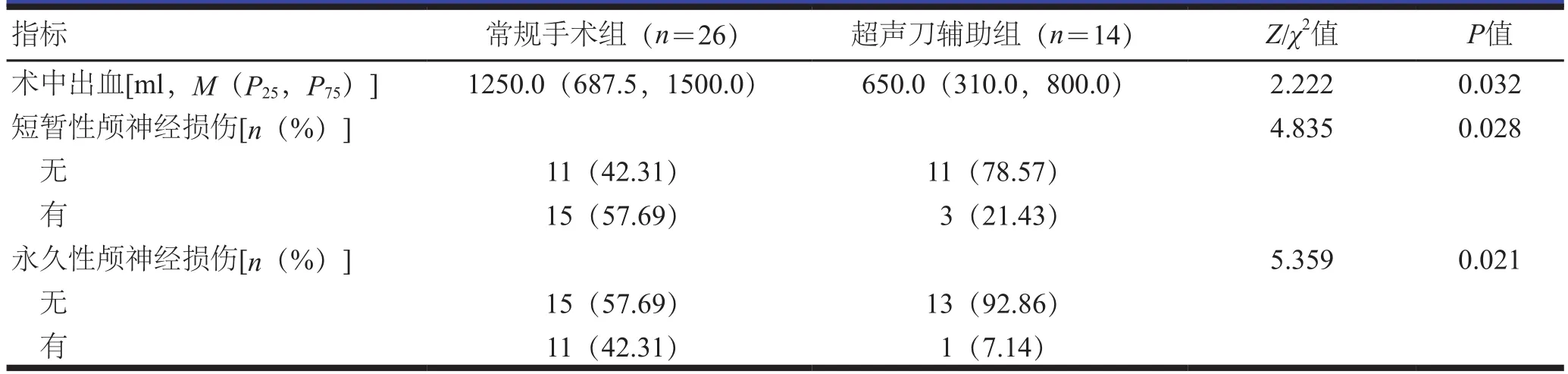
表3 两组shamblin分型为Ⅲ型患者的术中出血量及并发症发生率比较
3 讨论
CBT是一种罕见的肿瘤,随着人们健康意识的增强及检查技术的提升,疾病检出率呈上升趋势。CBT虽然多数是良性病变,但随着肿瘤的生长侵犯血管,影响神经功能,故早期发现及时治疗尤为重要。CBT切除术后存在多种并发症,主要包括脑梗死、血管损伤、短暂性颅神经损伤及永久性颅神经损伤等[12]。脑梗死通常是术中血管重建而阻断血管导致的,因此术中进行脑保护、血压管理是十分重要的。血管损伤常见于肿瘤侵犯血管,存在粘连严重或剥离困难等情况,研究表明,血管损伤及术中出血与CBT的shamblin分型相关[13],当出现血管损伤,本中心目前采取人工血管置换的方法。短暂性颅神经损伤常与术中神经牵拉导致神经挫伤、电凝及热凝导致的热传导损伤等因素相关。而永久性颅神经损伤则与肿瘤侵犯神经粘连过紧,手术剥离导致的神经离断损伤有关,神经损伤包括喉返神经、迷走神经、交感神经及面神经等[14]。
超声刀较电刀有凝血更迅速、创伤更小及术野保护更好等特点,并且超声刀不会产生电生理干扰,工作时的局部温度控制在70~120℃,热损伤更小[15]。顾占国等[6]认为超声刀在腮腺瘤手术中应用能减少面神经损伤发生率,缩短手术时间。杨立国等[7]验证了超声刀在开放甲状腺手术中安全性及治疗效果都优于电刀。Crispi等[16]证实了在腹腔镜手术中,即使血压超过正常水平,超声刀也可以安全地封闭直径达8 mm的动脉,以防止或控制出血。在本研究中,超声刀辅助组患者手术时间及住院时间短于常规手术组患者,术中出血量少于常规手术组患者,短暂性及永久性颅神经损伤发生率低于常规手术组患者,差异有统计学意义,这归因于超声刀自身的优势,且与国内外研究结果相符[16]。超声刀虽有诸多优势,但仍避免不了热损伤,邓文杰等[17]通过将超声刀应用于甲状腺手术的临床研究证实,超声刀应用过程中需要距重要神经或血管等结构3 mm及以上。而CBT与腮腺瘤及甲状腺肿瘤同样具有血供丰富及毗邻颅神经等特点。因此本研究超声刀辅助组短暂性及永久性颅神经损伤发生率低于常规手术组患者,但仍有神经损伤发生,可能与部分CBT具有局部侵袭或体积过大,导致肿瘤与周围组织粘连过紧或过近,剥离困难或无法给予超声刀的使用留出安全距离有关。本中心总结超声刀在CBT切除术中使用的操作细节:(1)超声刀使用前,依然需要钝性或锐性剥离重要血管、神经结构(CBT滋养血管、颈内动脉、颈外动脉、喉返神经及迷走神经等),并与重要结构保持3 mm及以上距离,并可用纱条填塞或生理盐水湿润纱布隔离保护;(2)超声刀每单次使用时间不宜过长,尽量控制在5 s以内;(3)连续多次使用超声刀后需物理降温刀头后继续使用;(4)进行切割时应每次少量钳夹组织,分多次进行。shamblinⅢ型CBT肿瘤大且完全包绕相邻的血管[8],研究显示,shamblin分型为Ⅲ型患者术中出血量、手术时间及神经并发症的发生率均多于或长于其他两种分型[18-19],而本研究结果显示,超声刀辅助组的术中出血量低于常规手术组,短暂性及永久性颅神经损伤发生率均低于常规手术组,差异有统计学意义,且超声刀辅助组的优势在shamblin分型为Ⅲ型患者也较明显。超声刀在颈动脉体瘤切除术中展现出一定的应用价值,且在出血量更多、神经损伤发生率更高的shamblinⅢ型肿瘤的切除中同样能降低并发症的发生率。
综上所述,超声刀辅助切除CBT能改善手术结局和减少术后并发症发生率,但不能完全避免术后并发症发生,为CBT手术器具的选择提供了临床证据,也为进一步优化CBT手术提供了可行的方案。

