益气活血解毒中药调控VEGF通路抑制单侧输尿管结扎大鼠对侧肾脏淋巴管生成的研究
高晓萌,赵绮悦,刘子骞,刘令今,陈格格,郝 娟,王香婷,2,3,许庆友,2,3*
1河北中医学院研究生学院;2河北省中西医结合肝肾病证研究重点实验室;3河北中医学院中西医结合学院,石家庄 050091
近年来,慢性肾脏病(chronic kidney disease,CKD)发病率明显增高,依据国家及人种不同为7%~12% ,其中中国的发病率为10.8%[1]。就CKD病因而言,单侧梗阻性肾脏损伤持续进展可以导致慢性肾衰竭的发生,其病理改变是肾间质纤维化(renal interstitial fibrosis,RIF)[2]。益气活血解毒中药是在总结国家级名老中医赵玉庸教授治疗肾脏病的经验基础上,结合肾脏病理改变及炎症损伤机制,采用黄芪15 g、茯苓10 g、芍药12 g、地龙6 g、僵蚕6 g、黄芩10 g、金银花10 g、大黄6 g组成,具有补虚扶正、解毒通络的作用,用于慢性肾脏病的治疗获得满意的临床效果。动物实验研究证实益气活血解毒中药可以抑制氧化应激、炎症损伤等途径减轻梗阻性肾病损伤,还可以调控自噬等途径减轻对侧肾脏的损伤[3-5]。本研究发现益气活血解毒中药可以调控VEGF途径,抑制单侧输尿管梗阻(unilateral ureteral obstruction,UUO)大鼠对侧肾脏淋巴管生成,减缓肾脏病进展。本研究采用UUO制备梗阻性肾病实验动物模型,给予益气活血解毒中药及醛固酮受体阻断剂依普利酮治疗,观察钠氯协同转运蛋白(Na+-Cl-cotransporter,NCC)、血管内皮生成因子C(vascular endothelial growth factor C,VEGF-C)、血管内皮生长因子受体-3(vascular endothelial growth factor receptor-3,VEGFR-3)、淋巴管内皮透明质酸受体(lymphatic vessel endothelial hyaluronic acid receptor-1,LYVE-1)、平足蛋白(podoplanin,PDPN)等淋巴管新生相关指标以及α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)、波形蛋白(vimentin)等细胞表型转化指标的表达,探讨梗阻性肾病大鼠对侧肾脏淋巴管新生并参与肾间质纤维化的通路以及中药的保护机制。
1 材料与方法
1.1 动物及分组
清洁级雄性Wistar大鼠40只,7周龄,体重200±20 g,购买于河北医科大学实验动物中心,动物生产许可证号:SCXK(冀)2018-004。按照体质量对大鼠进行编号,根据随机数字表随机分为假手术组(Sham)、单侧输尿管结扎组(UUO)、依普利酮治疗组(EPL)和中药治疗组(TCM),每组10只。购买后于河北中医学院动物室适应性饲养一周,动物使用许可证号:SYXK(冀)2017-005,光照时间为7∶00~18∶00。自由饮食,环境温度24±1 ℃,湿度55%±5%。
1.2 仪器和设备
RM2245型石蜡切片机(德国Leica公司);CTS SP8激光共聚焦扫描显微镜(德国Leica公司);ODYSSEY双色红外激光成像扫描仪(美国LICOR公司);DYY-12C型电泳仪及电泳槽(北京六一仪器厂);半干转膜仪(美国 BIO-RAD公司);台式高速冷冻离心机(上海力申仪器公司),VANOX DM-10AD型显微照相仪(日本OLYMPUS株式会社)。
1.3 药物与试剂
依普利酮饲料,美国Pfizer公司产品,辉瑞公司提供原粉,由日本Research Diets Inc公司根据动物的进食量与药物用量100 mg/kg/d按1.25 g/kg加入饲料中,折合成大鼠药物用量为100 mg/kg/d[6,7];益气活血解毒中药(组成:黄芪2 袋、茯苓2袋、芍药2袋、地龙1袋、僵蚕1袋、黄芩2袋、金银花2袋、大黄1袋)由广东一方制药有限公司提供中药配方颗粒,规格为每袋装2.0 g,相当于临床使用量饮片10 g。按比例混匀煎煮15 min,水煎液含生药0.43 kg/L,参照徐叔云《药理实验方法学》折合大鼠用量为14 g/kg/d给药。NCC抗体(Abcam公司,批号GR3274565-3);VEGF-C抗体(Immunoway公司,批号YT5297);VEGFR-3抗体(Immunoway公司,批号YT5878);LYVE-1抗体(Novus公司,批号1808R01);PDPN抗体(Bioss公司,批号AD06234578);Vimentin抗体(Abcam公司,GR3186827-16);α-SMA抗体(Abcam公司,批号GR3252482-10);GAPDH抗体(Epitomics公司,批号Y123103P);β-actin抗体(Abcam公司,批号GR305367-39)。
1.4 造模方法及给药
实验动物适应性喂养1周后,UUO组、EPL组和TCM组采用结扎单侧输尿管方法复制梗阻性肾病模型,异氟烷吸入麻醉后,于左侧中腹部切开皮肤,游离左侧输尿管,在输尿管上1/3处用丝线结扎,切断输尿管,逐层缝合皮肤;Sham组仅游离输尿管但不结扎。术后1天开始给药,EPL组给予依普利酮100 mg/kg/d加入饲料中喂养,TCM组化瘀解毒中药煎剂14 g/kg/d灌胃,Sham组和UUO组给予等量普通饲料。10天后,异氟烷吸入麻醉,股动脉取血,摘取对侧肾脏(右侧肾脏),沿纵轴切开,部分组织4%多聚甲醛中固定、石蜡包埋,切片行常规HE、Masson及免疫组化染色;部分组织OCT包埋,切片行常规免疫荧光染色;剩余组织-80 ℃保存备用,用于分子生物学检测。
1.5 指标检测方法
1.5.1 HE、Masson染色观察肾脏纤维化改变
HE染色:将石蜡切片置于二甲苯脱蜡,梯度乙醇复水至蒸馏水;PBS清洗,苏木精滴染5 min;PBS清洗,伊红复染3 min,蒸馏水稍洗30 s,常规乙醇梯度脱水、二甲苯透明后,中性树胶封固。光学显微镜观察细胞形态。
Masson染色:将石蜡切片置于二甲苯脱蜡,梯度乙醇复水至蒸馏水;PBS清洗,苏木精滴染5 min;PBS清洗,Masson丽春红酸性复红液复染5 min,2%冰醋酸水溶液浸洗片刻,1%磷钼酸水溶液分化3~5 min,不经水洗,苯胺蓝复染5 min,以0.2%冰醋酸浸染片刻,常规乙醇梯度脱水、二甲苯透明后,中性树胶封固。光学显微镜观察胶原表达。
1.5.2 免疫荧光法检测NCC、LYVE-1、VEGF-C、VEGFR-3、α-SMA、Vimentin的表达
将冰冻切片用PBS冲洗3次,加入0.01 mol枸木缘酸缓冲液(PH6.0)进行抗原修复;滴加10%山羊血清,室温孵育1 h;倾倒多余的山羊血清,滴加一抗(浓度为1∶100),4 ℃过夜;PBS清洗,滴加二抗(避光),37 ℃恒温水浴箱内孵育1 h;滴加DAPI液(避光)室温孵育10 min;滴加抗荧光衰减封片剂(避光)封片。
1.5.3 免疫组化法检测LYVE-1、PDPN、VEGF-C、α-SMA、Vimentin的表达
采用免疫组化法观察肾组织中LYVE-1、PDPN、VEGF-C、α-SMA、Vimentin的表达,石蜡切片脱蜡入水,修复抗原后加入一抗,4 ℃过夜;PBS清洗3次,每次5 min,滴加生物素标记的二抗,37 ℃孵育30 min,同上清洗3次,滴加辣根过氧化物酶标记链酶卵白素工作液,37 ℃孵育30 min,同上清洗3次,DAB显色3~5 min,自来水充分冲洗,终止显色;苏木精复染,脱水,透明,封片。显微镜下观察蛋白表达的位置及染色强弱,以镜下出现棕黄色为阳性表达,同时以PBS替代二抗作为阴性对照。
1.5.4 Western blot检测NCC、VEGF-C、VEGFR-3、α-SMA的表达
取新鲜肾脏组织100 mg,用预冷的生理盐水冲洗,加入含蛋白酶及磷酸酶抑制剂的裂解液400 μL,匀浆取上清,测蛋白浓度后,根据检测指标以20~50 μg样品进行电泳,电泳后转膜,5%脱脂牛奶封闭,加入一抗NCC、VEGF-C、VEGFR-3、α-SMA(1∶500~1∶1 000),4 ℃过夜,清洗,室温孵育二抗(1∶20 000),洗掉多余二抗后Odyssey红外显影仪扫描显影,与所得内参进行比较。
1.6 统计学方法
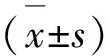
2 结果
2.1 肾脏组织病理学改变
由图1HE染色结果可知:Sham组大鼠肾脏结构未见明显异常,肾间质少量炎性细胞浸润,肾小管无扩张;UUO组可见间质出现水肿情况,较多炎性细胞浸润,部分肾小管上皮细胞空泡变性或出现坏死脱落,肾小球未见明显病变;EPL组及TCM组肾脏损伤较UUO组轻微。Masson结果显示:Sham组肾间质仅有少量纤维成分,结构清晰;UUO组肾间质胶原成分增多;EPL组及TCM组与UUO组比较,肾间质胶原成分有所减少。
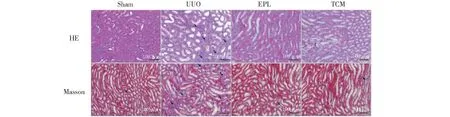
图1 HE、Masson染色观察UUO大鼠对侧肾组织病理改变Fig.1 The pathomorphology of contralateral kidney of UUO rats by HE and Masson staining (Scale bar=100 μm)
2.2 免疫组化法检测α-SMA、Vimentin的表达
免疫组化法显示Sham组α-SMA及Vimentin仅表达于血管,肾间质及上皮细胞表达较少;UUO组表达明显增强,肾间质及上皮细胞可见到阳性表达;EPL组及TCM组α-SMA、Vimentin局部呈中度表达,间质可见少量表达,较UUO组明显减弱(见图2)。
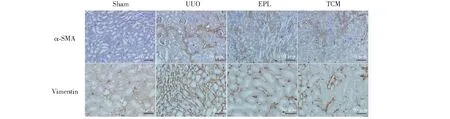
图2 免疫组化染色检测UUO大鼠对侧肾组织α-SMA、Vimentin的表达Fig.2 Expression of α-SMA and Vimentin in contralateral kidney of UUO rats with immunohistochemistry
2.3 免疫荧光法检测NCC的表达
由图3可知,NCC仅在Sham组对侧肾脏的远曲小管管腔亲水侧表达;UUO组大鼠对侧肾脏NCC表达明显增强;EPL组及TCM组表达范围及强度较UUO组明显减弱。
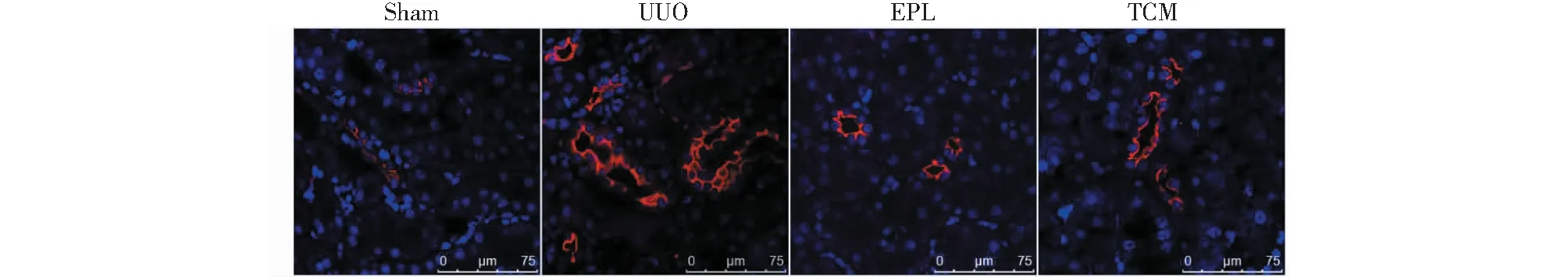
图3 免疫荧光检测UUO大鼠对侧肾组织NCC表达Fig.3 Expression of NCC in contralateral kidney of UUO rats with immunofluorescence(Scale bar=75 μm)
2.4 免疫荧光及组化法检测VEGF-C的表达
VEGF-C在Sham组大鼠对侧肾脏表达较弱;在UUO组VEGF-C表达明显增强,主要见于肾小管上皮细胞、肾间质细胞;EPL组及TCM组VEGF-C的表达较UUO组明显减弱(见图4)。
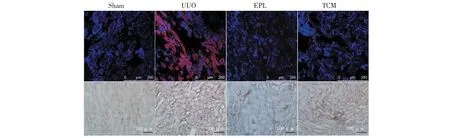
图4 免疫荧光及免疫组化检测UUO大鼠对侧肾组织VEGF-C的表达Fig.4 Expression of VEGF-C in contralateral kidney of UUO rats with immunohistochemistry and immunofluorescence
2.5 免疫荧光及组化法检测VEGFR-3、LYVE-1、PDPN的表达
VEGFR-3、LYVE-1、PDPN在Sham组大鼠对侧肾脏表达较弱;在UUO组VEGFR-3、LYVE-1、PDPN表达明显增强,主要见于对侧肾脏血管周围和肾小管间质;EPL组及TCM组VEGFR-3、LYVE-1、PDPN的表达较UUO组明显减弱(见图5)。
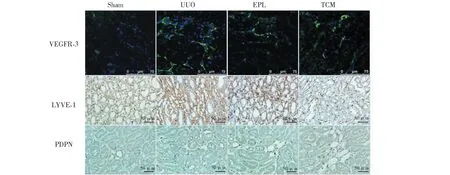
图5 免疫荧光及免疫组化检测UUO大鼠对侧肾组织VEGFR-3、LYVE-1、PDPN的表达Fig.5 Expression of VEGFR-3,LYVE-1 and PDPN in contralateral kidney of UUO rats with immunohistochemistry or immunofluorescence
2.6 免疫荧光法检测LYVE-1与α-SMA及Vimentin的表达
由图6可知,免疫荧光染色及激光共聚焦显微镜观察LYVE-1与α-SMA 共表达,结果显示Sham组大鼠仅在对侧肾脏血管周围、肾小管间质有少量LYVE-1(绿色)表达;UUO组对侧肾脏血管周围及肾小管间质LYVE-1表达明显增多,与α-SMA(红色)表达相关并呈现共表达(黄色);EPL组及TCM组LYVE-1与α-SMA表达均较UUO组减弱。LYVE-1 与Vimentin的共染结果与α-SMA相似(见图7)。

图6 免疫荧光检测大鼠肾组织LYVE-1与α-SMA表达Fig.6 Expression of LYVE-1 and α-SMA in UUO rats with immunofluorescence(Scale=75 μm)

图7 免疫荧光检测大鼠肾组织LYVE-1与Vimentin表达Fig.7 Expression of LYVE-1 and Vimentin in UUO rats with immunofluorescence(Scale=75 μm)
2.7 Western blot检测NCC、VEGF-C、VEGFR-3和α-SMA的表达
由图8与表1可知,UUO组NCC、VEGF-C、VEGFR-3、α-SMA的表达均较Sham组显著升高,差异有统计学意义(P<0.05);与UUO组相比,EPL组及TCM组NCC、VEGF-C、VEGFR-3、α-SMA的表达显著降低,差异有统计学意义(P<0.05)。
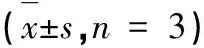
表1 UUO大鼠对侧肾组织NCC、VEGF-C、VEGFR-3和α-SMA蛋白Western blot灰度相对比值Table 1 Western blot gray scale relative ratios of NCC,VEGF-C,VEGFR-3 andα-SMA in the contralateral kidney of UUO rats = 3)
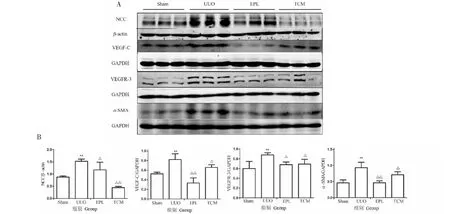
图8 Western blot检测UUO大鼠对侧肾组织NCC、VEGF-C、VEGFR-3和α-SMA表达Fig.8 Expression of NCC,VEGF-C,VEGFR-3 and α-SMA in contralateral kidney of UUO rats with Western blot注:A:UUO大鼠对侧肾组织NCC、VEGF-C、VEGFR-3和α-SMA 等蛋白Western blot数据;B:A中蛋白的灰度统计结果。与Sham组比较,*P<0.05,**P<0.01;与UUO组比较,△P<0.05,△△P<0.01。Note:A:Western blot data of proteins such as NCC,VEGF-C,VEGFR-3 and α-SMA in the contralateral kidney of UUO rats;B:Gray-scale statistical results of the protein in A.Compared with Sham,*P<0.05,**P<0.01;Compared with UUO,△P<0.05,△△P<0.01.
3 讨论与结论
近年来,慢性肾脏病发病率明显升高,现已成为全球关注的危害健康的公共性问题。依据流行病学资料,目前我国农村慢性肾脏病最为常见的原因是梗阻性肾病,其病理改变为肾间质纤维化[8]。我们的前期实验表明细胞增殖、细胞焦亡、巨噬细胞的集聚及表型转化参与对侧肾脏的损伤,近期研究发现淋巴管新生也在对侧肾脏纤维化过程中发挥着重要作用[9]。
在正常肾脏中,淋巴管仅分布在小叶间和弓形动脉周围,皮质肾小管间质区域若无损伤也少有淋巴管分布。然而,在肾小管间质纤维化和炎性损伤区域,淋巴管生成明显且管腔内充满单核细胞,生成的数量与肾小管间质损伤程度有关[10,11]。目前公认的淋巴管标志物有:淋巴管透明质酸受体1(LYVE-1)、平足蛋白(PDPN)以及血管内皮细胞生长因子受体3(VEGFR-3)。LYVE-1是一种主要表达于淋巴管内皮细胞上的膜蛋白,广泛分布在淋巴管内外腔面,参与淋巴管内皮细胞从组织摄取并转运透明质酸盐进入淋巴液的过程;PDPN是一种存在于肾小管膜上皮细胞上的黏液样跨膜糖蛋白,主要表达在人肾足突细胞、肺Ⅰ型上皮细胞和成骨细胞以及淋巴管内皮细胞,但仅出现在小淋巴管;VEGFR-3属于受体酪氨酸蛋白激酶家族的淋巴管内皮标志物,为血管内皮细胞生长因子VEGF-C的特异性受体,主要表达于淋巴管内皮细胞[12]。动物实验表明,UUO术后10天,UUO组大鼠对侧肾脏淋巴管内皮标志物LYVE-1、PDPN及VEGFR-3表达明显增强,说明淋巴管生成出现较早;考虑到细胞表型转化如肾小管上皮细胞、足细胞、血管内皮细胞等出现肌成纤维细胞样转化参与肾间质纤维化的形成[13],为了证实淋巴管内皮细胞是否存在类似改变,我们采用LYVE-1与细胞表型转化标志物α-SMA及Vimentin共染。α-SMA在肾组织表达的高低可以间接反应肌成纤维细胞的数量,因此α-SMA被广泛作为向肌成纤维细胞表型转化的一项指标;Vimentin是上皮细胞向肌成纤维转化过程中的产物,肾脏疾病时,Vimentin的表达程度与肾小管损伤情况相关,因此Vimentin是间质纤维化的间质细胞表达肌成纤维细胞的标志性蛋白[14]。结果显示UUO组大鼠LYVE-1与α-SMA、Vimentin均呈现共表达,说明淋巴管内皮细胞发生肌成纤维细胞样转变,参与了梗阻性肾病对侧肾脏纤维化的形成。
在众多信号通路中,VEGF-C/VEGFR-3途径是淋巴管生成最为关键的途径[15]。VEGF有6个亚型,A、B、C、D和E,其中参与淋巴管新生的主要是C和D,肾小管上皮细胞等分泌VEGF-C和VEGF-D作用于淋巴管内皮的同源受体VEGFR-3,诱导淋巴管和血管的生成[16,17]。VEGFR-3是淋巴管内皮表达的酪氨酸激酶,是淋巴管的标志物,VEGF-C与VEGF-D均可与之结合刺激其表达,其中VEGF-C的作用更为明显[18]。实验结果证实,结扎大鼠单侧输尿管,对侧肾脏VEGF-C表达明显增强,与淋巴管内皮标志物LYVE-1、VEGFR-3、PDPN的表达呈同样趋势;抑制VEGF-C的分泌可以减少UUO大鼠肾脏淋巴管的生成、抑制炎症损伤,减轻肾间质纤维化。
VEGF-C的过表达与组织水肿、缺血缺氧相关[19],水钠潴留是引起缺血缺氧的常见因素,NCC过表达参与这一病理生理改变。NCC是钠氯离子协同转运蛋白,主要表达在远端小管,其亲水的核心部分位于肾小管管腔侧,依据管腔与细胞间的钠离子梯度差异,将钠、氯离子共同运转到小管细胞内[20]。醛固酮调节NCC的表达,可引起钠氯离子吸收过多导致组织水肿、缺血缺氧,刺激肾小管上皮细胞等分泌VEGF-C,促进淋巴管新生[21-23]。
经过临床验证,中医中药在治疗慢性肾脏病方面发挥着重要作用。慢性肾脏病属于中医水肿、尿血、尿浊等范畴,病至后期进展为癃闭、关格等,总归脾肾亏虚、湿邪浊毒内蕴所致。根据“久病必虚”“久病必瘀”“久病入络”的中医理论,结合临床实践和现代研究,我们认为“虚、毒、瘀”是慢性肾脏病的基本病机,“虚为本,瘀为果,毒为凶”,因此拟定了益气活血解毒中药的治疗。“整体观念”是中医学的基本特点,人体的各个组成部分之间生理上不可分割,病理上相互影响。肾脏病尤其是输尿管梗阻引起的单侧肾脏损伤,不仅影响自身,也可以影响对侧,对侧受损是导致慢性肾衰竭的重要因素,通过对“健侧”肾脏的保护对于慢性肾病的治疗具有临床参考价值。
我们之前的研究已经证实,在长期实验中,UUO大鼠对侧肾脏出现巨噬细胞向成肌纤维细胞转化,加重了对侧肾脏的纤维化[24];在短期实验中,UUO大鼠对侧肾脏出现细胞增殖、细胞凋亡等现象,参与了对侧肾损伤[9,25,26]。本实验进一步证明,单侧肾脏损伤后对侧肾脏的改变与淋巴管生成有关,在梗阻后早期就发生了改变,尽管程度较轻,但随着梗阻时间的延长,会出现明显的纤维化改变。MR激活后,上调钠氯离子协同转运蛋白NCC的表达,导致水钠潴留引起组织缺血缺氧,刺激肾小管上皮细胞分泌VEGF-C诱导淋巴管生成,增生的淋巴管内皮细胞发生表型转化(α-SMA、Vimentin),参与间质纤维化形成。益气活血解毒中药可调控VEGF通路,下调LYVE-1、VEGFR-3、PDPN的表达,抑制淋巴管内皮细胞表型转化,从而达到减轻肾间质纤维化的作用。
致谢:本实验主要在河北省中西医结合肝肾病证重点实验室完成,在此对实验室的各位老师及同学的帮助致以衷心的感谢!
——淋巴管系统

