海风藤中酰胺生物碱类成分研究
朱 莹,孔江波,孙潘婷,孙彦君,2,冯卫生,2,李玉贤,2*,陈 辉,2*
1河南中医药大学药学院;2呼吸疾病中医药防治省部共建协同创新中心,郑州 450046
海风藤为胡椒科Piperaceae胡椒属植物风藤Piperkadsura(Choisy) Ohwi的干燥藤茎,主产于我国台湾、云南、广东等地。海风藤味辛、苦,性微温,归肝经,具有“祛风湿,通经络,止痹痛”等功效,临床上用于治疗风寒湿痹,肢节疼痛等症[1,2]。药理研究表明海风藤在治疗阿尔兹海默症,抗炎,镇痛和器官缺血再灌注等方面具有显著的药用价值[3-7]。化学成分研究发现海风藤中主要含有新木脂素类、生物碱类、黄酮类、挥发油等成分[8,9],其中酰胺生物碱类成分是该属植物中的特征成分,且含量较大,在海风藤中亦有报道。目前国内外学者对海风藤的研究主要集中于其中的新木脂素类及其在治疗和预防阿尔兹海默症、缺血性脑血管病等方面[3-7],但对于该植物中的酰胺生物碱类化合物报道较少。帕金森病(PD)是仅次于阿尔兹海默症第二常见的神经退行性疾病,近年来研究发现含有海风藤的一些中药复方或制剂对于PD具有较好的改善作用[10-12],但缺少相应的化学成分研究基础。基于以上问题,我们开展了海风藤中酰胺生物碱类成分的研究,并采用MPP+致损伤PC12细胞构建PD细胞模型,对分离得到的化合物进行体外神经保活性筛选,为后续该植物活性成分的开发和利用提供一定的参考依据。
1 材料与方法
1.1 仪器与材料
Bruker AVANCE III 500 MHz型核磁共振仪(德国Bruker公司);Bruker maxis HD 型飞行时间质谱(德国Bruker公司);N-1000型旋转蒸发仪(上海爱朗仪器有限公司);SHB-B 95A型循环水式多用真空泵(郑州长城科工贸有限公司);DFZ-3型真空干燥箱(上海医用恒温设备厂);赛谱锐思LC 52型高压制备液相色谱仪(赛谱锐思北京科技有限公司,SP 5030型半制备型高压输液泵,UV 200型紫外检测器,Easychrom型色谱工作站;色谱柱为YMC-Pack ODS-A,250 mm × 20 mm,5 μm);Multiskan FC型酶标仪(美国Thermo公司);薄层色谱硅胶GF254、柱色谱硅胶(200~300目,青岛海洋化工厂);Sephadex LH-20 (Pharmacia Biotech公司);ODS(40~60 μm YMC);甲醇,色谱纯(天津市四友精细化学品有限公司);其他试剂均为分析级;薄层层析硅胶选用10~40 μm的粒径,以0.5% CMC-Na制板,阴干,105 ℃活化0.5 h;MPP+(Sigma),MTS(Promega)。
海风藤于2018年6月采购于安徽亳州药材市场,经河南中医药大学药学院陈随清教授鉴定为胡椒科胡椒属植物风藤Piperkadsura(Choisy) Ohwi的干燥藤茎,标本存放于河南中医药大学中药化学研究室(标本号ID-20180609I)。
1.2 提取与分离
海风藤药材粗粉(40 kg),采用二氯甲烷冷浸提取,每次24 h,共提取3次,继续用甲醇冷浸提取;提取液经减压浓缩,得到二氯甲烷部位浸膏600 g,甲醇部位浸膏450 g。将二氯甲烷部位总浸膏进行硅胶柱色谱分离,以石油醚-丙酮系统(100∶0→0∶100)梯度洗脱,共分离得到13个流分(Fr.1~13)。流分Fr.7经中压柱色谱分离,依次用甲醇-水(30%→100%甲醇)梯度洗脱,得6个亚流分(Fr.7-1~Fr.7-6)。将Fr.7-3经半制备型HPLC制备(甲醇-水70%)制备得化合物9(20 mg,tR= 28 min),将Fr.7-5经硅胶柱色谱分离(石油醚:丙酮),再经半制备型HPLC制备得化合物8(2.6 mg,tR= 22 min)。流分Fr.8经中压柱色谱分离,依次用甲醇-水(30%→100%甲醇)梯度洗脱,得7个亚流分(Fr.8-1~Fr.8-7)。将Fr.8-3经硅胶柱色谱分离,依次用石油醚:丙酮(100∶0→0∶100)梯度洗脱,再结合制备型HPLC制备(甲醇-水 60%)得化合物1(5 mg,tR= 40 min)、2(6 mg,tR= 66 min)、3(14 mg,tR= 60 min)、4(10 mg,tR= 80 min)、6(8 mg,tR= 120min)。将Fr.8-4经硅胶柱色谱分离,依次用石油醚:丙酮(100∶0→0∶100)梯度洗脱,再结合制备型HPLC制备(甲醇-水 70%)得化合物7(2.5 mg,tR= 68 min)、11(1.5 mg,tR= 57 min)。将Fr.8-6经硅胶柱色谱分离,依次用石油醚:丙酮(100∶0→0∶100)梯度洗脱,再结合半制备型HPLC制备(甲醇-水 90%)得化合物5(2.6 mg,tR= 26 min)、10(3 mg,tR= 25 min)。将甲醇部位总浸膏进行硅藻土柱色谱分离,得石油醚、二氯甲烷、乙酸乙酯及甲醇4部位样品。将乙酸乙酯部位总浸膏进行硅胶柱色谱分离,以石油醚-丙酮系统(50∶1→0∶100)梯度洗脱,共分离得到8个流分(Fr.E1~E8)。将组分Fr.E3经凝胶柱色谱分离,再结合制备型HPLC制备(甲醇-水 75%)得化合物12(5.5 mg,tR= 68 min)、13(3.5 mg,tR= 57 min)。
1.3 体外神经保护活性测试
PC12低分化细胞置于10%FBS及100 U/mL的DMEM高糖双抗的培养基中,并在含5% CO2的37 ℃培养箱中培养至合适数量,用胰酶消化制成细胞悬液吸至15 mL离心管中,800 rpm,离心5 min后弃上清,加入新的完全培养基5 mL,用移液器吹打10次,尽量吹散细胞,取0.02 mL细胞悬液加入到细胞计数板中,计数。将细胞浓度调整至1×105个/ mL接种到96孔板继续培养。23 h后,吸出培养基,根据加入成分不同分成3组,每组平行重复3次[13]。空白对照组:只加入新培养基;模型组:加入培养基及终浓度750 μM MPP+,24 h后,加入MTS,2 h后,读值检测;药物组:加入培养基及终浓度20 μM化合物,再加终浓度750 μM MPP+,24 h后,加入MTS,2 h后,读值检测。
2 实验结果
2.1 结构鉴定
化合物1无色针状结晶(CHCl3);mp.133.2 ℃;UV光谱中显示该化合物在甲醇溶液中的最大吸收为276 nm;IR光谱显示有胺基(3 315 cm-1)和共轭羰基(1 648 cm-1)等特征吸收峰;HR-ESI-MS:m/z238.180 9 [M + H]+(计算值为238.180 2),确定化合物1的分子式为C14H23NO2,计算不饱和度为4。1H NMR谱中(表1),低场区显示有2组烯烃质子信号δH6.26(1H,d,J= 14.6 Hz,H-2),7.29(1H,dd,J= 14.6,11.6 Hz,H-3)和7.20(1H,dd,J= 15.1,11.6 Hz,H-4),6.46(1H,d,J= 15.1 Hz,H-5),根据其偶合常数推测分子中存在2个反式双键。此外,δH5.84处的质子信号,结合HSQC谱,推测为胺基活泼质子信号。高场区δH3.21~1.36之间出现4个亚甲基质子信号δH3.21(2H,t,J= 6.3 Hz,H-1′),2.59(2H,t,J= 7.3 Hz,H-7),1.63(2H,m,H-8),1.36(2H,m,H-9)和1个次甲基质子信号δH1.84(1H,m,H-2′)。此外,高场区还显示3个甲基质子信号δH0.94(6H,d,J= 6.2 Hz,H-3′,4′),0.92(3H,t,J= 7.3 Hz,H-10)。13C NMR谱中共显示14个碳信号,进一步结合DEPT和HSQC谱确定化合物1显示有2个羰基碳信号δc200.3(C-6)、165.1(C-1),4个双键碳信号,4个亚甲基碳信号,1个次甲基碳信号以及3个甲基碳信号。综合以上光谱数据信息,推测化合物1为酰胺类生物碱(见图1)。
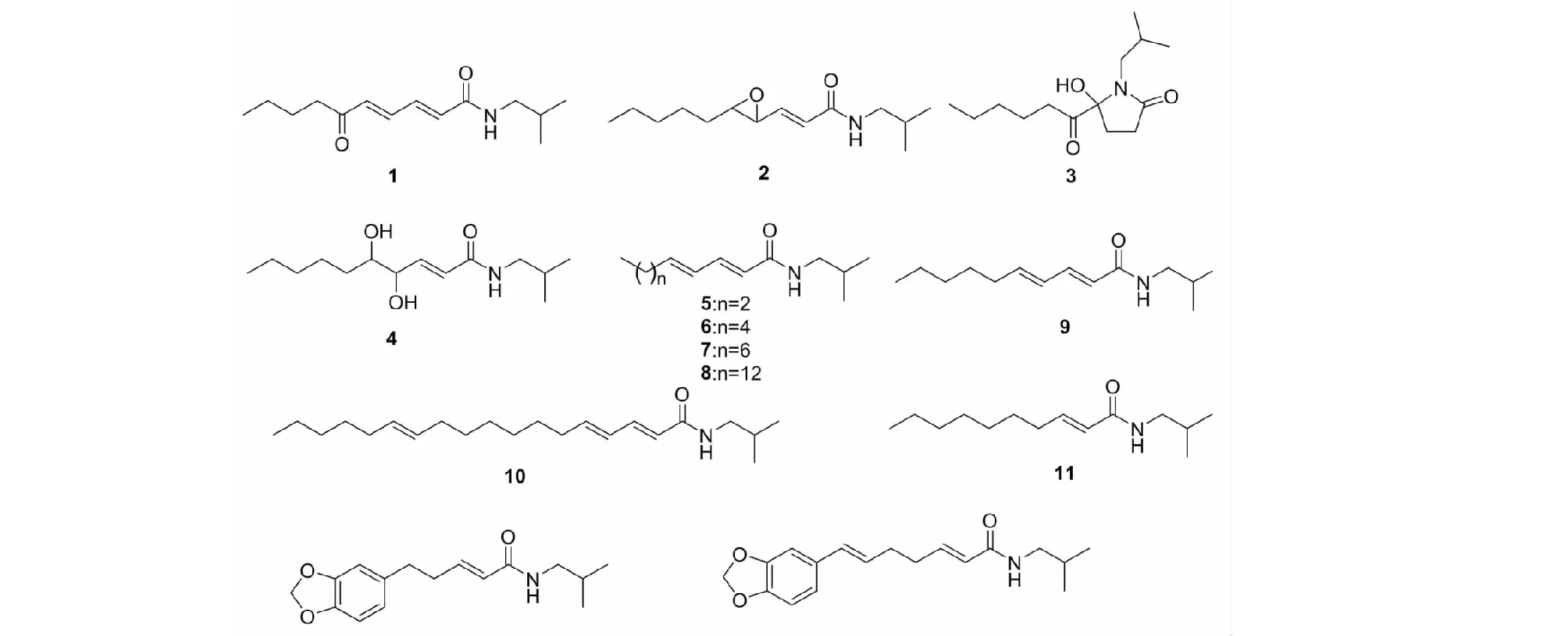
图1 化合物1~13的化学结构Fig.1 The chemical structures of compounds 1-13
1H-1H COSY谱中(图2)H-3与H-4有相关,说明分子中的2个反式双键以1,3共轭的形式存在;H-7与H-8、H-8与H-9、H-9与H-10存在相关,证明该化合物存在1个正丁基片段;H-1′与H-2′、-NH-,H-2′与H-3′、4′存在相关,证明该化合物有异丁基片段,且与氨基相连形成-NH-CH2-CH-(CH3)2结构片段。HMBC谱(见图2)中,H-3与δC165.1处的羰基碳(C-1)及C-5有明显远程相关,H-4与δC200.3处羰基碳(C-6)及C-2有远程相关,说明这2个羰基碳分别与1,3共轭双键上的C-2和C-5相连;H-7与C-9有相关,H-8与羰基碳C-6及C-10有相关,证明6位羰基碳与正丁基片段通过C-7相连;此外,H-1′与-3′、C-4′及C-1有相关,H-2′与C-4′有相关,证明-NH-CH2-CH-(CH3)2结构片段与1位羰基碳相连。综上所述,确定该化合物为(2E,4E)-N-isobutyl-6-oxodeca-2,4-dienamide。其1H NMR和13C NMR数据见表1。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
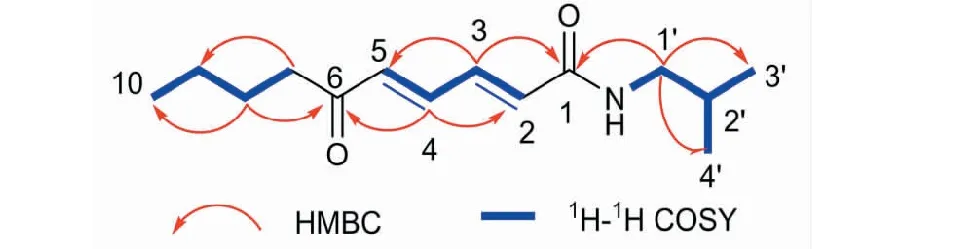
图2 化合物1的结构和关键1H-1H COSY、HMBC相关Fig.2 Key 1H-1H COSY and HMBC correlations of compound 1
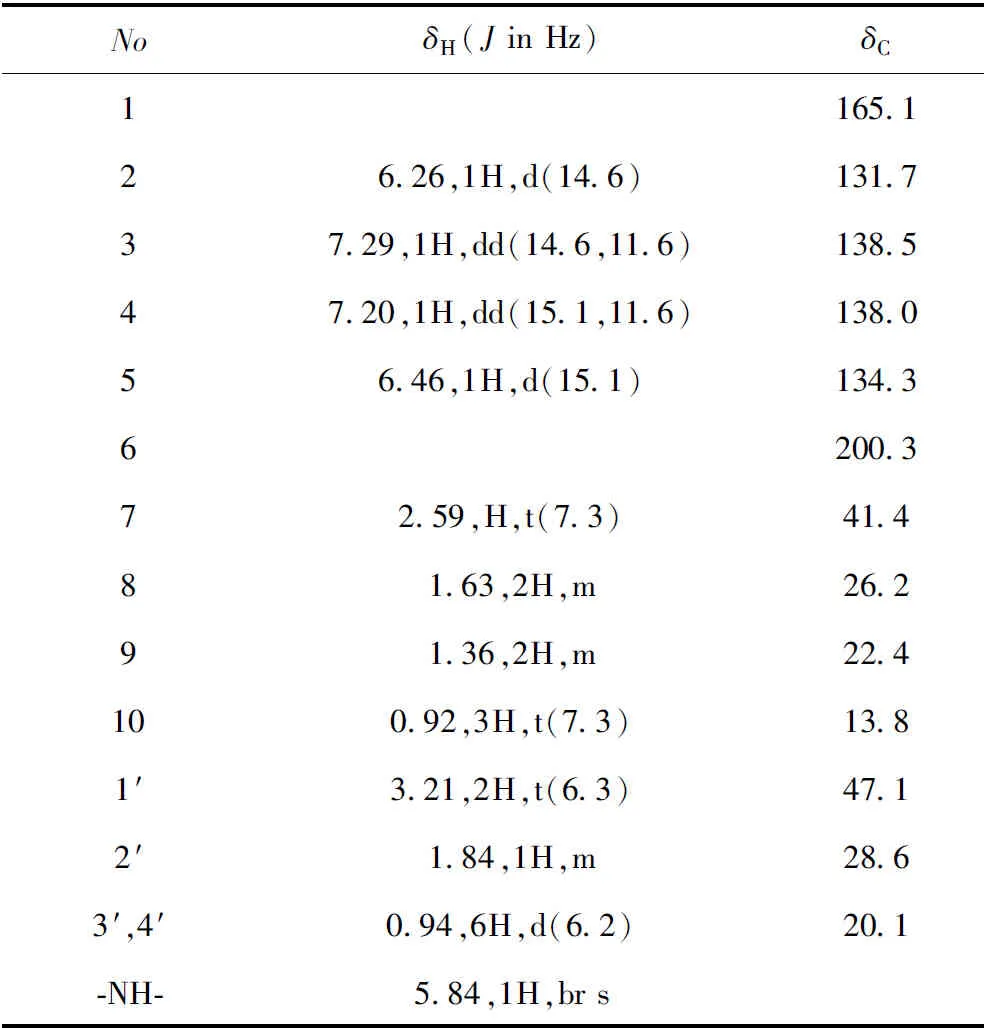
表1 化合物1的1H NMR和13C NMR波谱数据(500和125 MHz,CDCl3)Table 1 1H NMR and 13C NMR data ofcompound 1 (500 and 125 MHz,CDCl3)

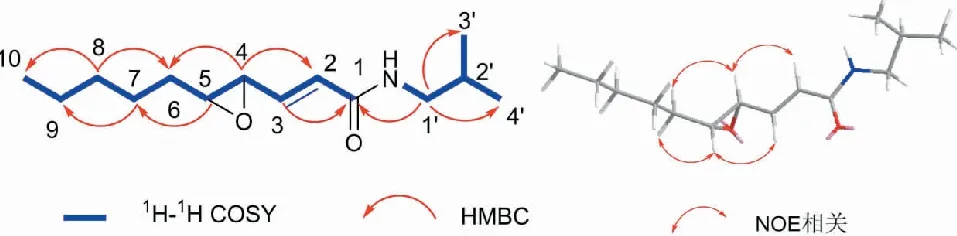
图3 化合物2的结构和关键1H-1H COSY、HMBC、NOE相关Fig.3 Key 1H-1H COSY,HMBC and NOE correlations of compound 2
化合物3无色油状物;ESI-MS:m/z256 [M + H]+,分子式为C14H25NO3。1H NMR(500 MHz,CDCl3)δ:3.23(1H,dd,J= 12.1,9.1 Hz,H-1′a),2.74(1H,m,H-2a),2.49(2H,m,H-1′a,2b),2.48(2H,m,H-6),2.30(1H,ddd,J= 14.3,10.3,4.9 Hz,H-3a),2.11(1H,ddd,J= 14.3,10.3,7.0 Hz,H-3b),1.87(1H,m,H-2′),1.67(1H,m,H-7a),1.65(1H,m,H-7b),1.36(1H,m,H-9a),1.30(1H,m,H-8a),1.29(1H,m,H-9b),1.28(1H,m,H-8b),0.90(3H,t,J= 6.8 Hz,H-10),0.88(6H,d,J= 6.8 Hz,H-3′,4′);13C NMR(125 MHz,CDCl3)δ:209.3(C-5),175.0(C-1),92.7(C-4),47.8(C-1′),34.8(C-6),31.2(C-8),30.2(C-3),29.2(C-2),27.9(C-2′),23.4(C-7),22.4(C-9),20.3(C-3′),20.4(C-4′),13.8(C-10)。以上数据与文献[15]报道基本一致,故鉴定化合物为N-isobutyl-4-hexanoyl-4-hydroxypyrrolidin-1-one。
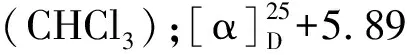
化合物5白色无定形粉末;ESI-MS:m/z196 [M + H]+,分子式为C12H21NO。1H NMR(500 MHz,CDCl3)δ:7.19(1H,dd,J= 15.0,10.4 Hz,H-3),6.10(1H,m,H-4),6.10(1H,m,H-5),5.75(1H,d,J= 15.0 Hz,H-2),3.17(2H,t,J= 6.7 Hz,H-1′),2.13(2H,q,J= 7.0 Hz,H-6),1.79(1H,m,H-2′),1.45(2H,m,H-7),0.92(6H,d,J= 6.7 Hz,H-3′,4′),0.90(3H,t,J= 7.4 Hz,H-8);13C NMR(125 MHz,CDCl3)δ:166.3(C-1),143.0(C-3),141.3(C-5),128.4(C-4),121.7(C-2),46.9(C-1′),35.0(C-6),28.6(C-2′),22.0(C-7),20.1(C-3′),20.1(C-4′),13.7(C-8)。以上数据与文献[15]报道基本一致,故鉴定化合物为N-isobutyl-2E,4E-octadienamide。
化合物6无色结晶(CHCl3);ESI-MS:m/z224 [M + H]+,分子式为C14H25NO。1H NMR(500 MHz,CDCl3)δ:7.20(1H,dd,J= 15.0,10.3 Hz,H-3),6.11(1H,m,H-4),6.11(1H,m,H-5),5.78(1H,d,J= 15.0 Hz,H-2),3.18(2H,t,J= 6.7 Hz,H-1′),2.15(2H,q,J= 7.0 Hz,H-6),1.81(1H,m,H-2′),1.43(2H,m,H-7),1.30(4H,m,H-8,9),0.94(6H,d,J= 6.7 Hz,H-3′,4′),0.90(3H,t,J= 7.0 Hz,H-10);13C NMR(125 MHz,CDCl3)δ:166.4(C-1),143.2(C-5),141.3(C-3),128.2(C-4),121.8(C-2),46.9(C-1′),32.9(C-6),31.4(C-8),28.5(C-7),28.6(C-2′),22.5(C-9),20.1(C-3′),20.1(C-4′),14.0(C-10)。以上数据与文献[17]报道基本一致,故鉴定化合物为pellitorine。
化合物7无色结晶(CHCl3);ESI-MS:m/z252 [M + H]+,分子式为C16H29NO。1H NMR(500 MHz,CDCl3)δ:7.21(1H,dd,J= 15.0,10.2 Hz,H-3),6.12(1H,m,H-4),6.12(1H,m,H-5),5.77(1H,d,J= 15.0 Hz,H-2),3.19(2H,t,J= 6.7 Hz,H-1′),2.17(2H,q,J= 7.0 Hz,H-6),1.81(1H,m,H-2′),1.43(2H,m,H-7),1.31(8H,m,H-8~11),0.95(6H,d,J= 6.7 Hz,H-3′,4′),0.90(3H,t,J= 6.8 Hz,H-12);13C NMR(125 MHz,CDCl3)δ:166.4(C-1),143.3(C-5),141.4(C-3),128.2(C-4),121.7(C-2),46.9(C-1′),33.0(C-6),31.8(C-8),29.1(C-7),29.1(C-9),28.8(C-10),28.6(C-2′),22.6(C-11),20.1(C-3′),20.1(C-4′),14.1(C-12)。以上数据与文献[18]报道基本一致,故鉴定化合物为N-isobuty-2E,4E-dodecadienamide。
化合物8白色无定形粉末;ESI-MS:m/z336 [M + H]+,分子式为C22H41NO。1H NMR(500 MHz,CDCl3)δ:7.21(1H,dd,J= 15.0,10.1 Hz,H-3),6.12(1H,m,H-4),6.12(1H,m,H-5),5.77(1H,d,J= 15.0 Hz,H-2),3.19(2H,t,J= 6.5 Hz,H-1′),2.15(2H,q,J= 7.0 Hz,H-6),1.81(1H,m,H-2′),1.43(2H,m,H-7),1.28(20H,m,H-8~17),0.94(6H,d,J= 6.7 Hz,H-3′,4′),0.90(3H,t,J= 7.0 Hz,H-18);13C NMR(125 MHz,CDCl3)δ:166.4(C-1),143.3(C-3),141.4(C-5),128.2(C-4),121.7(C-2),46.9(C-1′),33.0(C-6),31.9(C-16),29.5(C-7),29.2~29.7(C-9~15),28.8(C-8),28.6(C-2′),22.7(C-17),20.1(C-3′),20.1(C-4′),14.1(C-18)。以上数据与文献[15]报道基本一致,故鉴定化合物为N-isobutyl-2E,4E-octadecadienamide。
化合物9无色结晶(CHCl3);ESI-MS:m/z238 [M + H]+,分子式为C15H27NO。1H NMR(500 MHz,CDCl3)δ:7.21(1H,dd,J= 14.9,10.7 Hz,H-3),6.11(1H,m,H-4),6.11(1H,m,H-5),5.77(1H,d,J= 14.9 Hz,H-2),3.18(2H,m,H-1′),2.16(2H,m,H-6),1.60(1H,m,H-2′),1.42(2H,m,H-7),1.27(6H,m,H-8,9,3′),0.94(6H,m,H-4′,5′),0.90(3H,t,J= 7.4 Hz,H-10);13C NMR(125 MHz,CDCl3)δ:166.5(C-1),143.3(C-5),141.4(C-3),128.2(C-4),121.7(C-2),45.2(C-1′),32.9(C-6),31.4(C-8),35.1(C-2′),28.5(C-7),27.0(C-3′),22.5(C-9),17.2(C-5′),14.0(C-10),11.3(C-4′)。以上数据与文献[19]报道基本一致,故鉴定化合物为N-(2′-methylbutyl)-2E,4E-decadienamide。
化合物10黄色结晶(CHCl3);ESI-MS:m/z334 [M + H]+,分子式为C22H39NO。1H NMR(500 MHz,CDCl3)δ:7.19(1H,dd,J= 15.0,10.2 Hz,H-3),6.09(1H,m,H-4),6.09(1H,m,H-5),5.74(1H,d,J= 15.0 Hz,H-2),5.38(2H,m,H-12,13),3.16(2H,t,J= 13.0,6.7 Hz,H-1′),2.14(2H,m,H-6),1.96(4H,m,H-11,14),1.80(1H,m,J= 13.4,6.7 Hz,H-2′),1.41(2H,m,H-7),1.30(6H,m,H-15~17),1.29(6H,m,H-8~10),0.93(6H,d,J= 6.7 Hz,H-3′,4′),0.88(3H,t,J= 7.0 Hz,H-18);13C NMR(125 MHz,CDCl3)δ:166.4(C-1),143.3(C-3),141.4(C-5),130.5(C-12),130.2(C-13),128.2(C-4),121.7(C-2),46.9(C-1′),32.6(C-6),32.6(C-11),32.5(C-14),32.5(C-16),29.6(C-10),29.3(C-15),29.1(C-9),29.0(C-8),28.9(C-7),28.6(C-2′),22.6(C-17),20.1(C-3′),20.1(C-4′),14.1(C-18)。以上数据与文献[15]报道基本一致,故鉴定化合物为N-isobutyl-2E,4E,12Z-octadecatrienamide。
化合物11无色结晶(CHCl3);ESI-MS:m/z226 [M + H]+,分子式为C14H27NO。1H NMR(500 MHz,CDCl3)δ:6.85(1H,m,H-3),5.77(1H,d,J= 15.2 Hz,H-2),3.18(2H,t,J= 6.5 Hz,H-1′),2.19(2H,q,J= 6.9 Hz,H-4),1.81(1H,m,H-2′),1.59(6H,m,H-5~7),1.30(4H,m,H-8,9),0.95(6H,d,J= 6.5 Hz,H-3′,4′),0.90(3H,t,J= 6.9 Hz,H-10);13C NMR(125 MHz,CDCl3)δ:166.3(C-1),144.8(C-3),123.5(C-2),46.8(C-1′),32.0(C-4),31.8(C-8),29.1(C-5),29.1(C-6),28.6(C-2′),28.3(C-7),22.6(C-9),20.1(C-3′),20.1(C-4′),13.8(C-10)。以上数据与文献[20]报道基本一致,故鉴定化合物为N-isobutyl-2E-decenamide。
化合物12黄色结晶(MeOH);ESI-MS:m/z276 [M + H]+,分子式为C16H21NO3。1H NMR(500 MHz,CD3OD)δ:6.76(1H,m,H-3),6.69(2H,overlap,H-2′′,6′′),6.64(1H,d,J= 8.0 Hz,H-4′′),5.90(1H,d,J= 15.4 Hz,H-2),5.87(2H,s,-OCH2O-),3.03(2H,d,J= 6.8 Hz,H-1′),2.68(2H,t,J= 7.5 Hz,H-5),2.45(2H,q,J= 7.5 Hz,H-4),1.76(1H,m,H-2′),0.80(6H,d,J= 6.7 Hz,H-3′,4′);13C NMR(125 MHz,CD3OD)δ:167.3(C-1),147.7(C-3′′),145.9(C-4′′),143.1(C-3),134.9(C-1′′),123.9(C-2),120.9(C-6′′),108.7(C-2′′),107.6(C-5′′),100.7(-OCH2O-),46.5(C-1′),34.0(C-5),33.8(C-4),28.3(C-2′),19.1(C-3′,4′)。以上数据与文献[21]报道基本一致,故鉴定化合物为二氢荜茇明宁碱。
化合物13无色结晶(MeOH);ESI-MS:m/z302 [M + H]+,分子式为C18H23NO3。1H NMR(500 MHz,CD3OD)δ:6.90(1H,d,J= 1.5 Hz,H-2′′),6.79(2H,m,H-3,6′′),6.71(1H,d,J= 8.0 Hz,H-5′′),6.34(1H,d,J= 15.7 Hz,H-7),6.08(1H,m,H-6),5.97(1H,d,J= 15.4 Hz,H-2),5.90(2H,s,-OCH2O-),3.04(2H,d,J= 6.9 Hz,H-1′),2.35(4H,m,H-4,5),1.78(1H,m,H-2′),0.90(6H,d,J= 6.8 Hz,H-3′,4′);13C NMR(125 MHz,CD3OD)δ:167.7(C-1),147.5(C-3′′),147.5(C-4′′),143.3(C-3),132.1(C-1′′),130.3(C-7),126.9(C-6),123.8(C-2),120.1(C-6′′),107.6(C-5′′),104.9(C-2′′),100.9(-OCH2O-),46.5(C-1′),31.6(C-5),31.4(C-4),28.3(C-2′),19.1 (C-3′,4′)。以上数据与文献[21]报道基本一致,故鉴定化合物为风藤酰胺。
2.2 体外神经保护活性测试结果
采用MPP+损伤PC12细胞模型对化合物1~10进行活性测试,检测结果显示:与空白对照组比较(100%),模型组的细胞存活率显著降低(68.60%);与模型组比较,化合物6在20 μM时,细胞的存活率为73.78%,对MPP+诱导的神经细胞损伤有非常显著的保护作用(P< 0.01),其余化合物对MPP+诱导的神经细胞损伤无明显保护作用。
3 讨论
本实验从海风藤二氯甲烷部位共分离得到酰胺类生物碱13个,其中化合物1为新化合物,化合物2为新天然产物,化合物3~7、9、10为首次从该植物中分离得到。药理实验研究表明化合物6在20 μM时,对MPP+诱导的PC12细胞损伤具有显著的保护作用(P< 0.01),提示其对于帕金森病具有潜在的治疗作用。本研究不仅进一步丰富了海风藤中酰胺生物碱类成分的结构多样性,对海风藤中酰胺类生物碱在治疗和预防神经退行性疾病方面的研究亦具有一定的参考价值,同时对该属植物后续化学成分及生物活性的研究具有一定的借鉴作用。

