吉祥草活性成分RCE-4抑制宫颈癌Ca Ski细胞增殖、侵袭和迁移的活性及机制研究
陈重旭,游方芳,金桂兰,程 凡,邹 坤,邢翔飞,奚 炜,陈剑锋*
1三峡大学生物与制药学院 三峡大学天然产物研究与利用湖北省重点实验室;2宜昌市第一人民医院,宜昌443002
宫颈癌是一种常见的妇科恶性肿瘤,目前临床上对其治疗仍以手术和放化疗为主,但由于宫颈癌多为浸润性肿瘤,具有易转移、易扩散的特点,往往导致治疗预期不佳[1]。因此,寻找能抑制其侵袭和迁移的新型抗宫颈癌化疗药物备受关注。天然来源的药物因其多靶点、有效低毒的优势一直受到学者的重视。RCE-4是本实验室从百合科铃兰族吉祥草(Reineckiacarnea(Andr.) Kunth)植物中分离得到的一个螺甾烷型皂苷,化学名称为(1β,3β,5β,25S)-螺甾烷-1,3-diol1-[α-L-鼠李糖-(1→2)-β-D-木吡喃糖苷],结构见图1,其在吉祥草总皂苷中的含量最高(达13%),同时其药理活性也最好,RCE-4现已作为吉祥草的标志性成分被湖北省地方中药材标准收录[2]。
本实验室前期研究发现,RCE-4对宫颈癌Ca Ski细胞具有较好的选择性细胞毒性[3,4],能显著抑制裸小鼠Ca Ski细胞移植瘤生长,最高抑瘤率可达到69.1%,给药组小鼠的子宫、卵巢等重要组织均未见瘤细胞转移、浸润和病理改变[5]。在前期结果的启发下,我们推测RCE-4可能具有抑制宫颈癌细胞侵袭和迁移的作用,目前相关活性及其分子作用机制尚未见任何报道。
Wnt/β-catenin和Hippo/YAP是与肿瘤侵袭和迁移关联较为密切的两条细胞内信号通路,二者均通过其核心信号分子(β-catenin和YAP/TAZ)由胞浆进入细胞核后与转录因子结合转录下游靶基因从而调控肿瘤的侵袭和迁移[6-8]。阻断Wnt/β-catenin通路对肿瘤的增殖具有显著的抑制作用[9]。Wnt/β-catenin信号转导通路的异常激活可引起生长发育缺陷和肿瘤的发生以及迁移、侵袭[10,11]。下调Wnt/β-catenin 通路下游蛋白如MMP2、MMP9等可抑制肿瘤细胞的转移[12]。与 Wnt/β-catenin 通路的生物学功能相反,Hippo/YAP 通路活化后抑制细胞增殖,促进细胞凋亡[13]。在没有 Hippo 相关激活因子刺激的情况下,非磷酸化状态的 YAP 转移入核,与转录激活因子 TEAD/TEF 家族相互作用来调节靶基因的表达[14]。胞外刺激信号可通过尚不明确的机制活化 Mst1/2,再通过一系列的级联磷酸化反应磷酸化其他核心成员。
因此,本研究将以宫颈癌Ca Ski细胞为对象,通过Wnt/β-catenin和Hippo/YAP两条信号通路系统研究RCE-4对宫颈癌增殖、侵袭和迁移的影响及其分子作用机制,为RCE-4将来的临床应用提供理论支撑。
1 材料与方法
1.1 实验细胞株
人宫颈癌Ca Ski细胞由中国科学院典型培养物保藏委员会细胞库提供,本实验室培养保存。细胞培养于含10%胎牛血清、青链霉素的RPMI-1640培养基中,置于37 °C、5% CO2饱和湿度的恒温培养箱中培养。
1.2 主要试剂
RCE-4由本实验室从吉祥草中分离并进行结构鉴定,结构见图1;一抗p-GSK3β、GSK3β、p-β-catenin、β-catenin、c-Myc、MMP2、MMP7、MMP9、MMP14、VCAM-1、ICAM-1、MST1、p-MST1、NUAK2、LATS1、p-LATS1、YAP、p-YAP、CYR61、SOX2、PAK4、YAP/TAZ和β-actin(美国Cell Signaling Technology公司);二抗辣根酶标记山羊抗兔 IgG(爱必信生物科技有限公司);1640培养基(美国Gibco公司);胎牛血清(浙江天杭生物科技股份有限公司);MTT(美国Amersco公司);ECL超敏发光液(北京普利莱基因技术有限公司);DAPI染色试剂(武汉赛维尔生物科技有限公司);FITC标记山羊抗兔IgG二抗(武汉赛维尔生物科技有限公司)。
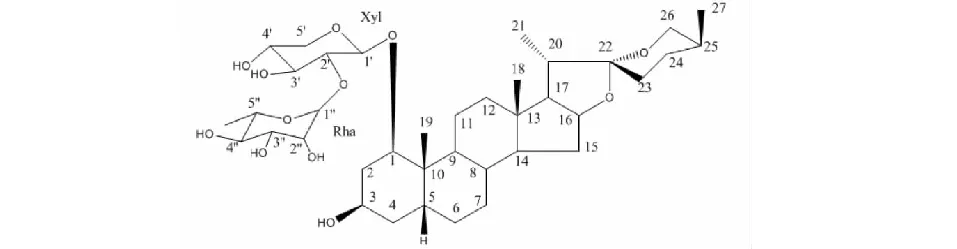
图1 RCE-4的化学结构式Fig.1 The chemical structure of RCE-4
1.3 实验仪器
酶标仪(瑞士TECAN infinite F200 PRO);荧光显微镜(宁波舜宇仪器有限公司XD30A-RFL);CO2培养箱(德国Binder公司);超低温保存箱(安徽中科都菱商用电器股份有限公司);低速离心机(安徽中科中佳科学仪器有限公司);高速冷冻离心机(德国,eppendorf公司);超纯水仪(上海和泰仪器有限公司Smart-S15UVF);电泳仪(北京基昂生物科技有限公司)。
1.4 MTT实验
将对数生长期的细胞,用胰蛋白酶消化计数后,用含10%胎牛血清的培养基配置成适合浓度的细胞悬液。以2×104个/孔的密度接种到96孔板中,设置6个平行孔,在37 °C,5%CO2的无菌培养箱中培养12 h,加入含有不同浓度RCE-4处理48 h,每孔加入20 μL MTT(5 mg/mL),孵育4 h后弃去培养基,加入150 μL DMSO,震动5 min,490 nm处测量OD值。
1.5 平板克隆形成实验
取对数生长期的Ca Ski细胞,常规消化,制备单细胞悬液并计数。以3 000个/孔的密度接种到6孔板中,以十字方向轻晃动培养皿,使细胞分散均匀。在37 °C,5%CO2的无菌培养箱中培养24 h后,将细胞用不同浓度的RCE-4分别处理24、48、72 h。处理后用无药物培养基代替并培养14天。在此期间,每两天更换一次培养基。孵育完成后,PBS小心洗涤6孔板两次,在室温下用甲醇固定15 min,0.1%结晶紫染色10 min。拍照并使用ImageJ软件(1.44I版)计数菌落数。
1.6 划痕实验
取对数生长期的Ca Ski细胞,以5×105/孔的密度接种在6孔板中。当细胞汇合度达到90%时,以200 μL移液枪吸管头部刮出三个平行伤口,并用PBS清洗孔板两次以去除掉落的细胞。使用含有2%FBS的培养基培养以消除细胞增殖的影响。每组给予不同浓度的药物,处理24 h后置细胞培养板于倒置显微镜下观察拍照。
1.7 Transwell侵袭实验
将基质胶(50 μL,用无血清培养基以1∶4稀释)垂直添加到Transwell小室(BD Biosciences,San Jose,CA)的底部,并将小室在培养箱中干燥以备使用。取对数生长期的Ca Ski细胞,消化重悬,调整浓度至1×106个/mL。将200 μL细胞悬液添加到上腔室中,并同时给药。在下腔室中加入600 μL含10%胎牛血清的RPMI-1640培养基。在37 °C下孵育24 h后,使用棉签去除残留在膜上表面的非侵入性细胞,用甲醇固定穿过膜的细胞10 min,用0.1%结晶紫染色15 min,然后在400倍光学显微镜下随机选择5个视野进行计数。
1.8 Transwell迁移实验
Transwell迁移实验的步骤与侵袭实验步骤相同,只是Transwell上腔室的表面没有被基质胶覆盖。
1.9 间接免疫荧光实验
取对数生长期的Ca Ski细胞,常规消化,制备单细胞悬液并接种于孔板中。将玻璃盖玻片上的细胞孵育至60%~80%汇合度,在不同浓度药物的作用后,取出细胞爬片,PBS洗3次,100%甲醇冷却并固定15 min,并用PBS-0.1%Triton X-100渗透15 min,3%BSA封闭后,将细胞与抗β-catenin和抗YAP/TAZ抗体在4 °C孵育过夜。PBS洗三次后,将细胞与抗兔荧光素异硫氰酸酯偶联的二抗(Bioworld,1∶200稀释)避光孵育2 h,并用DAPI染色细胞核,然后通过荧光显微镜进行观察、拍照。
1.10Western blot实验
取对数生长期的Ca Ski细胞用不同浓度的RCE-4处理6、12、24 h后,用含有蛋白酶抑制剂(1%PMSF,1%磷酸化蛋白酶抑制剂)的RIPA裂解缓冲液提取蛋白质,在冰上孵育30 min,并在4 °C下以12 000 rpm离心10 min,以获得蛋白质。核蛋白通过核蛋白提取试剂盒(GBCBIOT Technologies,中国广州)提取。上清液中的蛋白质含量使用BCA分析试剂盒(中国北京碧云天)进行测量。用5×上样缓冲液和水将蛋白质样品调整至相同浓度。在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)上分离蛋白质,然后将其转移到聚偏二氟乙烯(PVDF)膜(北京Labgic Technology Co.,Ltd.)上。用5%脱脂奶将膜封闭2 h后,将蛋白质样品与相应的一抗在4 °C下孵育16 h。用Tris缓冲盐水Tween-20(TBST)洗涤3次×10 min,然后使用适当的二抗进行孵育。随后使用ECL试剂(北京碧云天)可视化凝胶条带,并使用发光成像系统(Tanon 5200)记录结果。
1.11统计分析
所有统计分析均使用GraphPad Prism软件(5.0版,LaJolla,CA,美国)进行,以mean±SD表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05具有统计学意义。
2 结果
2.1 RCE-4对Ca Ski细胞增殖的抑制作用
为了研究RCE-4对Ca Ski细胞增殖的影响,使用MTT法检测了细胞系的增殖能力。MTT实验结果(见图2A)表明,RCE-4对Ca Ski细胞具有显著的抑制作用,IC50为4.71 μM。采用平板克隆形成实验反映单个细胞的增殖能力,在孔板中接种密度较小的细胞使之成为单个细胞,能形成可见克隆的细胞必为贴壁且有增殖能力的细胞。克隆形成实验结果(见图2B、2C)显示,与对照组相比,RCE-4能以剂量和时间依赖方式明显减少Ca Ski细胞的集落。
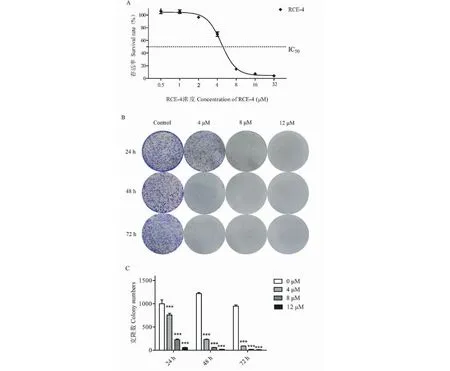
图2 RCE-4对Ca Ski细胞增殖的抑制作用Fig.2 RCE-4 can inhibit the proliferation of Ca Ski cells注:(A)RCE-4处理Ca Ski细胞48 h后通过MTT法测定评估增殖抑制效应;(B)Ca Ski细胞分别用各种浓度(0、4、8和12 μM)的RCE-4处理24 h、48 h和72 h。细胞活力通过集落形成试验确定;(C)直方图表示Ca Ski细胞集落数的数目。数据表示为三个实验的平均值±SD。与对照组相比,***P <0.001。Note: (A) Ca Ski cells were treated with RCE-4 for 48 h,and proliferation inhibition was assessed by MTT assay;(B) The Ca Ski cells were treated with various concentrations (0,4,8 and 12 μM) of RCE-4,respectively for 24 h,48 h,and 72 h.The cell viability was determined by colony formation assay;(C) The histogram indicates the number of Ca Ski cell colony numbers.Data are expressed as the mean ± SD of three experiments.Compared with control group,***P < 0.001.
2.2 RCE-4对Ca Ski细胞迁移的影响
我们采用了划痕实验和Transwell迁移来探讨RCE-4对Ca Ski细胞体外迁移的影响。划痕试验(见图3A、3B)和Transwell小室实验(见图3C、3D)的结果均表明,RCE-4能极显著(P<0.001)的抑制Ca Ski细胞的体外迁移。

图3 RCE-4抑制了Ca Ski细胞的迁移Fig.3 RCE-4 can inhibit the migration of Ca Ski cells注:(A)用不同浓度的RCE-4处理接种在六孔板上的Ca Ski细胞。给药24 h后,细胞迁移的变化。比例尺:400 μm;(B)直方图表示24 h后Ca Ski细胞中伤口愈合的百分比;(C)在具有不同浓度的RCE-4的Ca Ski细胞上进行Transwell迁移测定24 h。将穿过膜的细胞染色并在显微镜下观察;(D)直方图表示穿过膜的Ca Ski细胞的数量。比例尺:100 μm。数据表示为三个实验的平均值±SD。与对照组相比,**P <0.01,***P<0.001。Note: (A) Ca Ski cells inoculated on six-well plates were treated with various concentrations of RCE-4.After administration for 24 hours,the cells migration was recorded.Scale bars: 400 μm;(B) The histogram indicates the percentage of wound healing in Ca Ski cells after 24 h;(C) Transwell migration assays were performed on Ca Ski cells for 24 h with different concentrations of RCE-4.The cells that passed through the membrane were stained and observed under a microscope;(D) The histogram indicates the number of Ca Ski cells passing through the membrane.Scale bars: 100 μm.Data are expressed as the mean ± SD of three experiments.Compared with control group,**P < 0.01,***P < 0.001.
2.3 RCE-4对Ca Ski细胞侵袭的影响
为了阐明RCE-4在抑制Ca Ski细胞侵袭中的影响,我们采用了Transwell侵袭实验。在Transwell小室的底部添加基质胶,以模仿体内细胞外基质。结果如图4A、4B所示,RCE-4以剂量依赖性方式显著抑制Ca Ski细胞的侵袭(P<0.001)。
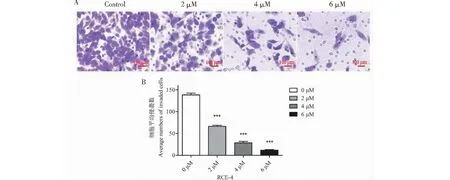
图4 RCE-4抑制了Ca Ski细胞的侵袭Fig.4 RCE-4 can inhibit the invasion of Ca Ski cells注:(A)在不同浓度的RCE-4上对Ca Ski细胞进行24 h Transwell侵袭测定。将基质胶添加到Transwell腔室的底部,以模拟体内的细胞外基质。将通过基质胶的细胞染色并在显微镜下观察。比例尺:100 μm;(B)直方图表示穿过基质胶的Ca Ski细胞的数量。数据表示为三个实验的平均值±SD。与对照组相比,***P <0.001。Note: (A) Transwell invasion assays were performed on Ca Ski cells for 24 h in different concentrations of RCE-4.Matrigel was added to the bottom of the Transwell chambers to mimic the extracellular matrix in the body.The cells that passed through the matrigel were stained and observed under a microscope.Scale bars: 100 μm;(B) The histogram indicates the number of Ca Ski cells passing through the matrigel.Data are expressed as the mean ± SD of three experiments.Compared with control group,***P < 0.001.
2.4 RCE-4对β-catenin由胞浆入核的影响
β-catenin由胞浆入核是整个Wnt/β-catenin信号通路激活的关键环节。β-catenin入核后与转录因子结合,转录出诸多下游蛋白,从而促进肿瘤细胞迁移。我们分别采用间接免疫荧光实验及Western blot方法来评估RCE-4对β-catenin入核的影响。间接免疫荧光实验(见图5A、5B)和Western blot实验(见图5C、5D)结果均表明,RCE-4以时间和剂量依赖的方式显著的抑制了β-catenin由胞浆进入细胞核。

图5 RCE-4对β-catenin核转录的抑制作用Fig.5 RCE-4 inhibits the nuclear translocation of β-catenin注:(A)通过免疫荧光评估β-catenin在Ca Ski细胞中的位置。使用抗β-catenin抗体对培养的Ca Ski细胞进行免疫荧光染色。比例尺:100 μm;(B)直方图表示(A)中的细胞荧光强度比;(C)在用各种浓度的RCE-4处理6、12、24 h后,通过蛋白质印迹法检测到β-catenin的表达;(D)直方图显示(C)中的相对蛋白质。绿色表示β-catenin的表达,蓝色表示核染色的DAPI。条形图表示上述蛋白质的平均值±SD。与对照组相比,***P <0.001。Note: (A) The location of β-catenin in Ca Ski cells was assessed by immunofluorescence.Cultured Ca Ski cells were suffered immunofluorescence staining with anti-β-catenin antibody.Scale bars: 100 μm;(B) The histogram indicates the cell fluorescence intensity ratio in (A);(C) The expression of β-catenin was detected by western blotting after treatment with various concentrations of RCE-4 for 6 h,12 h and 24 h;(D) The histogram shows the relative protein in (C).The green indicated the expression of β-catenin,and the blue denoted nuclear stained DAPI.The bar graphs represent the mean ± SD of the above proteins.Compared with control group,***P<0.001.
2.5 RCE-4对YAP/TAZ由胞浆入核的影响
同β-catenin相似,YAP/TAZ蛋白分子由胞浆入核是整个Hippo/YAP信号通路激活的关键环节。YAP/TAZ入核后与转录因子结合,转录出诸多下游蛋白,从而促进肿瘤细胞侵袭。我们同样分别采用间接免疫荧光实验及Western blot方法来评估RCE-4对YAP/TAZ入核的影响。间接免疫荧光实验(见图6A、6B)和Western blot实验(见图6C、6D)结果均表明,RCE-4以时间和剂量依赖的方式显著的抑制了YAP/TAZ由胞浆进入细胞核。
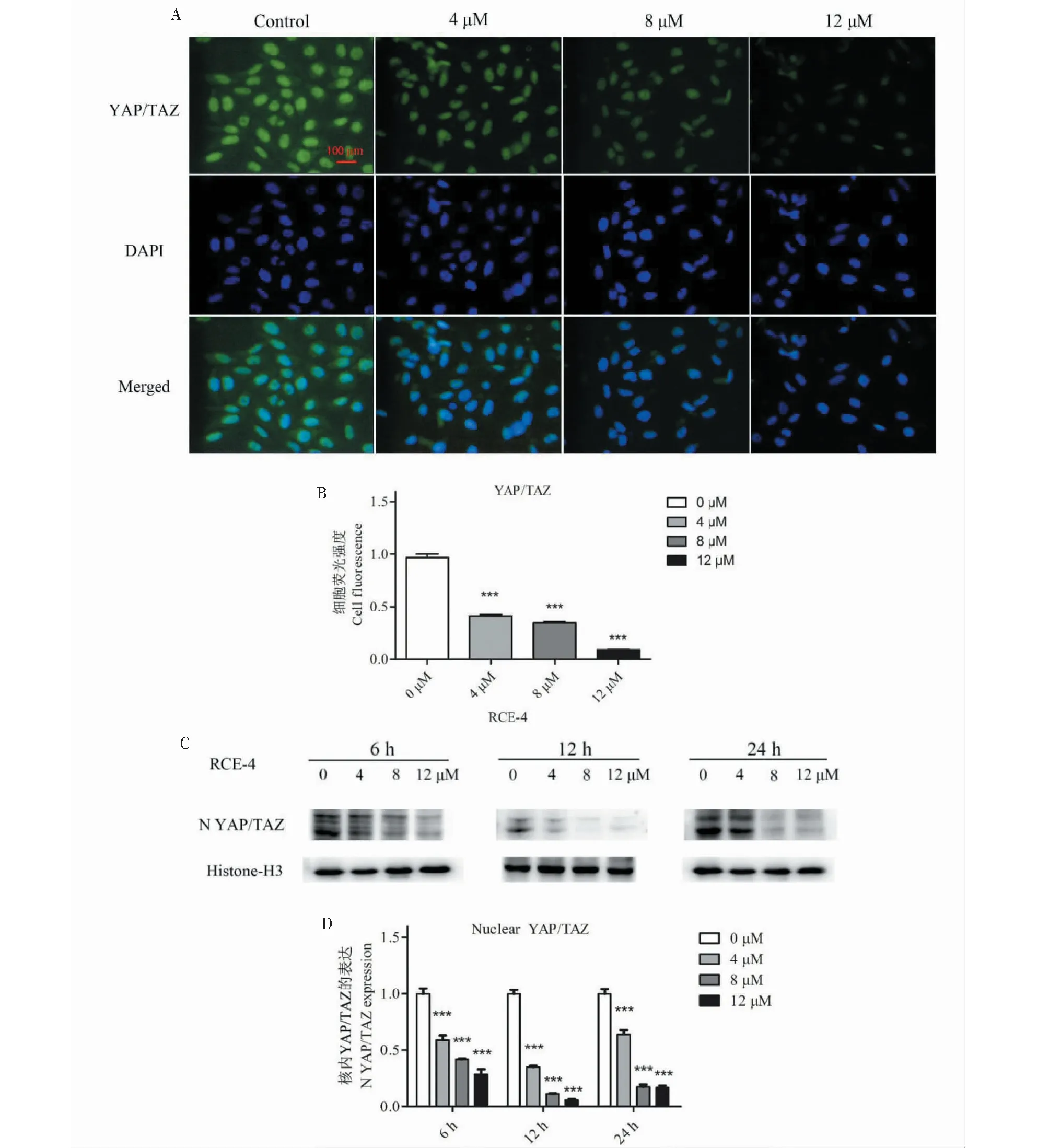
图6 RCE-4对YAP/TAZ核转录的抑制作用Fig.6 RCE-4 inhibits the nuclear translocation of YAP/TAZ注:(A)通过免疫荧光测定法评估YAP/TAZ在Ca Ski细胞中的位置。用抗YAP/TAZ抗体对培养的Ca Ski细胞进行免疫荧光染色。比例尺:100 μm;(B)直方图表示(A)中的细胞荧光强度比;(C)在用各种浓度的RCE-4处理6 h、12 h和24 h后,通过蛋白质印迹法检测到YAP/TAZ的表达;(D)直方图表示(C)中的相对蛋白质表达。绿色表示YAP/TAZ的表达,蓝色表示核染色的DAPI。条形图表示上述蛋白质的平均值±SD。与对照组相比,***P <0.001。Note: (A) The location of YAP/TAZ in Ca Ski cells was assessed by immunofluorescence assays.Cultured Ca Ski cells were subjected to immunofluorescence staining with anti-YAP/TAZ antibody.Scale bars: 100 μm;(B) The histogram indicates the cell fluorescence intensity ratio in (A);(C) The expression of YAP/TAZ was detected by western blotting after treatment with various concentrations of RCE-4 for 6 h,12 h and 24 h;(D) The histogram indicates the relative protein expression in (C).The green indicated the expression of YAP/TAZ,and the blue denoted nuclear stained DAPI.The bar graphs represent the mean ± SD of the above proteins.Compared with control group,***P<0.001.
2.6 RCE-4对Wnt/β-catenin信号通路的调控
在Wnt/β-catenin信号通路中,PAK4、GSK3β和磷酸化的β-catenin等共同调控着β-catenin的入核,其下游转录产物主要为基质金属蛋白酶(MMPs)家族成员,与肿瘤细胞的侵袭能力密切相关。Western blot实验结果(见图7A~7D、8A~8D)显示,不同浓度的RCE-4作用Ca ski细胞6 h和12 h之后可以显著增强p-β-catenin的表达,作用24 h之后可以显著增强GSK3β的表达。同时,Wnt/β-catenin信号通路中的其它关键蛋白如PAK4、p-GSK3β、β-catenin以及下游转录产物MMP2、MMP7、MMP9、MMP14、c-Myc均以时间和剂量依赖的方式被显著抑制,表明RCE-4抑制了Ca Ski细胞中Wnt/β-catenin信号通路的激活。

图7 RCE-4对Wnt/β-catenin信号通路的调控Fig.7 RCE-4 inhibits Wnt/β-catenin signaling pathway注:(A)在用不同浓度的RCE-4处理6 h、12 h和24 h后通过免疫印迹检测PAK4、GSK3β、p-GSK3β、β-catenin和p-β-catenin的表达。β-actin作为内参;(B)直方图表示(A)中6 h的相对蛋白表达;(C)直方图表示(A)中12 h的相对蛋白质表达;(D)直方图显示(A)中24 h的相对蛋白质表达。条形图表示上述蛋白质的平均值±SD。与对照组相比,*P <0.05,**P <0.01,***P <0.001。Note: (A) The expressions of PAK4,GSK3β,p-GSK3β,β-catenin and p-β-catenin and were detected after treatment with various concentrations of RCE-4 for 6 h,12 h and 24 h by immunoblotting.β-actin was included as loading control;(B) The histogram indicates the relative protein expression of 6 h in (A);(C) The histogram indicates the relative protein expression of 12 h in (A);(D) The histogram shows the relative protein expression of 24 h in (A).The bar graphs represent the mean ± SD of the above proteins.Compared with control group,*P< 0.05,**P<0.01,***P<0.001.
2.7 RCE-4对Hippo/YAP信号通路的调控
在Hippo/YAP信号通路中,MST1、p-MST1、NUAK2、LATS1、p-LATS1、YAP、p-YAP等共同调控着YAP/TAZ的入核,其下游转录产物主要为包括VCAM-1、ICAM-1、CYR61、SOX2等成员,与肿瘤细胞的迁移能力密切相关。Western blot实验结果(见图8A~8D、9A~9D)显示,RCE-4可以以时间和剂量依赖的方式显著抑制MST1、LATS1、NUAK2、YAP/TAZ、YAP、VCAM-1、ICAM-1、CYR61、SOX2的表达,在作用6 h和12 h的时候显著增强p-YAP、p-LATS1的表达,表明RCE-4显著激活了Ca Ski细胞中Hippo/YAP信号通路。 详细机制图如图10所示。
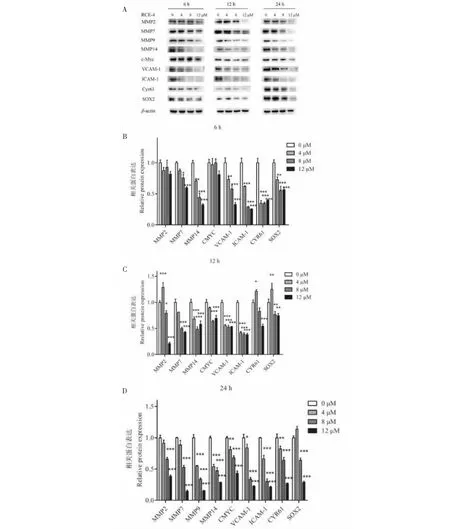
图8 RCE-4对下游靶蛋白表达的影响Fig.8 RCE-4 inhibits the downstream target proteins expression注:(A)经不同浓度的RCE-4处理6、12 和24 h后,免疫印迹法检测MMP2、MMP7、MMP9、MMP14、c-Myc、VCAM-1、ICAM-1、CYR61和SOX2的表达。β-actin作为内参。(B)直方图显示(A)中6 h的相对蛋白表达。(C)直方图显示(A)中12 h的相对蛋白质表达。(D)直方图显示(A)中24 h的相对蛋白质表达。条形图表示上述蛋白质的平均值±SD。与对照组相比,*P<0.05,**P<0.01,***P<0.001。Note: (A) The expressions of MMP2, MMP7, MMP9, MMP14, c-Myc, VCAM-1, ICAM-1, CYR61 and SOX2 were detected after treatment with various concentrations of RCE-4 for 6, 12 and 24 h by immunoblotting, β-actin was included as loading control; (B) The histogram shows the relative protein expression of 6 h in (A) ; (C) The histogram shows the relative protein expression of 12 h in (A) ; (D) The histogram shows the relative protein expression of 24 h in (A). The bar graphs represent the mean ± SD of the above proteins. Compared with control group, *P<0.05,**P<0.01,***P<0.001.
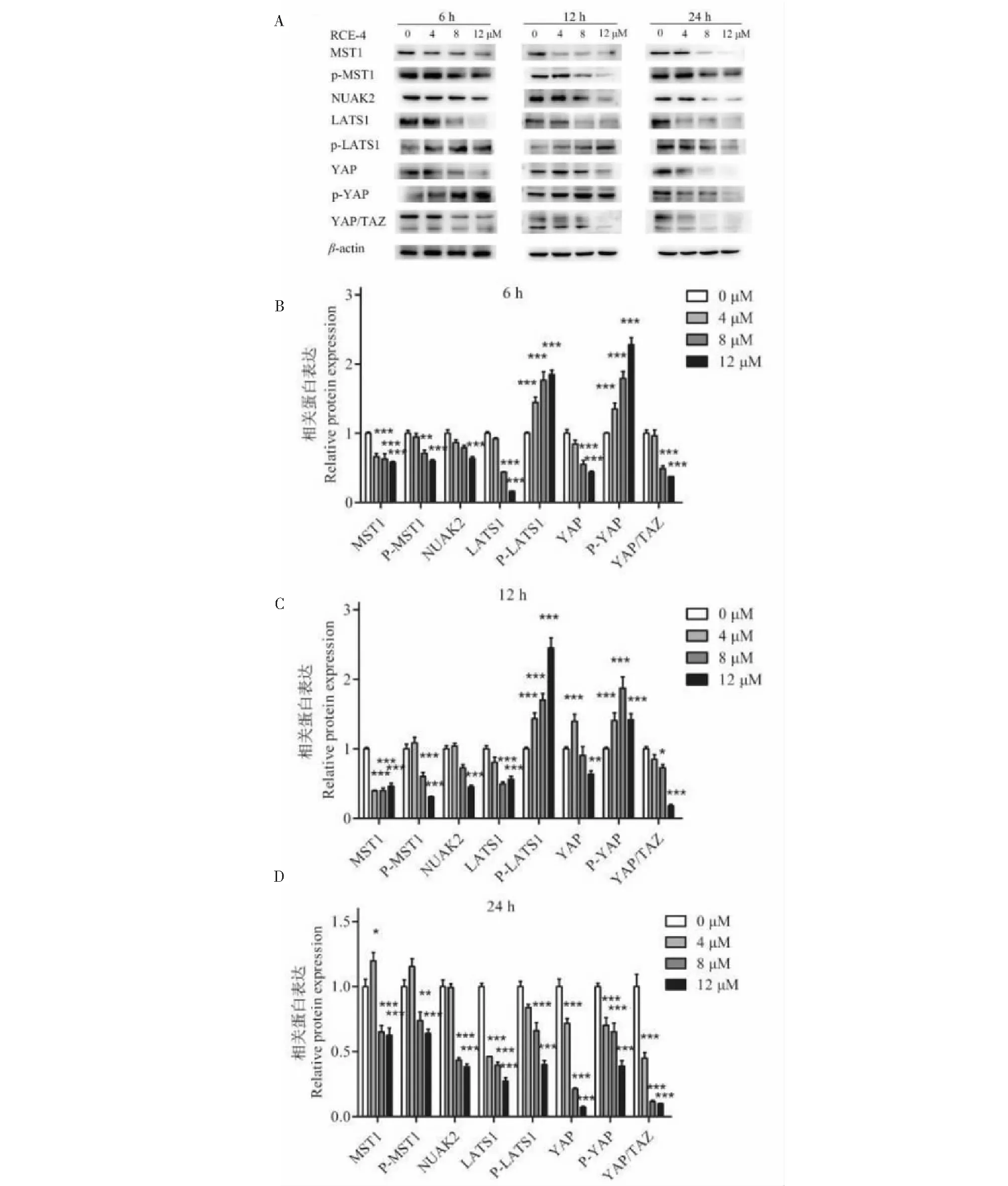
图9 RCE-4对Hippo/YAP信号通路的调控Fig.9 RCE-4 activates Hippo/YAP signaling pathway注:(A)用不同浓度的RCE-4处理6、12和24 h后,检测MST1、p-MST1、NUAK2、LATS1、p-LATS1、YAP、p-YAP和YAP/TAZ的表达。β-actin作为内参;(B)直方图表示(A)中6 h的相对蛋白表达;(C)直方图表示(A)中12 h的相对蛋白质表达;(D)直方图显示(A)中24 h的相对蛋白质表达。条形图表示上述蛋白质的平均值±SD。与对照组相比,*P <0.05,**P <0.01,***P <0.001。Note: (A) The expressions of MST1,p-MST1,NUAK2,LATS1,p-LATS1,YAP,p-YAP and YAP/TAZ were detected after treatment with various concentrations of RCE-4 for 6,12 and 24 h by immunoblotting. β-actin was included as loading control; (B) The histogram indicates the relative protein expression of 6 h in (A); (C) The histogram indicates the relative protein expression of 12 h in (A); (D) The histogram shows the relative protein expression of 24 h in (A). The bar graphs represent the mean ± SD of the above proteins. Compared with control group,*P< 0.05,**P<0.01,***P<0.001.
3 讨论
本实验室前期通过MTT实验已显示RCE-4可呈时间和剂量依赖的方式抑制Ca Ski细胞的增殖,本研究克隆形成实验的结果进一步的验证了RCE-4的有效性。另外,通过划痕实验以及Transwell小室体外侵袭实验检测了RCE-4对Ca Ski细胞侵袭和迁移的影响。结果显示,RCE-4能显著抑制Ca Ski细胞的迁移和侵袭能力,且具有浓度依赖性。
Wnt/β-catenin信号通路在肿瘤的迁移中发挥着重要作用,β-catenin的入核是该通路激活的关键[15]。结果显示,RCE-4可通过抑制p-GSK3β的表达、促进β-catenin的磷酸化以及抑制PAK4的表达三种途径共同抑制β-catenin的入核,进而抑制下游基因基质金属蛋白酶MMP2/7/9/14等的转录。有意思的是,最新的研究发现,抑制PAK4的活性可以协同增强PD-1免疫阻断疗法的治疗效果[16]。PD-1疗法在肿瘤组织缺乏免疫细胞预先浸润的情况下,疗效甚微,这也是PD-1疗法产生抗药性的主要原因[17]。使用PAK4抑制剂后可显著增强体内瘤组织对PD-1阻断疗法的响应,考虑到RCE-4对PAK4显著的抑制作用,这为我们提供了新的研究方向。
Hippo/YAP信号通路与肿瘤细胞侵袭的关系也已得到证实[18],但到目前为止,针对Hippo/YAP信号通路的药物还相对较少。2018年,Gill等[19]发现,该通路围绕YAP/TAZ分子入核过程存在着一个特殊的正反馈循环,该循环由NUAK2、LATS1、p-LATS1、胞浆内和细胞核内YAP/TAZ五个蛋白分子组成,NUAK2可以通过抑制LATS1的表达以阻止LATS1的磷酸化,从而促进YAP/TAZ复合物分子由胞浆向细胞核的转移,进入核内的YAP/TAZ分子与NUAK2转录子结合,转录出的NUAK2进入胞浆,以此形成正反馈循环。该循环的发现使Hippo/YAP信号通路更显复杂,也解释了调控Hippo/YAP信号通路以抑制肿瘤细胞侵袭的困难性。本实验结果显示,RCE-4可以通过多条途径,包括抑制MST1的磷酸化、增强YAP的磷酸化以及减少YAP的表达等共同抑制YAP/TAZ的入核,核内YAP/TAZ的减少又导致NUAK2的表达降低,从而打破了此正反馈循环。循环的打破导致其下游细胞间粘附分子-1(ICAM-1)、血管细胞粘附分子-1(VCAM-1)、CYR61以及SOX2等蛋白表达的减少,Ca Ski细胞的迁移能力被显著抑制。
值得注意的是,细胞内Wnt/β-catenin和Hippo/YAP两条信号通路并非毫无联系,二者在很多方面存在交互作用[20,21],比如磷酸化的YAP/TAZ能与β-catenin结合导致β-catenin滞留在胞质中,从而抑制β-catenin的转录活性[22]。YAP可以诱导GSK3β的失活,失活的GSK3β进而稳定胞质的β-catenin,促进β-catenin的核转移[23]。本研究尚未对两条信号通路的互反馈调控进行深入研究,同时,本阶段的研究也具有一定的局限性,对于如Hela、SiHa等其它宫颈癌细胞株还未进行验证,以及缺少动物实验结果,这也是我们下一步的研究方向。
综上所述,RCE-4具有较好的抑制Ca Ski细胞侵袭和迁移的能力,其分子作用机制主要是通过阻止β-catenin和YAP/TAZ的入核这一关键环节从而抑制Wnt/β-catenin信号通路的活化以及激活Hippo/YAP信号通路来实现。

