谈高三化学一轮复习
摘 要:原电池是高中化学的重要知识点,教师在进行一轮复习时应与学生一起总结原电池的基础知识,引导其构建系统的知识网络,既要使学生牢记相关定义,又要使其深入理解原电池工作原理,以便灵活运用于解题中。作者结合高三化学一轮复习经验,对原电池的工作原理及相关应用进行了探讨,以供相关教师参考。
关键词:高三化学;一轮复习;原电池;工作原理
中图分类号:G420 文献标识码:A 文章编号:2095-9192(2021)24-0040-02
引 言
原电池是高考的热门考点,题型灵活多变,学生只有深入理解原电池的工作原理,掌握相关的应用技巧,才能以不变应万变,提高化学学习能力。因此,在高三化学一轮复习中,教师应制订详细的复习计划,按部就班地开展复习,使学生在深入理解原电池工作原理的同时,积累应用原电池知识解题的思路与技巧。
一、原电池工作原理及理解
原电池是把化学能转化为电能的装置,其本质为氧化还原反应,并且氧化反应和还原反应是分开进行的。原电池由活泼性不同的金属或非金属构成电池的两极。其中,活泼金属失去电子发生氧化反应,为负极;不活泼金属作为正极,发生了电子的还原反应[1]。一轮复习时,教师应引导学生认真理解以下问题:①构成原电池的条件有哪些?②原电池两极物质的金属活动性强弱是怎样的?③原电池中电子的流动与电流的流动方向是怎样的?④原电池如何产生持续稳定的电流?⑤书写电极反应式时应注意哪些细节?
二、原电池工作原理的应用
(一)用于比较金属活动性强弱
比较金属活动性强弱是原电池应用的重要方向之一。根据原电池原理可知,负极的金属活动性强于正极,其失去的电子通过导线流向正极,而电流方向是从正极经导线流向负极的。在溶液中,阳离子向正极移动,阴离子向负极移动。根据这些规律,学生很容易便可判断金属活性的强弱。
例如,将A、B、C、D四块金属片浸泡在稀硫酸中,用导线两两连接可构成各种原电池,其中A、B连接时,A为负极;C、D连接时,电流由D流向C;A、C连接时C极产生大量气泡;B、D连接时,D极金属部分溶解,则四块金属的活动性顺序由强到弱为( )。
A. A>B>C> D B. A>C>D>B
C. C>A>B>D D. B>D>C>A
由原电池工作原理可知,A、B相连时,A为负极,表明金属活动性A>B;C、D连接时,电流由D流向C,则电子由C流向D,表明金属活动性C>D;A、C连接时,C极产生大量气泡,表明H+在C极得电子被还原成H2,则C为正极,A为负极,金属活动性A>C;B、D连接时,D极金属部分溶解,金属由单质被氧化成阳离子,则D为负极,则金属活动性D>B。综上可知,B项正确。
(二)用于判断电极材料及反应
运用原电池工作原理可判断电极材料,根据电解质溶液的离子种类能够判断两极发生的电极反应。一轮复习时,为使学生掌握相关的判断技巧,教师应注重为学生创设如下习题情境,锻炼学生灵活运用所学知识分析问题的能力。
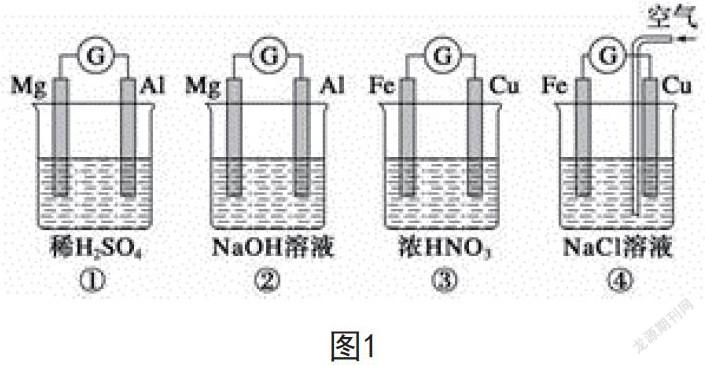
例如,原电池电极名称不仅和电极材料性质相关,还和电解质溶液有关,如图1所示的四个原电池装置,以下说法正确的是( )。
A.①②中Mg为负极,③④中Fe为负极
B.②中Al为负极,电极反应为2Al-6e-=2Al3+
C.③中Fe为负极,电极反应为Fe-2e-=Fe2+
D.④中Cu为正极,电极反应为O2+4e-+2H2O=4OH-
判断原电池正负极材料时,首先要注重对比两极物质的活泼性强弱情况,分析哪一极与电解质溶液发生反应,而后运用所学的氧化还原反应知识,写出电极反应式。解答该题需要认真观察给出的原电池裝置,逐一分析给出的选项。其中,A项,②中Al失去电子为负极,错误;B项,②中的电极反应方程式为Al-3e-+4OH-=AlO2-+2H2O,错误;C项,Fe和冷的浓硝酸发生钝化反应,Cu和浓硝酸发生反应失去电子,为负极,错误;D项,铁发生吸氧腐蚀为负极,Cu为正极,正极上为氧气得电子的还原反应,电极反应为O2+4e-+2H2O=4OH-,正确。
(三)用于判断反应过程
众所周知,原电池工作中因电子、阴阳离子的移动会引起一些物质的变化。为使学生准确地掌握原电池中物质的变化规律,教师应注重优选经典的习题,在课堂上为学生预留时间,要求学生通过对反应过程的理解进行分析作答,更好地巩固所学,深化理解。
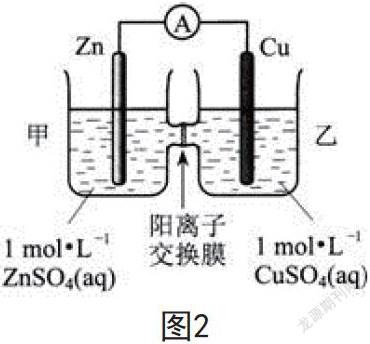
例如,图2为锌铜原电池装置,其中阳离子交换膜只允许阳离子和水分子通过,以下说法不正确的是( )。
A. Zn电极上发生氧化反应
B.甲池的SO42-微粒减少
C.甲池溶液的阳离子向乙池移动
D.乙池中的Cu电极质量增加
该题目涉及离子交换膜,解答时需要把握离子交换膜的作用,可运用原电池工作原理进行解答。A项,根据图中内容可知该原电池的反应原理为Zn+Cu2+=Zn2++Cu,Zn失去电子为负极,发生氧化反应,正确;B项,因两池之间存在阳离子交换膜,SO42-无法在两池之间移动,甲池的SO42-保持不变,错误;C项,原电池工作时,甲池中的Zn2+会通过阳离子交换膜进入乙池中,维持溶液电荷平衡,正确;D项,乙池中Cu2+得电子被还原为单质Cu,促使电极质量增加,正确。
(四)用于设计原电池
为提高学生的应用能力,教师应注重给出反应原理及相关的化学试剂,要求学生自己进行原电池的设计,进一步提高学生的综合能力。教师应注重跟踪学生原电池设计过程,通过给予学生引导与启发,帮助其寻找到正确的设计思路,同时设计相关的问题,进一步加深学生印象。
例如,已知FeCl3溶液、KI溶液,两极材料均使用石墨,其他材料任选,请根据2Fe3++2I-2Fe2++I2设计成带盐桥的原电池,并回答问题。
①画出设计的原电池装置图,并标出电极名称及电解质溶液;②发生还原反应的电极为电池的___极,电极反应式为_____;③反应平衡时,外电路导线中_____(填“有”或“无”)电流通过。
原电池的设计对学生的综合能力要求较高,需要学生综合考虑诸多细节。学生通过对给出的溶液及对原电池原理的分析,可知铁离子得电子发生还原反应,为正极,碘离子失电子发生氧化反应,为负极。显然,正极使用FeCl3溶液,负极使用KI溶液。原电池装置图如图3所示。
正极电极反应式为Fe3++e-=Fe2+。当反应达到平衡时,没有电子转移,因此,外电路导线中无电流。
结 语
在高中化学的原电池一轮复习中,教师要让学生重视基础知识的复习,尤其应深入理解原电池工作原理,在此基础上构建系统的知识网络。同时,教师也要为学生展示原电池工作原理在解题中的具体应用,进一步巩固其所学,从而使学生掌握相关的应用思路与技巧,在解题中能够少走弯路。
[参考文献]
郑晓烁,林晓明,覃路珠.基于化学核心素养的模型建构研究:以原电池的工作原理为例[J].黑龙江科学,2020,11(13):30-33.
作者简介:陈丽双(1978.2-),女,福建莆田人,本科学历,中学一级教师。

