延龄草总皂苷对D-半乳糖诱导的SD大鼠心肌线粒体自噬的影响
夏德尧,张 桃,陈 颖,王 刚,杨丽君,赵方毓,覃晓莉,陈显兵,3
(1.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;湖北民族大学2.医学部,3.附属民大医院病理科,湖北 恩施 445000)
心血管疾病是我国城乡居民死亡的首要原因[1],衰老是心血管疾病发生的重要危险因素。D-半乳糖(D-galactose,D-gal)被广泛应用于衰老动物模型和细胞模型的建立,可引发氧化应激、线粒体损伤等致多器官功能衰退[2]。而线粒体是心脏功能活动的主要能量来源,线粒体功能受损导致其产生能量的能力逐渐丧失,同时产生大量的活性氧,随着时间累积能量短缺和氧化应激加重,导致心肌细胞受损甚至死亡。因此,线粒体功能障碍在衰老进程中的心肌损伤中起着核心作用[3]。
适时清除损伤线粒体对于维持心肌细胞的正常生长和代谢十分重要。线粒体自噬是最具特征性的选择性自噬类型,可将多余或受损的线粒体通过空泡包绕隔离形成自噬小体以进行降解。不同于其他类型的自噬,线粒体自噬通过线粒体外膜上的线粒体BNIP3L膜蛋白(BNIP3-like protein X,NIX)和线粒体外膜结构域包含蛋白FUN141(FUN14 domain containing 1,FUNDC1)招募自噬结构蛋白微血管相关蛋白轻链并与之结合,从而诱导线粒体自噬,这一途径被称为受体介导的线粒体自噬途径[4]。另外,线粒体自噬还通过PTEN诱导假 定 激酶 1(PTEN induced putative kinase 1,PINK1)-E3泛素连接酶活性帕金森病蛋白2(E3 ubiquitin ligase Parkinson′s disease protein 2,Parkin)经典通路进行调节。尤其是在线粒体功能异常时,PINK1稳定在损伤的线粒体膜上并维持其激酶活性,同时招募Parkin启动线粒体自噬[5]。综上,损伤的线粒体可通过多种独立和交叉的途径对自身进行降解,以维持线粒体质量及完整性。但研究发现,随着机体的衰老,细胞自噬机制逐渐衰弱,线粒体自噬活动在机体衰老的进程中逐渐降低[6]。因此,靶向调控线粒体的关键通路和基因的抗氧化药物,可能成为治疗衰老相关的心功能障碍的新的治疗策略。
延龄草(Trillium tschonoskii Maxim)是土家族地区的传统药材。其活性成分皂苷类具有抗癌、抗炎、清除自由基、改善心功能和降压及抗衰老等功效[7-8]。研究发现,延龄草提取液可抑制糖尿病大鼠心肌损伤中的心肌细胞凋亡[9],提示延龄草在治疗心功能异常方面有一定的前景。本研究采用D-gal制备大鼠亚急性心肌损伤模型,探究延龄草总皂苷(total saponins from Trillium tschonoskii Maxim,TST)对D-gal诱导的大鼠心肌线粒体自噬水平的影响,以期为TST在心血管疾病中的临床应用提供理论依据。
1 材料与方法
1.1 药物、试剂和主要仪器
TST由湖北民族大学中药学实验中心自制。药材采自湖北恩施,经该大学医学部中药实验室鉴定为百合科延龄草属植物延龄草,药材经60℃恒温箱干燥后粉碎,用75%乙醇浸泡过夜后回流提取,将提取液过滤并减压浓缩、干燥,得延龄草总提取物。使用适量去离子水将总提取物全部溶解,经水饱和的正丁醇萃取,减压浓缩干燥,得TST,含量为61.48%。用延龄草苷对照品制作标准曲线,紫外可见光光度计测定得TST含量为14.72 mg·g-1药材。D-gal(美国Sigma-Aldrich有限公司),肌酸激酶(creatine kinase,CK)、CK同工酶MB(creatine kinase MB,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)、羟丁酸脱氢酶(hydroxybutyrate dehydrogenase,HBD)和天门冬氨酸氨基转移酶(glutamic-oxaloacetic transaminase,GOT)检测试剂盒(南京建成生物工程研究所),兔抗人GAPDH单克隆抗体、兔抗人PINK1及Parkin多克隆抗体(上海碧云天生物技术有限公司),兔抗人LC3B、Beclin1、P62、线粒体外膜结构域包含蛋白FUN141(FUN14 domain containing 1,FUNDC1)、NIX 单克隆抗体及生物素标记的山羊抗兔IgG抗体(美国CST公司),即用型IHC试剂盒(福州迈新生物技术开发有限公司),Western印迹和其他相关试剂(上海碧云天生物技术有限公司)。1510型全波长酶标仪全波长酶标仪(美国Thermo公司),荧光显微镜(Eclipse 80i,日本Nikon公司),Western印迹电泳及转膜系统(美国Bio-Rad公司),全自动化学发光成像系统Tanon-5200(上海天能科技公司)。
1.2 动物、分组和给药
50只8周龄雄性SD大鼠,体重200~240 g,由湖北省实验动物研究中心提供,许可证号为SCXK(鄂)2015-0018。适应性喂养7 d后开始正式实验,喂养环境保持23~25℃,12 h明暗交替,安静通风。
将大鼠随机分为5组,每组10只,分别为正常对照组(每日ig给予双蒸水10 mL·kg-1)、D-gal组(颈背部sc给予D-gal 200 mg·kg-1,5 mL·kg-1)、D-gal+TST 50,100和 200 mg·kg-1组(ig给予 TST 5 mL·kg-1,2h后颈背部皮下sc给予D-gal),连续7周。本实验动物使用方案通过湖北民族大学伦理委员会伦理审查。
1.3 样本收集和处理
大鼠末次给药后禁食不禁水12 h,10%水合氯醛(3.5 mL·kg-1)ip麻醉,打开胸腔,于心尖部位取血。心尖取血静置2 h,2500×g离心15 min,取血清。每组随机选取5大鼠灌流固定,取心肌组织于4%多聚甲醛固定备用,另5只取新鲜心肌组织于-80℃冻存备用。
1.4 试剂盒检测大鼠血清中CK,CK-MB,LDH,HBD和GOT活性
取1.3中制备的血清样本,按照检测试剂盒说明进行操作,测定大鼠血清中CK,CK-MB,LDH,HBD和GOT活性。
1.5 HE染色法观察心肌组织病理变化
取1.3经灌流固定的心肌组织,于4%多聚甲醛固定24 h,修块,脱水,透明,浸蜡,包埋,4 μm切片,60℃烤片2 h,用全自动染色机进行脱蜡、水化、HE染色、脱水、透明,中性树胶封片,扫描。
1.6 免疫组织化学法检测大鼠心肌组织FUNDC1和NlX蛋白表达
取1.5制备的心肌组织蜡块样本,3 μm切片,60℃烤片2 h,二甲苯3次脱蜡,梯度乙醇水化。高压锅中加1×EDTA抗原修复液,沸腾后放入玻片,加热2 min,室温冷却后平放入湿盒中用PBS漂洗3次,每次3 min。擦去组织外的PBS,滴加A液(阻断内源性过氧化物酶)后静置10 min;PBS漂洗3次,每次3 min,滴加B液(山羊封闭血清)后静置10 min;甩去封闭液,滴加一抗 NIX(1∶100)和FUNDC1(1∶100),按每张50 μL的量配制,4℃孵育过夜;次日室温孵育20 min,PBS漂洗3次,每次3 min,滴加C液(辣根过氧化物酶)静置10 min;PBS漂洗3次,每次3 min,滴加D液(链酶亲和素-过氧化物酶)静置20 min;PBS漂洗3次,每次3 min,二氨基联苯胺(DAB)避光反应8 min,过双蒸水后苏木素复染细胞核,常规脱水、透明、封片、扫描。光镜下,NIX和FUNDC1蛋白在细胞浆内显棕黄色,每个样本随机截取5个视野计算平均吸光度,平均吸光度=积分吸光度/阳性表达面积,取均值表示组织FUNDC1和NIX蛋白表达水平。
1.7 Western印迹法检测心肌LC3Ⅱ/Ⅰ,Beclin1,P62,PlNK1,Parkin,FUNDC1和NlX蛋白表达水平
取1.3适量冻存的心肌组织进行裂解匀浆,提取总蛋白,通过BCA蛋白浓度试剂盒测定蛋白浓度并定量。依次进行制胶、电泳、转膜、封闭、4℃孵育抗体 GAPDH(1∶5000)、LC3B(1∶1000)、Beclin1(1∶1000)、P62(1∶1000)、PINK1(1∶2000)、Parkin(1∶2000)、FUNDC1(1∶1000)及 NIX(1∶1000)过液,清洗后,室温孵育生物素标记的二抗(1∶5000)2 h,ECL发光检测,用凝胶成像系统显影并分析,以GAPDH为参照,以目标蛋白与内参蛋白积分吸光度比值表示待测蛋白相对表达水平。
1.8 统计学分析
2 结果
2.1 TST对D-gal诱导的心肌损伤大鼠血清心肌酶水平的影响
表1结果显示,与正常对照组相比,D-gal模型组血清 CK,CK-MB,LDH,HBD 及 GOT活性均明显升高(P<0.05,P<0.01)。与D-gal模型组相比,D-gal+TST各剂量组血清中LDH,HBD和GOT活性均明显下降(P<0.05,P<0.01);D-gal+TST 50和100 mg·kg-1组CK活性显著下降(P<0.01),D-gal+TST 200 mg·kg-1组CK活性下降不明显;D-gal+TST 100mg·kg-1组CK-MB活性显著下降(P<0.05),D-gal+TST 50和200 mg·kg-1组CK-MB活性无明显变化。
2.2 TST对D-gal诱导的心肌损伤大鼠心肌组织病理变化的影响
如图1所示,D-gal模型组心肌细胞萎缩,细胞体积缩小,心肌纤维变细,细胞间隙增宽,胞质内可见脂褐素及脂肪空泡。D-gal+TST 50 mg·kg-1组心肌纤维变细且排列紊乱,细胞间隙增宽,少见脂肪空泡及脂褐素;D-gal+TST 100和200 mg·kg-1组心肌纤维形态趋于正常,少见脂肪空泡及脂褐素。

Fig.1 Effect of TST on myocardial pathological change of rats with myocardial injury induced by D-gal.See Tab.1 for the rat treatment.Black arrows indicate fat vacuoles and blue arrows indicate gap enlargement.

Tab.1 Effect of total saponins from Trillium tschonoskii Maxim(TST)on serum creatine kinase(CK),creatine kinase MB(CK-MB),lactate dehydrogenase(LDH),hydroxybutyrate dehydrogenase(HBD)and glutamic-oxaloacetic transaminase(GOT)levels in rats with myocardial injury induced by D-galactose(D-gal)
2.3 TST对D-gal诱导的心肌损伤大鼠心肌组织中FUNDC1和NlX蛋白表达的影响
如图2所示,FUNDC1蛋白(图2A)和NIX蛋白(图2B)在心肌细胞中均为胞浆表达,阳性表达呈棕黄色。与正常对照组相比,D-gal模型组大鼠心肌组织中FUNDC1蛋白和NIX蛋白表达降低(P<0.01);与D-gal模型组比较,D-gal+TST各剂量组大鼠心肌组织中FUNDC1和NIX蛋白表达显著增加(P<0.05)(图2C)。
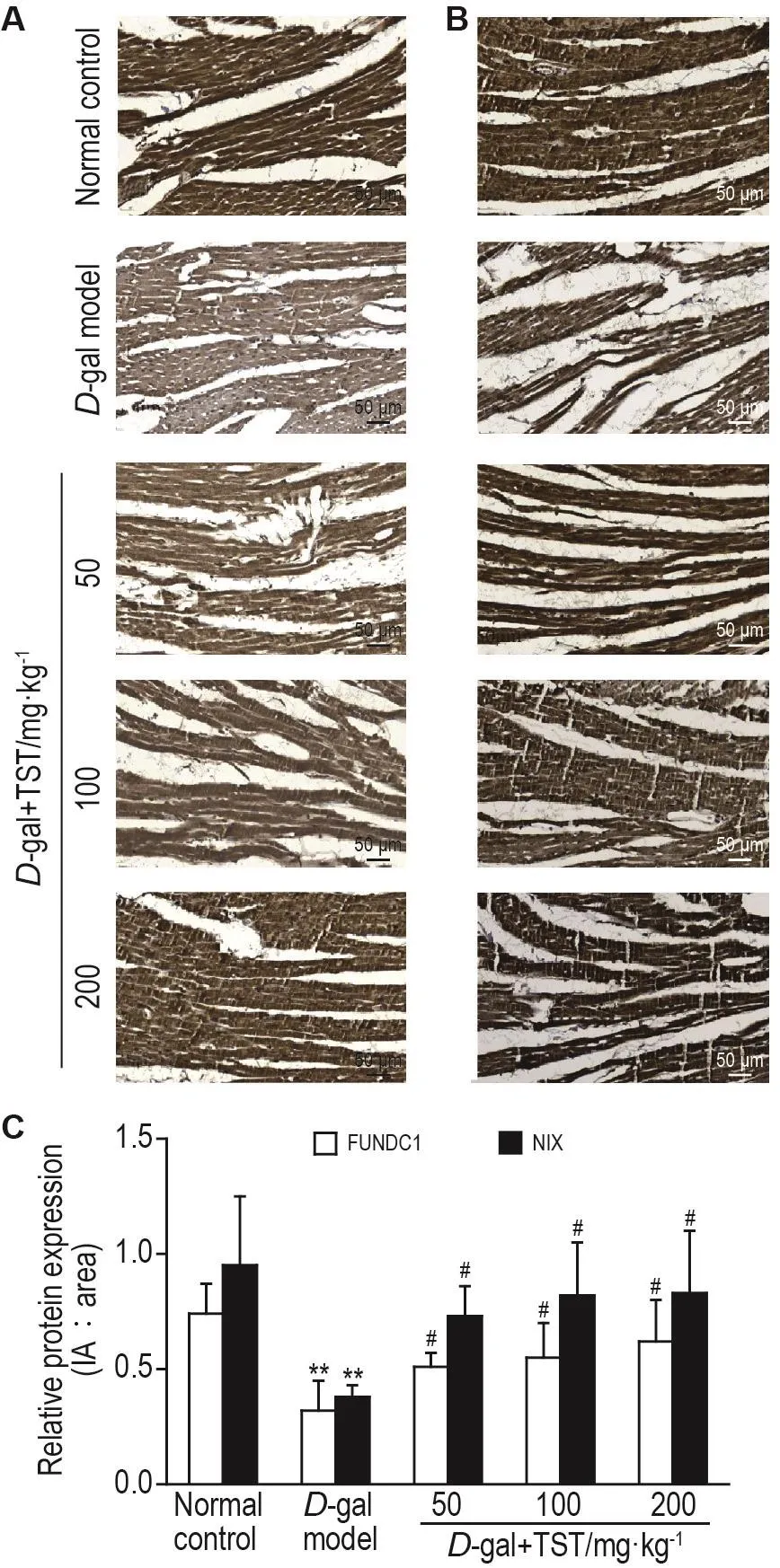
Fig.2 Effect of TST on protein expressions of FUN14 domain containing 1(FUNDC1,A)and Nip3-like protein X(NlX,B)in myocardial tissue of rats with myocardial injury induced by D-gal deteced by immunohistochemistry.See Tab.1 for the rat treatment.C was the semi-quantitative result of A and B.±s,n=5.**P<0.01,compared with normal control group;#P<0.05,compared with D-gal model group.IA:integrated absorbance.
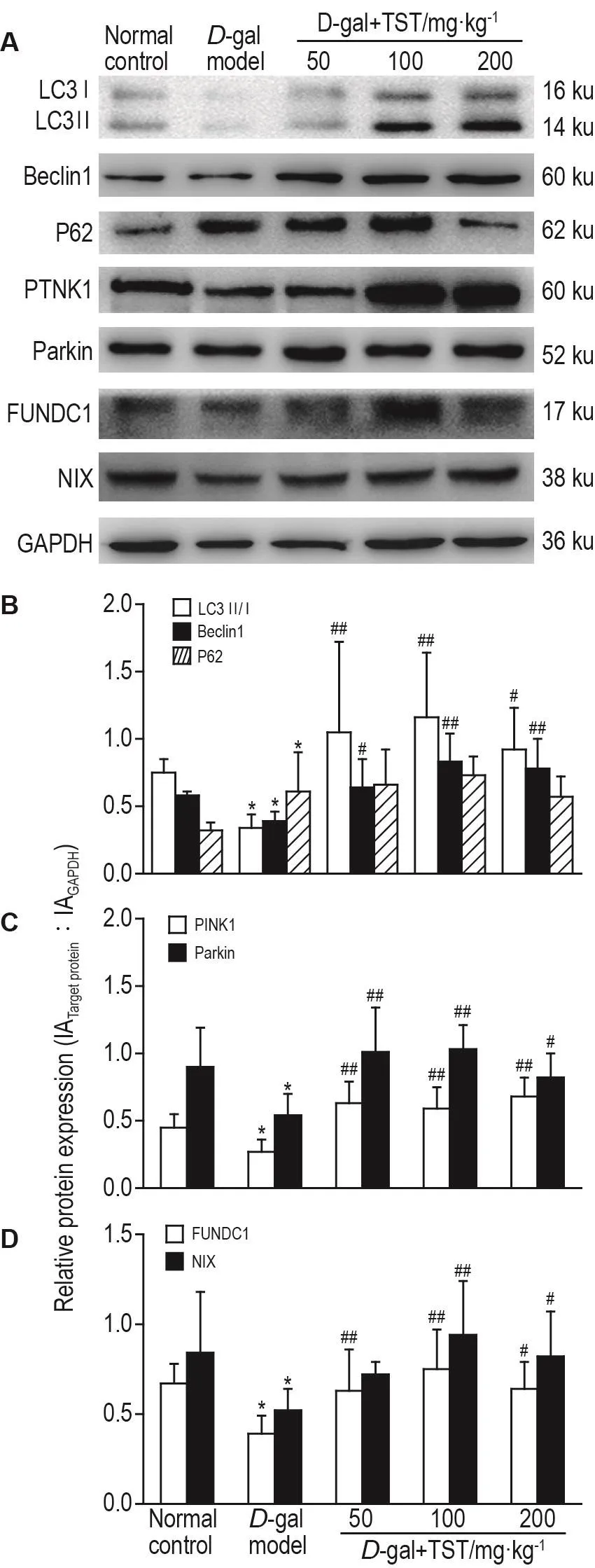
Fig.3 Effect of TST on ratio of LC3Ⅱ/Ⅰ and on protein expressions of Beclin1,P62,PlNK1,Parkin,FUNDC1 and NlX in myocardial tissue of rats with myocardial injury induced by D-gal deteced by Western blotting.See Tab.1 for the rat treatment.B,C and D were the semi-quantitative results of A.±s,n=5.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with D-gal model group.
2.4 TST对D-gal诱导的心肌损伤大鼠心肌组织中LC3Ⅱ/Ⅰ 比值 、Beclin1、P62、PlNK1、Parkin、FUNDC1和NlX蛋白表达的影响
Western印迹结果如图3所示,与正常对照组相比,D-gal模型组中 LC3Ⅱ/Ⅰ比值、Beclin1、PINK1、Parkin、FUNDC1及NIX蛋白表达降低(P<0.05),P62表达增加(P<0.05);与D-gal模型组相比,D-gal+TST各剂量组LC3Ⅱ/Ⅰ,Beclin1,PINK1和Parkin,FUNDC1蛋白表达均增加(P<0.05,P<0.01),D-gal+TST 100和200 mg·kg-1组NIX蛋白表达显著增加(P<0.05,P<0.01),D-gal+TST 200 mg·kg-1组P62蛋白表达无明显变化。
3 讨论
本研究结果表明,TST可降低大鼠血清心肌酶水平,减轻大鼠心肌组织的病理损伤,并升高自噬活动关键蛋白LC3Ⅱ/Ⅰ比值和Beclin1表达,P62蛋白表达降低。LC3能募集自噬相关蛋白形成自噬小体,一般认为LC3Ⅱ/Ⅰ比值一定程度上可反映自噬水平,Beclin1是调控自噬水平的必要因子,而P62在自噬过程中作为底物在自噬溶酶体中降解[10-11]。本研究结果提示,TST可减轻由D-gal引起的心肌细胞损伤,其作用机制可能与增强线粒体自噬活动有关。
当细胞受到应激等刺激导致线粒体功能异常时,可通过多种独立和交叉的途径介导线粒体自噬的发生,对损伤线粒体进行降解。如当线粒体膜电位消失时,PINK1稳定在损伤线粒体外膜上并维持其激酶活性,同时招募原本处于抑制状态的Parkin并使其磷酸化,活化后的Parkin可催化线粒体蛋白泛素化,并介导其与选择性自噬受体结合,后与LC3连接形成线粒体自噬,该途径为PINK1-Parkin介导的线粒体自噬;另外还有线粒体自噬受体FUNDC1和NIX途径,通过与自噬结构蛋白LC3的结合将后者招募至损伤的线粒体上,从而诱导线粒体自噬[12]。本研究结果表明,TST能上调大鼠心肌组织中线粒体自噬相关蛋白PINK1、Parkin、FUNDC1和NIX的表达水平,提示TST可通过调控PINK1-Parkin信号通路及NIX/FUNDC1受体介导途径来增强线粒体自噬水平。
综上所述,TST可通过调控PINK1-Parkin信号通路及NIX/FUNDC1受体介导途径来增强大鼠心肌线粒体自噬水平,从而减轻心肌细胞损伤。TST具有抗癌、抗炎和清除自由基作用,改善心功能和抗衰老等多种功效,因此众多活性成分可从多环节、多靶点调节机体功能,从而达到综合治疗的目的。开展TST对线粒体自噬的调节作用及相关机制研究,对于揭示其药效物质基础和机制、实现中药现代化以及防治相关疾病具有重要意义。

