牛蒡子苷对三阴性乳腺癌MDA-MB-453细胞增殖和凋亡的影响及作用机制
李霖枫,陈重华,李天平
(四川大学1.华西药学院,2.临床医学院,3.华西医院,四川 成都 610041)
乳腺癌是全球女性最常见的侵袭性肿瘤,严重威胁女性身心健康。《全球癌症统计报告》[1]显示,2020年全球新增乳腺癌患者约226万,发病率为11.7%,死亡率为30%(68/226)。乳腺癌具有高度分子异质性,其中三阴性乳腺癌以雌激素受体、孕激素受体和人表皮生长因子受体2阴性表达为特征,占所有乳腺癌的15%~20%,多发于绝经前女性,癌肿体积大,易发生转移,恶性程度高,预后相对最差[2-4]。由于缺乏有效治疗靶点且对内分泌治疗不敏感,化疗仍是目前针对三阴性乳腺癌唯一有效的全身治疗措施,常以蒽环类、紫杉类和铂类药物为首选方案[5-6]。然而,化疗药物存在明显的不良反应,如心脏毒性、骨髓抑制和神经损伤等,造成很多患者治疗依从性差,生活质量下降;部分患者在治疗过程中出现耐药现象,导致化疗失败[4,7]。据统计,Ⅱ~Ⅳ期三阴性乳腺癌患者5年生存率明显低于其他类型乳腺癌[5]。因此,积极寻找有效、低毒的治疗药物是药物科学家面临的重要任务。
药用植物在药物发现领域占有重要地位,是新化学实体开发的重要资源。临床上约有1/3药物来源于天然产物或其衍生物,如抗癌药紫杉醇和抗疟药青蒿素。牛蒡子苷(arctiin,ARC)是中药牛蒡子的主要活性成分之一,具有抗炎、抗病毒、降血糖、抗肿瘤等药理作用,可用于防治糖尿病肾病[8-9]。研究表明,ARC能有效抑制多种肿瘤细胞生长,如前列腺癌、骨髓瘤、乳腺癌和结肠癌等[10-12],提示ARC可能是一种潜在的抗肿瘤药物。Lee等[13]发现,ARC是一种信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)抑制剂,可诱导多发性骨髓瘤细胞G2/M期阻滞和凋亡。李孝庆等[14]报道,ARC能降低Bcl-2表达,诱导前列腺癌PC3细胞发生非凋亡性死亡。为阐释ARC对三阴性乳腺癌的治疗作用,本研究探讨ARC对三阴性乳腺癌MDA-MB-453细胞增殖和凋亡的影响及其作用机制。
1 材料与方法
1.1 细胞系
人三阴性乳腺癌MDA-MB-453细胞(中国医学科学院基础医学研究所细胞资源中心,资源编号:3111C0001CCC000016):接种于含有10%胎牛血清、1%青-链霉素的RPMI 1640培养基中,置于5% CO2,37℃恒温及饱和湿度细胞培养箱中培养。细胞贴壁生长,稳定传代后,取对数生长期的细胞进行实验。
1.2 药物、试剂和仪器
ARC(成都瑞芬思生物科技有限公司,批号:N-004-100 mg,纯度>98%):溶于细胞培养级DMSO配制浓度为100 mmol·L-1储备液(DMSO终浓度≤0.5%),避光保存于-80℃。实验时取适量储备液,用完全培养基配制浓度为1 mmol·L-1的ARC母液。
RPMI 1640培养基和0.25%胰蛋白酶(批号:SH30809.01和SH30042.01),美国Hyclone公司;胎牛血清(批号:04-001-1ACS),以色列BI公司;CCK-8试剂盒(批号:HY-K0301),美国MCE公司;细胞周期和细胞凋亡检测试剂盒(批号:KGA512和KGA108),江苏凯基生物技术股份有限公司;GreenNuc™活细胞胱天蛋白酶3活性检测试剂盒和BCA蛋白浓度测定试剂盒(批号:C1168S和P0012),上海碧云天生物技术有限公司;二抗:辣根酶标记山羊抗兔IgG和辣根酶标记山羊抗小鼠IgG(批号:ZB-2306和ZB-2305),北京中杉金桥生物技术有限公司;一抗:兔抗人周期蛋白依赖性激酶2(cyclindependent kinases,CDK)单抗、兔抗人CDK4单抗、兔抗人细胞周期蛋白D1单抗、小鼠抗人细胞周期蛋白E1单抗、兔抗人P27 KIP1单抗、兔抗人β肌动蛋白单抗(批号:2546T,12790T,2978T,4129T,3686T和4970T),美国CST公司。
倒置相差显微镜和OBSERVER D1/AX10 cam HRC倒置荧光显微镜,德国Zeiss公司;CO2培养箱,德国Binder公司;EON酶标仪,美国BioTek公司;Cytoflex流式细胞仪,美国Beckman公司;Mini P-4小型垂直电泳系统和Mini TBC小型湿式转印电泳槽,北京凯元信瑞仪器有限公司;ChemiDoc MP化学发光成像仪,美国Bio-Rad公司。
1.3 CCK8法检测细胞存活
取200 μL细胞悬液接种至96孔板(每孔3×104细胞),贴壁生长24 h。用不同浓度ARC(100,200,300,400和500 μmol·L-1)处理24,48和72 h,细胞对照组不予药物干预。加入100 μL CCK8工作液,37℃避光孵育1~2 h,测定450 nm处的吸光度值(A450nm),计算各组细胞存活率。每组设5复孔,实验重复3次。细胞存活率(%)=(药物组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。后续实验均以48 h为药物干预时间。
1.4 平板克隆实验检测细胞克隆形成率
取2 mL细胞悬液接种至6孔板(每孔2000细胞),贴壁生长24 h。加入ARC 25,50,100和200 μmol·L-1处理48 h,细胞对照组不予药物干预。撤药后用新鲜培养基继续培养,当孔板内出现肉眼可见集落时,终止培养,用4%多聚甲醛固定,吉姆萨染色液染色15~30 min,计数克隆,计算各组克隆形成率。克隆形成率(%)=克隆数/细胞接种量×100%。实验重复3次。
1.5 流式细胞仪检测细胞周期分布
参照细胞周期检测试剂盒说明书进行。取2 mL细胞悬液接种至6孔板(每孔4×105细胞),贴壁生长24 h。加入适量无血清培养基,饥饿处理8 h。药物干预(同1.3)48 h。收集细胞于2 mL离心管中,350×g离心5 min,用预冷的PBS清洗1~2次,保留细胞沉淀。用300 μL预冷的PBS重悬细胞,缓慢滴加至700 μL预冷的无水乙醇中,混匀后于4℃静置过夜。洗去固定液,加入300 μL PI/RNA酶A染色工作液,室温避光孵育30~60 min。上机检测。利用Modfit LT软件分析细胞周期分布。实验重复3次。
1.6 荧光显微镜观察胱天蛋白酶3活性
参照GreenNuc™活细胞胱天蛋白酶3活性检测试剂盒说明书。取200 μL细胞悬液接种至96孔板(每孔3×104细胞),贴壁生长24 h。药物干预(同1.3)48 h。PBS洗涤1~2次。取适量1 mmol·L-1胱天蛋白酶3荧光耦联底物,用完全培养基稀释至5 μmol·L-1,每孔加入100 μL,室温孵育15~30 min,每组设3复孔,用荧光显微镜定性观察绿色荧光并拍照。绿色荧光越多,表明酶活性越强。
1.7 流式细胞仪检测细胞凋亡率
参照细胞凋亡检测试剂盒说明书进行。取2 mL细胞悬液接种至6孔板(每孔4×105细胞),贴壁生长24 h。药物干预(同1.3)48 h。收集细胞于2 mL离心管中,350×g离心5 min,用预冷PBS清洗1~2次,保留细胞沉淀。加300 μL结合缓冲液,吹打混匀,再加 5 μL Annexin Ⅴ-FITC 和 5 μL PI,室温避光孵育5~15 min。上机检测。利用FlowJo V10软件分析细胞凋亡率。实验重复3次。
1.8 Western印迹法检测CDK2、CDK4、细胞周期蛋白D1、细胞周期蛋E1和P27Kip1蛋白表达
收集ARC(100,300和500 μmol·L-1)组和细胞对照组细胞,分别加适量裂解液,冰上裂解30 min,14 000×g离心15 min,收集上清,采用BCA法测定蛋白质浓度。调整各组蛋白质浓度,加适量5×上样缓冲液,95℃变性5 min。SDS-PAGE垂直凝胶电泳(80V→120 V),200 mA冰浴转膜1.5 h,5%脱脂奶粉封闭1 h,一抗(1∶1000)4℃孵育过夜,TBST洗膜3次,二抗(1∶1000)室温孵育1 h,再次洗膜3次,ECL发光液显影。凝胶成像系统扫描条带,Image J软件进行积分吸光度值(integrated absorbance,IA)分析,计算各组目标蛋白IA与内参蛋白β肌动蛋白IA的比值,表示目标蛋白相对表达水平。实验重复3次。
1.9 统计学分析
2 结果
2.1 ARC对MDA-MB-453细胞存活率的影响
CCK8法结果(图1)显示,与细胞对照组相比,ARC 100,200,300,400 和 500 μmol·L-1可 使MDA-MB-453细胞存活率显著降低(P<0.01),但同一时间点各浓度组间并无明显差异。然而,在同一浓度下,48 h组细胞存活率明显低于24 h组(P<0.05,P<0.01),72 h组细胞存活率明显低于48 h组(P<0.05,P<0.01)。
2.2 ARC对MDA-MB-453细胞克隆形成的影响
平板克隆实验结果(表1)显示,与细胞对照组相比,ARC 25 μmol·L-1组MDA-MB-453细胞克隆形成率明显降低(P<0.05),50,100和200 μmol·L-1组克隆形成率显著降低(P<0.01),提示ARC能有效抑制该肿瘤细胞的体外增殖。
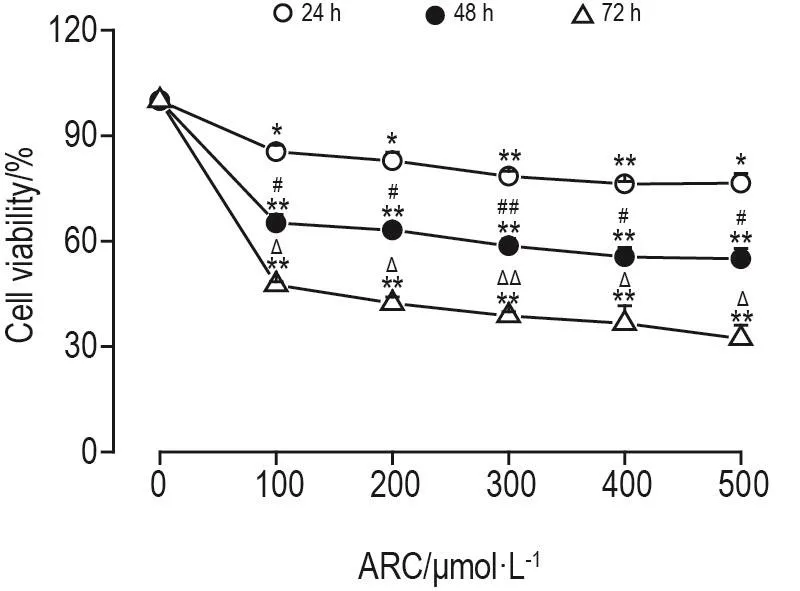
Fig.1 Effect of arctiin(ARC)on cell viability of MDAMB-453 cells.MDA-MB-453 cells were incubated with ARC 100,200,300,400 and 500 μmol·L-1for 24,48 or 72 h.Cell viability was detected by CCK8 assay.±s,n=3.*P<0.05,**P<0.01,compared with cell control(0 μmol· L-1)group;#P<0.05,##P<0.01,compared with corresponding 24 h group;ΔP<0.05,ΔΔP<0.01,compared with corresponding 48 h group.
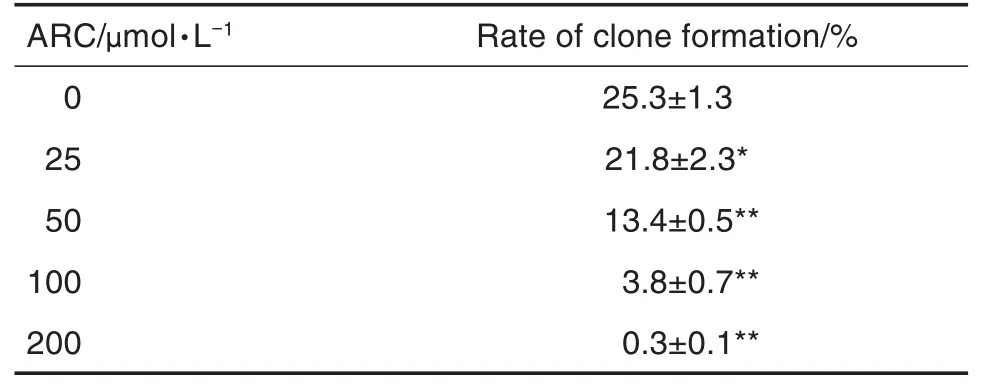
Tab.1 Effect of ARC on clone formation of MDA-MB-453 cells
2.3 ARC对MDA-MB-453细胞周期的影响
流式细胞检测结果(图2)显示,与细胞对照组相比,MDA-MB-453细胞经ARC 100,200,300,400和500 μmol·L-1处理48 h后,G0/G1期细胞百分比显著增加(P<0.01),S期细胞百分比显著降低(P<0.01),G2/M期细胞百分比无明显变化,提示ARC可干预细胞周期进程。

Fig.2 Effect of ARC on cell cycle of MDA-MB-453 cells by flow cytometry.MDA-MB-453 cells were incubated with ARC 100,200,300,400 and 500 μmol·L-1for 48 h.B was quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control(ARC 0 μmol·L-1)group.
2.4 ARC对MDA-MB-453细胞内胱天蛋白酶3活性的影响
胱天蛋白酶3荧光染色结果见图3,细胞对照组处于正常生长状态,胞内胱天蛋白酶3活性低,镜下几乎未见绿色荧光;ARC各浓度组镜下也仅可见零星绿色荧光,提示MDA-MB-453细胞经ARC刺激后胞内胱天蛋白酶3活性未明显提高。
2.5 ARC对MDA-MB-453细胞凋亡的影响
细胞对照组和 ARC 100,200,300,400 和500 μmol·L-1组细胞死亡率分别为(5.9±1.6)%,(15.1±1.3)%,(15.1±0.5)%,(12.1±1.1)%,(13.8±2.6)%和(15.0±2.1)%(均P<0.05)(图4)。与细胞对照组相比,ARC各浓度组凋亡晚期与坏死细胞百分比显著升高(P<0.01),但早凋细胞百分比无显著差异,提示ARC可能未诱导该细胞凋亡。
2.6 ARC对MDA-MB-453细胞CDK2、CDK4、细胞周期蛋白D1、细胞周期蛋白E1和P27蛋白表达的影响
Western印迹结果(图5)显示,与细胞对照组相比,ARC 100,300和 500 μmol·L-1组 MDA-MB-453细胞内CDK4和细胞周期蛋白D1蛋白水平明显下降(P<0.01),CDK2和细胞周期蛋白E1无明显变化;ARC 100和300 μmol·L-1组P27蛋白水平显著增加(P<0.05)。

Fig.3 Effect of ARC on activity of caspase 3 in MDA-MB-453 cells.See Fig.2 for the cell treatment.The cells were fluorescent-stained and observed under a fluorescence microscope(GFP channel,×200).The more intense green fluorescence,the stronger the caspase 3 activity.
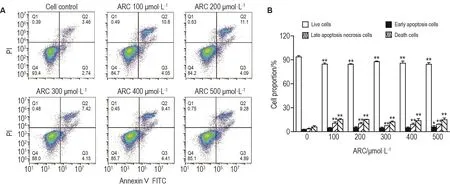
Fig.4 Effect of ARC on apoptosis of MDA-MB-453 cells by flow cytometry.See Fig.2 for the cell treatment.B was quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control(ARC 0 μmol·L-1)group.

Fig.5 Effect of ARC on protein expressions of cyclin dependent kinases(CDK)2,CDK4,cyclin D1,cyclin E1 and P27 in MDA-MB-453 cells by Western blotting.See Fig.2 for the cell treatment.IA:integrated absorbance.B was semi-quantitative result of A.±s.n=3,*P<0.05,**P<0.01,compared with cell control(ARC 0 μmol·L-1)group.
3 讨论
本研究实验结果表明,ARC不仅能有效降低MDA-MB-453细胞的存活率,还可显著减少单个细胞的克隆形成率,提示ARC对三阴性乳腺癌MDAMB-453细胞体外增殖能力具有抑制作用,ARC或能应用于三阴性乳腺癌的治疗。
恶性肿瘤的发生发展通常与细胞周期异常具有密不可分的关系。目前,细胞周期抑制剂已成为三阴性乳腺癌治疗策略的研究方向之一,如CDK4/6抑制剂(帕博西尼)对Rb基因高表达的三阴性乳腺癌细胞具有明显抑制作用[15-18]。本研究结果显示,ARC干预MDA-MB-453细胞后,S期细胞百分比明显下降而G0/G1期细胞百分比明显升高,推测ARC可能干扰细胞周期进程,可导致MDA-MB-453细胞发生G0/G1期阻滞。细胞周期受到精确且复杂的程序调节,其中CDK/细胞周期蛋白异源二聚体和CDK抑制因子是推动细胞周期运行的重要因素。细胞周期蛋白D是肿瘤细胞恶性增殖的重要因素之一,在多数乳腺癌细胞中均高表达[19]。一般而言,细胞周期蛋白D主要在G1期表达,能与CDK4/6结合形成复合物,磷酸化Rb蛋白,促进E2F转录因子释放和一系列相关基因转录,协同CDK2/细胞周期蛋白E推动G1/S期转化[20-21]。P27属非特异性CDK抑制因子,是G1/S检查点的关健分子,能与细胞周期蛋白D竞争性结合CDK4,导致G1期无法向S期转换[22-23]。CDK4和细胞周期蛋白D表达降低或P27表达升高均会导致G0/G1期阻滞,从而促使肿瘤细胞增殖抑制。既往研究显示,ARC可通过下调细胞周期蛋白D1表达以抑制骨肉瘤、肺癌、结直肠癌和乳腺癌等肿瘤细胞增殖[12]。本研究发现,经不同浓度ARC干预后MDA-MB-453细胞内P27蛋白水平显著上调,CDK4和细胞周期蛋白D1蛋白水平明显下调,CDK2和细胞周期蛋白E1表达未受影响,与先前报道一致[12]。由此可见,ARC可能通过调控CDK4、细胞周期蛋白D1和P27的表达来干扰MDA-MB-453细胞周期的进程。
细胞凋亡失衡是导致肿瘤无限增殖的另一重要因素,故调控肿瘤细胞凋亡过程也是肿瘤治疗的热点策略。胱天蛋白酶家族是存在于细胞质中一组具有高度同源性的蛋白酶,在细胞凋亡中扮演着重要角色,其中胱天蛋白酶3是细胞凋亡途径上的终末剪切酶,可作为标志性蛋白反映细胞凋亡状态。研究表明,ARC可通过胱天蛋白酶依赖性线粒体途径诱导多发性骨髓瘤[13]、肝癌[24]和胰腺癌[25]等肿瘤细胞发生凋亡。然而,本研究结果显示,MDAMB-453细胞在经过ARC处理48 h后,胞内胱天蛋白酶3酶活化水平和早期凋亡水平均无显著提高,提示凋亡诱导可能并非ARC发挥抗肿瘤效应的作用方式。由于ARC组细胞坏死率较细胞对照组有小幅度提升(3.4%→10.0%),推测ARC或许可造成MDA-MB-453细胞非凋亡性坏死,与李孝庆等[14]报道相似,这可能不是造成MDA-MB-453细胞生长抑制的主要原因。
综上,ARC能有效抑制三阴性乳腺癌MDAMB-453细胞增殖且可干预细胞周期进程,其作用机制可能与下调CDK4、细胞周期蛋白D1蛋白水平和上调P27表达有关。本研究扩展了ARC在抗肿瘤方面的潜在应用,在持续深入开展机制研究的基础上,ARC有望开发为一种靶向细胞周期治疗的抗肿瘤药物。但本研究仅在细胞水平进行了探讨,结果具有局限性,是否存在其他作用机制有待进一步研究。

