风险评估行为:焦虑相关动物模型的重要评价指标
郑天歌,张青杰,贾靖仪,梁建辉
(北京大学药学院分子与细胞药理学系,北京 100083)
焦虑障碍(anxiety disorder)是一种常见的慢性精神疾病,正因其广泛的躯体症状、复杂的并发症、高复发率和显著的性别差异受到越来越多研究者的重视。
动物模型是研究人类疾病的简化方法,焦虑动物模型则可帮助科研人员间接解析焦虑这种复杂的心理活动,在焦虑药物的发现、改良与焦虑疾病的神经生物学机制研究方面均有重要价值。近20年来,为改善现有抗焦虑药物临床使用效果欠佳和不良反应大的状况,新型抗焦虑药物相关研究与日俱增,但许多化合物却在临床和(或)非临床试验中展现出与预期不相符的药理学作用,其中一个关键原因是缺乏对不同种类药物普遍适用的焦虑动物模型[1]。这一方面表明,研究者有必要不断设计更加合理的实验程序来评估动物的焦虑样行为,另一方面意味着焦虑及其相关行为的表征仍有待全面挖掘,为新的、更合理的模型和实验程序提供基础。
由美国国立精神卫生研究院(National institute of mental health,NIMH)资助的用于研究精神障碍的Research Domain Criteria项目通过对野生和实验室饲养的啮齿类动物的焦虑反应进行详细的行为学分析,将焦虑描述为“一种针对潜在或不确定威胁的中枢神经系统激活,伴随着特征性响应模式如风险评估(risk assessment,RA)或警惕性的增强”。此定义既明确了焦虑个体产生的是一种对潜在威胁的预期,而非对正在面临着的、明确存在的威胁的恐惧这一传统概念,又明确了焦虑与特定的防御性反应(如RA行为)密切相关[2]。
1 风险评估行为
RA行为是一种经演化形成的先天性防御机制,用以描述实验环境下实验动物对潜在威胁的反应,并与野生动物的警觉(vigilance)表现进行区分[3],可见于条件性刺激[4]和非条件性刺激[5]。Blanchard等[6]在1989年将RA行为描述为:当面对潜在威胁性刺激时,大鼠通常会减少或停止正在进行的动作,面向刺激的方向,耳朵向前以试图捕捉细微的声响,同时头部缓慢地左右移动,利用视觉和嗅觉对周围环境进行检查并收集相关信息。
1.1 风险评估行为的功能
RA行为涉及复杂的认知过程,能够帮助动物判断威胁性刺激是否代表真正的危险、定位刺激的来源、获得刺激相关特征、规划最佳逃生路线或躲避地点。通过明确这些信息,动物方可针对特定威胁做出最佳的防御反应,如攻击(fight)、木呆(freezing)或逃跑(flight),因为未经确定的威胁性刺激本身就是一种特殊的危险——试图解决或对其进行规避可能会适得其反。简而言之,RA能够使动物以更高的精确度来预测其针对特定威胁可能做出的每种防御行为的成功率[6-7]。RA的另一个重要功能是在警报解除时降低个体的防御反应,使之回归正常活动[3]。这一过程同样涉及决策相关的认知活动,但与检测到威胁后立即做出防御反应相比,确定潜在危险不存在或已消除的过程通常持续更长的时间[6,8],因为个体需要对其判断结果进行充分的评估,以避免由于威胁仍未消失所致的灾难性后果[3]。从进化角度来讲,RA的这种功能具有很好的适应性,能够帮助生物个体从紧张、焦虑的情绪中转移,并重新投入其他事项(图1)。而显然,此过程的损害可导致防御反应时间延长、精神耗损加速,同时阻碍非防御行为的进行,进而影响到正常生活,正如许多慢性焦虑、抑郁和创伤后应激障碍患者的临床表现[9-10]。
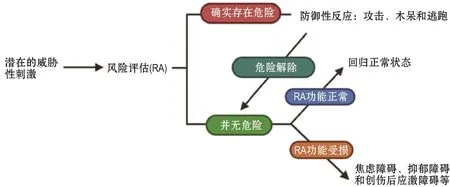
图1 风险评估过程及风险评估行为的功能.
1.2 风险评估行为的神经生物学机制
神经科学相关研究已针对性地解析了负责攻击、木呆和逃跑等特定防御行为的脑区,但对RA行为的机制却鲜有涉及[11]。
纹状体是负责风险相关决策的脑区之一,可编码特定行动与结果的关联性,并根据预期奖励选择行动路线,在目标导向行为中发挥着重要作用[12]。其中,背侧纹状体可通过将感觉运动、认知和动机信息整合到纹状体皮质的回路,直接诱导风险相关评估、决策和选择的发生。研究发现,纹状体活动与赌博等高风险活动的选择相关:当面对具有高收益前景的选择时,纹状体的背侧和腹侧等多个区域都十分活跃;而当存在难以忽略的潜在威胁或损失时,纹状体的活动减少[13]。
2017年,Motta等[14]提出了一个调控RA行为的神经通路:背侧中脑导水管周围灰质-外侧隔前额背外侧区-腹侧海马-内侧前额叶皮质。2020年日本学者发现,下丘脑穹隆周区(hypothalamic perifornical area)的尿皮质素3(Urocortin 3,Ucn3)神经元参与调节了小鼠对潜在威胁的RA行为[11]。此外,富含5-羟色胺(5-hydroxytryptamine,5-HT)能神经元的中缝核也具有调控RA行为的功能,且这种调节主要是通过中缝中核内的5-HT1A受体而非5-HT2A/2C受体来实现[15-16]。
1.3 拉伸-专注姿态
拉伸-专注姿态(stretch-attend posture,SAP)最早于 1986 年提出[17],用以与 1963 年 Grant和Mackintosh提出的4种啮齿类动物在社交情景中的“stretched attend”行为进行区分[18],描述了小鼠在非社交情境下展现出的矛盾倾向,表现为在应激条件下啮齿类动物将躯体尽力向前伸展,而后再返回原位、不产生空间上位移的动作。类似的行为活动还包括向前式SAP(forward in SAP)、拉伸式位移(flat-back approach behavior),用于表述啮齿类动物拉伸躯体、背部平展,同时缓慢向前移动的过程[17,19-20]。这些行为被认为是动物心理冲突的行为表现,即对于是应接近还是远离应激源而摇摆不定(ambivalent element reflecting an avoidanceapproach tendency)。
作为一种可量化的指标,SAP已在高架十字迷宫(elevated plus-maze,EPM)、旷场(open field,OF)、大鼠暴露测试(rat exposure test)和遮盖拉伸姿态测试(canopy stretch attend posture test)中进行了行为药理学评估,并被纳入了RA行为的范畴[21-22],也正在逐渐成为RA的代表性检测指标。其原因在于,一方面,目前的科技手段几乎无法解析动物应激时的思考,包括冲突、抉择、风险判断和承担等多个过程,但却可以通过检测这些思想活动的外在行为表现来对其进行间接的描述和研究。相比嗅闻、聆听、转头、扫视、静止等行为特征,SAP对RA的表现似乎更加全面——通过躯体的拉伸和对气味的分辨,动物可谨慎地接近刺激源并仔细研究周围环境,尽可能多地收集有关威胁性因素的信息,从而做出最佳决断。另一方面,对于如啮齿类等群居动物而言,实验室一般采用每笼4~5只随机合笼饲养。在饲养过程中,同笼动物会通过打斗等方式区分社会等级,然而这种常见的等级区别并不影响小鼠在SAP测试中的表现[17]。同时,随着计算机技术的发展,对动物进行跟踪定位和行为分析的软件越来越多,检测也更加便捷和准确[23],这些都为SAP作为RA指标被纳入行为学实验提供了良好的基础。
2 药物作用与风险评估行为
RA受损所致的认知适应不良与焦虑表现之间存在某些明显的相似性,表明两者之间可能存在生物学关系[3],使用已知作用的中枢神经系统药物或可间接揭示这种关系。需要注意的是,即便是同种药物,在不同模型中的药理学作用也缺乏可比性。例如,模型诱导的焦虑强度对RA活动的变化具有很大影响[2]。在高强度的威胁性刺激下,通过抗焦虑药减弱动物对威胁强度的感知通常会增加RA行为,减少更为明确的防御反应,如逃逸和静止;在低强度威胁性刺激下,降低威胁强度却可减少RA行为。除此之外,不同焦虑类型、不同实验条件均会导致RA行为水平和用药效果的不同。因此,在给定情况下解释RA行为的改变,不仅需要有关威胁性刺激的信息,还需要结合同时间段的其他防御行为进行判断。
Kaesermann[17]在系列研究中发现,在高架平板(elevated plastic platform)模型中,单次ip给予苯二氮类抗焦虑药地西泮可剂量依赖性地降低小鼠SAP的累计时长,但三环类抗抑郁药丙米嗪则无此效果,表明RA与焦虑的关系较抑郁更加紧密。同时,在该实验中,药物对SAP的作用效果无品系间的显著差异。
在另一种刺激强度的结构化模型——小鼠防御测试组系(mouse defense test battery,MDTB)[24]中,对广泛性焦虑障碍(general anxiety disorder,GAD)有效的经典抗焦虑药物,如苯二氮类可持续降低RA行为,提示RA可能与GAD相关[9]。有趣的是,三环类和选择性5-HT重摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)类抗抑郁药在长期给药时也可减少RA行为的出现[25-26],而SSRI是目前临床治疗焦虑障碍的一线用药。相似的药效结果也已在EPM中观测到,SSRI类药物氟伏沙明、齐美定和丙米嗪急性给药对大鼠和小鼠EPM中的RA行为均无影响[28],但SSRI类药物氟西汀和帕罗西汀慢性给药却能显著降低大鼠和小鼠在EPM中RA行为的出现频率,展现出明显的抗焦虑作用[28-29]。此外,新型快速抗抑郁药氯胺酮急性给药也对EMP中大鼠的SAP频率无影响[40]。上述结果不仅与临床GAD和其他焦虑相关疾病治疗的用药模式相印证[31-32],也进一步证实了RA行为与神经递质5-HT及焦虑障碍之间的关系[2]。
丁螺环酮(buspirone,Bus)是一种非典型抗焦虑药,已在临床上被证实对GAD和惊恐障碍(panic disorder)有效[31-33]。然而在不同模型中,Bus 对RA的作用却不尽相同[34]。在高架迷宫中,Bus(1~4 mg·kg-1,ip)仅降低了大鼠SAP的次数,而对传统时空(spatiotemporal)行为学指标无显著性影响;在明/暗箱测试中,Bus仅在高剂量(10和15 mg·kg-1,ip)时降低小鼠SAP的次数;在自由探索实验中,Bus(1.25~5 mg·kg-1,ip)无效;在 MDTB模型中,Bus对RA行为并无明显作用,但1.25~5 mg·kg-1剂量时可降低小鼠的情境性防御和攻击行为。与之相比,地西泮在上述所有模型中均产生了抗焦虑作用,表现为RA行为活动降低、回避行为减少、探索活动增加和情景焦虑降低[35]。Bus的药理作用在模型间的不一致性可能与焦虑模型的类型和模型诱导的焦虑强度均有关系。另一方面,焦虑的组成是复杂的,不仅包括RA,还包括高反应性和高攻击性等特点,而对诸如Bus等药物而言,其抗焦虑作用可能更多地通过影响非RA行为的其他焦虑特征而实现[3,35]。
3 风险评估行为在焦虑行为学模型中的应用
即便在啮齿类动物模型中,RA行为仍然代表了一种复杂的模式[2]。
以EPM为例,其基本原理是利用啮齿类动物对开放场地的先天性厌恶和(或)警惕及对狭小、封闭区域的喜好,诱导其产生对模型的空间偏好。在EPM中,RA行为通常表现为明显的SAP[36-37]。有时,开放臂末端处的探头动作也被归为RA行为,而这一动作发生的位置距离中央平台越远,表明动物的焦虑程度越低。自创建以来,EPM实验在经济性、可操作性和结果统计速度等方面均具有极大的优势[38],加之其检测指标对苯二氮类抗焦虑药的灵敏性[39],一直是研究焦虑机制和筛选抗焦虑新药最常用的非临床研究范式。但同时,EPM也存在一些缺点,最为典型的便是其对(尤其是低剂量的)Bus和SSRI等非典型抗焦虑药不敏感[39-41]。
3.1 风险评估行为作为检测指标的优势和功能
在使用EPM检测啮齿类动物的焦虑水平时,常用的指标主要针对大、小鼠对该模型开放臂的回避性,包括进入开放臂的潜伏期、进入开放臂的次数和开放臂停留时间[19]。然而,相关研究发现,在诸如OF和EPM等焦虑动物模型中,在经过一段时间的探索后,即便啮齿类动物不再回避进入非保护的相对开放的区域,它们也可能会在该区域展现出大量的SAP。因此,RA行为被认为是表现动物紧张情绪的更加敏锐的指标,在对焦虑相关药物的测评方面或许比传统常用的回避类行为指标更加灵敏[42-43]。
RA能够帮助动物在存在潜在威胁的情境中更加全面地获取环境信息并制定行为策略,也能够更加精准地衡量动物情绪的反应与变化[3]。这一观点已在EPM相关实验中得到了验证。较高剂量的Bus(2.5~5.0 mg·kg-1)可在EPM中降低开放臂回避性,并展现出对动物一般活动的抑制;低剂量的Bus虽无法诱导开放臂回避性的减少,却可显著降低SAP等RA行为的出现次数和频率,展现出抗焦虑效果[44]。这说明通过加入RA作为EPM的评分项可以提高检测的灵敏度,同时也在一定程度上弥补了该模型在药物适用性方面的缺陷。另一方面,RA也被证实可用于区分药物的抗和(或)致焦虑作用与镇静作用。间氯苯哌嗪(m-chlorophenylpierazine,mCPP)是一种作用于脑内5-HT系统的致焦虑剂,已被用于诱导大鼠明暗箱焦虑模型。在测试中,mCPP虽减少了动物在EPM开放臂的活动时间,但却显著增加了SAP出现的次数和频率,说明mCPP确实具有致焦虑作用,而其诱导的开放臂活动的减少也并非由于其具有镇静和(或)活动抑制作用[45-46]。
此外,目前许多焦虑动物行为学模型在研究中的应用并不规范,如不合理地、重复使用同一批实验动物进行药效学检测。在EPM中进行的测试/再测试操作模式(test/retest protocol)显示,首次的实验经历(通常为5 min)会显著影响动物在第2次实验中的行为学检测结果,表现为开放臂回避倾向的增加[47-48]。全时程分析显示,在首次实验的前2 min内,动物在新奇性的驱使下对开放臂和闭合臂进行几乎等时长的探索,而随后则更愿意将时间花费在能提供安全感的闭合臂,但这一过程并不伴随RA行为和活动度水平的显著性变化,说明此过程不存在一般性的行为抑制;而在第2次实验的前1 min内,与首次实验相比,动物展现出了更高水平的RA行为和探索行为,随后才出现明显且高度的开放臂回避[47]。这或许表明,在第2次实验中,动物于短时间内对模型环境进行了迅速的再熟悉,即出现了首试耐受(one-trial tolerance)现象[48-49],可导致行为学结果不准确,进而影响到抗焦虑药物药理学检测的准确性,出现假阴性结果。然而,在某些特定的验证性和排除性实验中,进行重复测试则可排除药物的假阳性作用。例如,首次测试中,米达唑仑(midazolam)和东莨菪碱(scopolamine)均可引起EPM中开放臂的探索次数和停留时间增加,但在再测试中,时段分析显示,给药组动物表现出了异常的行为结构,即在再次面对熟悉环境时采取与对照组不同的认知行为策略,而米达唑仑给药组则与对照组无明显差异[50-51]。这一结果与相关研究的发现相佐,米达唑仑具有典型抗焦虑作用,而莨菪碱则通过损害学习记忆过程影响动物在行为学模型中的表现[51-53]。
3.2 风险评估行为相关研究
关于EPM中RA行为的相关研究早在30年前就已经取得了一定的进展。在RA行为的细化方面,1992 年 Rodgers等[54]开发了啮齿动物基于EPM的8种行为模式,包括进入开放臂、进入闭合臂、嗅闻、直立、梳理、试探性穿梭、拉伸姿态和探头(head dips)。随后又在这一基础上,将SAP、探头、嗅闻和拉伸式位移按其在模型中发生的位置分为保护型(protected)和非保护型(unprotected)。其中,保护型定义为动作发生于闭合臂和(或)中央平台,非保护型定义为动作发生于开放臂[19]。1997年,Fernández Espejo[55]在 Rodgers 等研究的基础上进行了马尔可夫分析(Markovian analysis),给出了小鼠在EPM中行为的顺序结构图,发现这8种行为模式以嗅闻为核心,呈放射状排列,相互独立而又存在联系。这种顺序结构及其在给药后出现的变化对于测试抗焦虑药物的药理作用具有重要意义。
在RA行为的归类方面,1994年Cruz等[56]就大鼠EPM模型的行为学(ethological)指标和时空数据(如开放臂和闭合臂的停留时间及进入次数等)进行了因子分析(factor analysis),并将这些指标和数据划分为了4个维度,分别代表焦虑(anxiety)、活动(activity)、决策(decision making)和位移(displacement)。该研究发现,RA在焦虑、决策和位移3个维度中都有涉及,这虽然对于RA这种既涵盖对危险的认知又包括对风险的回避的行为来说是合理的,但这种多定位的概念同时又是模糊而容易产生争议的。同年,Rodgers等[19]利用小鼠EPM模型进行了类似的因子分析,并清晰地划分了6个维度,包括焦虑、水平运动(locomotion activity)、RA、决策、垂直运动(vertical activity)和探索(exploration)。而在RA维度,仅SAP和嗅闻的累计时长被纳入考量。2013年,Sorregotti等[57]对标准EPM进行了改良,使其4臂开放形成开放式高架十字迷宫模型(open EPM,oEPM),并在该模型中就ICR小鼠的行为学表现进行了因子分析,得到了3个独立因子,即深度探索(depth exploration,如探头)、谨慎探索(cautious exploration,如拉伸式位移)和RA(如SAP)。这些因子分析的研究不仅进一步确证了SAP与RA及RA与焦虑的相关性,还突出了动物行为学分析的多维性,既为焦虑的多角度解析提供了指导,也为基于EPM以及其他焦虑模型的药理学和基础医学研究提供了良好的开端和架构。
然而近年来,关于RA的研究却几乎停滞不前,其在焦虑行为学实验中也一直保持着相当低的使用率[58]。截至2021年5月24日,在Pubmed网站上搜索关键词“elevated plus maze”,共有相关文献8720篇,加入关键词“risk assessment”可获得219篇,替换为“stretch attend posture”则仅获得88篇文献,约占总研究数量的1%,国内研究对RA行为更是鲜有涉及。对于如此低的应用率,一种可能的解释是,与测量传统时空数据相比,加入RA评估后工作者将耗费更多的精力。但事实上,加入RA评估并不会显著增加数据收集和分析的时间,尤其是在这个图像分析工具越来越发达的时代。即便建立RA行为的测量体系需要相对较多的人力物力来对其进行分析,鉴于RA行为能增加焦虑相关药物检测的灵敏度、鉴别药物假阳性/假阴性作用及扩大模型的适用范围,这些前期的付出都是值得的[59]。
令人欣慰的是,一些科研人员仍在坚持RA行为相关的工作,并取得了一定的成果。2016年,Holly等[23]使用MATLAB开发了一款能够自动检测并分析啮齿类动物SAP行为的开放源算法(MATSAP),克服了人工量化SAP费时、易出错、主观性强的缺点。2019年,Oron等[60]发现,在孤独症谱系障碍中,纹状体谷氨酸能受体在RA行为的调控中扮演重要角色。Blanchard等也分别在2011[3]、2018[61]和 2019 年[2]对动物模型和人类疾病中的RA行为进行了全面、细致的综述。
本实验室近年也围绕RA行为开展了一些研究。使用自行研发的情景应激模型——梁氏情境应激箱研究发现,在相同时长内,梁氏情景应激箱内小鼠发生SAP的次数和持续时间均显著高于EPM和OF模型(待发表)。这一结果一定程度上填补了梁氏情境应激箱对小鼠焦虑相关行为影响方面的空白,为新模型的效度评估提供了实验依据。
4 焦虑动物模型方法学展望
疾病与动物、动物与人的转化研究一直是动物模型研究领域待解决的问题。2001年,美国国立精神卫生研究院就焦虑行为模型与焦虑症临床特征之间的关系进行了研讨,认为未来能够开发出准确反映焦虑致病因素的动物模型的可能性非常低,但却可通过更好地规范、定义和扩展与焦虑相关的现有模型和行为指标,建立影响因素和测量维度更加综合的新模型[62]。精神病学中动物模型的发展依赖于特定行为或其他神经生物学特征的发掘,因为研究永远无法让动物开口说出它们的心理、情感和认知过程。因此,与基于精神症状(表观效度)的模型相比,基于代表性的、适应性的和可量化的表型的动物模型可能更适合于精神疾病的研究[63]。
另一个尚未解决的问题是,现有或将来的焦虑动物模型如何能进一步提高预测效度,并有助于新药开发,这不仅需要模型具有良好的理论基础和评价体系,还需要临床焦虑症诊断标准的共同进步,而诊断标准应至少部分基于生理、行为等功能性模块的描述。
RA作为一种生物进化形成的行为模式,无疑符合了上述要求。该行为不仅涉及多种与潜在威胁和(或)焦虑相关的认知过程,还对许多临床抗焦虑药物有稳定的响应。在这个焦虑行为学模型迫切需要优化和革新的时代,我们相信RA会受到越来越多研究者的重视,并逐渐得到推广与使用。

