ADP核糖基化因子样6相互作用蛋白1(ARL6lP1)低表达对电离辐射所致小鼠小肠上皮细胞损伤的影响
闫 华,邢 源,叶雨萌,郝延辉,喻 超,贾兆乾,左红艳,李 杨
(1.军事科学院军事医学研究院辐射医学研究所,北京 100850;2.解放军总医院第六医学中心,北京 100048;3.河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口 075000)
小肠是人体内对电离辐射最敏感的器官之一[1-2]。电离辐射可通过破坏小肠上皮黏膜的隐窝-绒毛结构,影响小肠上皮黏膜的吸收及屏障功能,引发放射性肠损伤(radiation induced intestinal injury,RⅢ)[3-5]。RⅢ的发生发展是全身放射性损伤死亡和救治失败的关键原因,肠损伤及其导致的水电解质紊乱、酸碱失衡和严重的肠源性感染等均为急性放射性损伤的主要死亡原因[3,6-8]。腹部和骨盆肿瘤患者接受局部放射治疗后,通常会引发RⅢ,>15%的患者会形成慢性肠损伤,这不仅明显影响患者的生活质量,同时限制肿瘤放疗的剂量,一定程度上影响肿瘤的治疗效果[3,9-10]。但目前其损伤机制尚未阐明,缺少有效的诊断及防治措施。因此,亟需进一步探究其发病机制,寻找更为有效的RⅢ敏感生物标志物和防治靶点。
ADP核糖基化因子样6相互作用蛋白1(ADP-ribosylation factor-like 6 interacting protein 1,ARL6IP1)位于内质网内膜,对于维持内质网的结构和功能至关重要[11-13]。研究发现,Arl6ip1基因与肿瘤细胞耐药性相关,具有抗凋亡特性,参与肿瘤细胞的生长和侵袭等过程[14]。Arl6ip1基因还参与兴奋性突触中的主要兴奋性神经递质谷氨酸的调节,沉默其表达可引发功能障碍[15]。有报道认为,遗传性痉挛性截瘫和多发性感觉运动神经疾病等患者体内存在Arl6ip1基因突变体[16-17]。
本课题组前期制备了小鼠RⅢ模型,通过单细胞转录组测序技术研究细胞放射敏感性并筛选与放射敏感性相关基因,发现肠道主要类型细胞如小肠干细胞、上皮细胞、巨噬细胞和T细胞等不同亚群细胞辐射敏感性存在较大差异。通过对照射后肠道主要细胞类型的存活细胞基因表达特征进行分析,显示Arl6ip1基因表达出现特异性增高。为验证Arl6ip1基因在放射性损伤中的作用,本研究首先观察放射性肠损伤模型小鼠空肠组织ARL6IP1蛋白表达的变化;随后设计小干扰RNA(small interfering RNA,siRNA),构建Arl6ip1敲低的小肠上皮细胞IEC-6,观察ARL6IP1低表达对放射致DNA损伤和细胞存活率的影响。
1 材料与方法
1.1 动物、细胞、主要试剂和仪器
50只雄性SPF级C57BL/6N小鼠,体重20~25 g,北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0001,动物饲养在军事医学研究院动物房(温度21~23℃,湿度40%~60%)。IEC-6细胞,广州吉妮欧生物科技公司。为防止脱靶,根据Arl6ip1基因序列,设计3条序列不同的siRNA(表1)作用于Arl6ip1基因mRNA的不同位点,并合成双链阴性对照siRNA(negative control siRNA,siRNA-NC),siRNA序列由上海吉玛制药技术有限公司合成,分别插入慢病毒载体LV5(EF-1aF/GFP&Puro)中。小鼠抗人磷酸化组蛋白H2AX(phosphorylated histone H2AX,γH2AX)单抗、兔抗小鼠GAPDH单抗和兔抗人ARL6IP1单抗(一抗)及Alexa Fluor 647标记山羊抗小鼠IgG抗体(二抗),美国Abcam公司;辣根过氧化酶标记山羊抗兔IgG抗体(二抗),中山金桥公司;胎牛血清和DMEM液体培养基,美国Gibco公司;青霉素和链霉素溶液,美国HyClone公司;0.25% EDTA-胰蛋白酶,美国Sigma公司;BCA蛋白浓度测定试剂盒,北京索莱宝公司;CCK-8试剂盒,美国Bimake公司。
Tab.1 Small interfering RNA(siRNA)sequences targeting ADP-ribosylation factor-like 6 interacting protein 1(Arl6ip1)
60Co源,军事医学研究院;37℃细胞培养箱,美国Thermo公司;超净工作台,南通沪南科学仪器公司;蛋白电泳仪,北京六一仪器厂;台式高速离心机,上海医学分析仪器厂;FACS Calibur流式细胞仪,美国BD公司;多功能酶标仪(Victor-X3)和PE Time-lapse转盘共聚焦活细胞成像系统,美国PerkinElmer公司。
1.2 小鼠急性RⅢ模型的制备
将C57BL/6N小鼠随机分为正常对照组(10只)和照射组(40只),照射组采用60Co源γ射线进行照射。小鼠称重后ip给予0.5%戊巴比妥钠溶液麻醉。麻醉后固定于自制木板上,暴露腹部(上至剑突,下至耻骨联合),用铅砖将其余部位屏蔽,进行全腹部单次照射:靶距为3 m,剂量15 Gy,剂量率123.69 cGy·min-1;正常对照组进行假照射(将小鼠进行麻醉固定,但未照射)。照射后,每天观察小鼠的饮食、精神及活动状态及有无腹泻和血便等,记录体重和存活数。
1.3 Western印迹法检测小鼠空肠组织ARL6lP1蛋白表达
分别于照射后1,3,7和14 d取5只小鼠处死,从腹腔中取出整段小肠,去除内容物后用生理盐水冲洗,滤纸吸干水分后称量。从小鼠幽门开始截去5 cm,之后取空肠10 cm称重,剪碎后按1∶10(体积比)加入RIPA裂解液(含1%蛋白酶抑制剂),并用超声仪将组织震碎,离心后取上清液。加入等体积上样缓冲液,置沸水浴中变性10 min。用BCA蛋白质测定试剂盒测定蛋白质浓度,取适量变性蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。蛋白分离结束后,采用转膜仪转膜,将带有蛋白样品的聚偏氟乙烯(PVDF)膜浸入封闭液(5%脱脂奶粉)处理1~2 h。用封闭液洗膜后加入特异性一抗(1∶1000)4℃孵育24 h。再以封闭液洗膜后,加入辣根过氧化酶标记的二抗(1∶10000)于37℃反应1 h。以二氨联苯胺显影后凝胶成像系统拍照,以GAPDH作内参,分析蛋白条带的积分吸光度(integrated absorbance,IA)值。ARL6IP1蛋白相对表达水平以IAARL6IP1/IAGAPDH比值表示。
1.4 慢病毒转染细胞及Arl6ip1敲低作用的验证
将IEC-6细胞从液氮中取出后迅速置37℃水浴中解冻,并用移液器将细胞悬液转移入离心管中。离心洗净冻存液后,采用DMEM培养基(含10%胎牛血清)于37℃,5% CO2培养箱培养。将IEC-6细胞(1×105L-1)以每孔500 μL接种于24孔板中,待细胞密度达约70%,弃培养基,将siRNA-NC,Arl6ip1-siRNA-132,Arl6ip1-siRNA-249和 Arl6ip1-siRNA-565慢病毒30 μL 加入270 μL培养基中,充分混匀后加入相应孔中,每组6复孔。将24孔板置37℃,5% CO2细胞培养箱中转染24 h。弃含有siRNA慢病毒的培养基,加入500 μL培养基继续培养。慢病毒转染后72 h,弃培养基,加入胰酶消化细胞,用PBS溶液洗涤后重悬细胞,用流式细胞术检测细胞中绿色荧光蛋白(green fluorescent protein,GFP)的表达。GFP阳性细胞为成功转染病毒的细胞。转染效率(%)=GFP阳性细胞数/总细胞数×100%。
慢病毒转染后72 h,弃培养基,用生理盐水洗涤1次,每孔加入100 μL RIPA细胞裂解液,用细胞刮将贴壁细胞刮下,转移至离心管中,置于冰上裂解15 min。离心后取上清液,用BCA蛋白质测定试剂盒测定蛋白质浓度,用Western印迹法验证siRNA-NC和3条Arl6ip1-siRNA特异性敲低ARL6IP1效果。
1.5 细胞和照射
将IEC-6细胞随机分为4组:即细胞对照组、细胞照射组、siRNA-NC转染照射组和Arl6ip1-siRNA-565转染照射组,每组6复孔,每孔加IEC-6 500 μL(1×105L-1)。Arl6ip1-siRNA-565和siRNA-NC慢病毒转染IEC-6细胞后72 h,将细胞照射组、siRNA-NC转染照射组和Arl6ip1-siRNA-565转染照射组置60Co源照射台进行γ射线照射:靶距为4 m,剂量15 Gy,剂量率68.34 cGy·min-1。细胞对照组进行假照射(将细胞24孔板带至照射室,但未照射)。
1.6 CCK-8法检测细胞存活率
在照射后24和48 h,各组每孔加入10 μL CCK-8工作液,置细胞培养箱孵育2 h,用多功能酶标仪在450 nm波长处检测吸光度值(A450nm)。细胞存活率(%)=〔实验孔A450nm-空白孔A450nm〕/〔细胞对照孔A450nm-空白孔A450nm〕×100%。空白孔含培养基和CCK-8溶液,无细胞。
1.7 免疫荧光法检测细胞中 γH2AX表达水平
将IEC-6细胞(1×105L-1)500 μL接种于玻片上,同1.6照射后3 h,各组加入适量4%多聚甲醛进行细胞固定。室温孵育15 min后捞片,用PBS洗涤2次。将0.3% Triton X-100滴加玻片上,室温孵育10 min,PBS洗涤2次;以PBS稀释小鼠抗人γH2AX单抗(一抗,1∶200)滴加于玻片上,4℃孵育过夜,用PBS洗涤2次;滴加Alexa Fluor 647标记山羊抗小鼠IgG抗体(二抗,1∶2000),37℃避光孵育1 h,用封片剂(含DAPI)封片,并在荧光显微镜下观察。红色荧光表示γH2AX表达阳性,荧光强度表示γH2AX的表达水平。
1.8 统计学分析
2 结果
2.1 小鼠照射后一般状态和存活数
小鼠腹部照射后1 d,体重和状态较照射前无明显变化;照射后2 d,开始出现进食不佳,轻微腹泻,体重减轻;照射后3 d,小鼠出现精神萎靡、懒动、蜷缩成团,皮毛黯淡无光且脱毛,严重腹泻,甚至个别小鼠出现血便,体重减轻;照射后7 d,小鼠活动缓慢,持续腹泻,体重持续减轻;照射后14 d,小鼠状态恢复良好,皮毛光滑,体重逐步恢复。
照射组小鼠自照射后2 d开始出现死亡,死亡1只;照射后3~5 d为死亡高峰期,死亡7只;照射后14 d,共死亡8只,死亡率为20%。正常对照组无死亡。
2.2 小鼠照射后空肠组织ARL6lP1蛋白表达
与正常对照组相比,小鼠照射后1和3 d,照射组空肠组织中ARL6IP1蛋白表达显著降低(P<0.05,P<0.01);照射后7和14 d,照射组空肠组织中ARL6Ip1蛋白表达与正常对照组无显著差异(图1)。

Fig.1 Effect of radiation on expression of ARL6lP1 in jejunum of mice by Western blotting.The mice were exposed to 15 Gy of abdominal radiation.IA:integrated absorbance;B was the semi-quantitative result of A.±s,n=5.*P<0.05,**P<0.01,compared with normal control group.
2.3 Arl6ip1-siRNA转染效率及Arl6ip1-siRNA转染对lEC-6细胞ARL6lP1表达水平的影响
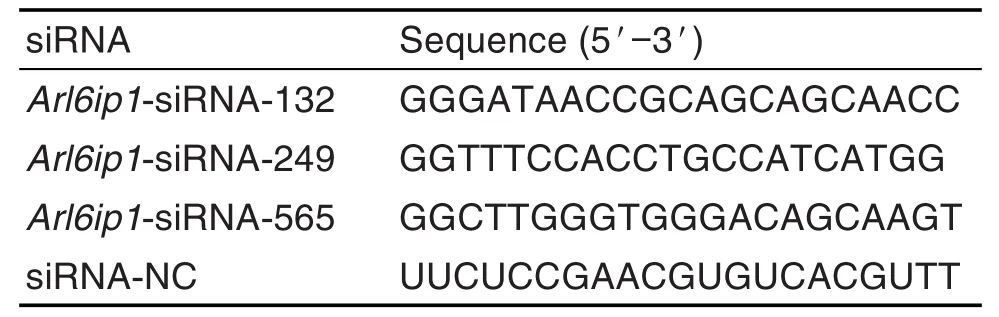
siRNA转染IEC-6细胞后72 h,用流式细胞仪分析siRNA-NC,Arl6ip1-siRNA-132,Arl6ip1-siRNA-249和Arl6ip1-siRNA-565的转染效率,分别为(89±4)%,(64±9)%,(45±7)%和(88±10)%(n=5)(图2)。转染Arl6ip1-siRNA-565后,IEC-6细胞中ARL6IP1蛋白表达水平较siRNA-NC组明显降低(P<0.05);而转染Arl6ip1-siRNA-132和Arl6ip1-siRNA-249后,IEC-6细胞中ARL6IP1蛋白表达水平与siRNA-NC组无显著差异(图3)。
2.4 敲低Arl6ip1对照射后lEC-6细胞存活率的影响
图4结果表明,照射后24 h,与细胞对照组相比,细胞照射组细胞存活率显著降低(P<0.01);与细胞照射组相比,siRNA-NC转染照射组细胞存活率无显著变化,Arl6ip1-siRNA-565转染照射组显著降低(P<0.05);与siRNA-NC转染照射组相比,Arl6ip1-siRNA-565转染照射组细胞存活率显著降低(P<0.01)。照射后48 h,各组细胞存活率变化与照射后24 h基本一致。
2.5 敲低Arl6ip1对照射后lEC-6细胞 γH2AX表达的影响
图5结果表明,用Arl6ip1-siRNA-565和siRNA-NC慢病毒转染IEC-6细胞后4 d,进行60Co源γ射线照射3 h。免疫荧光法检测结果表明,细胞对照组可见少量γH2AX阳性细胞,而细胞照射组和siRNA-NC转染照射组可见较多散在的γH2AX阳性细胞,Arl6ip1-siRNA-565转染照射组可见较为密集的γH2AX阳性细胞。经过图像分析,与细胞对照组相比,细胞照射组γH2AX荧光强度显著升高(P<0.05);与细胞照射组相比,siRNA-NC转染照射组γH2AX荧光强度无显著差异,而Arl6ip1-siRNA-565转染照射组γH2AX荧光强度显著升高(P<0.05)。与siRNA-NC转染照射组相比,Arl6ip1-siRNA-565转染照射组γH2AX荧光强度显著升高(P<0.05)。
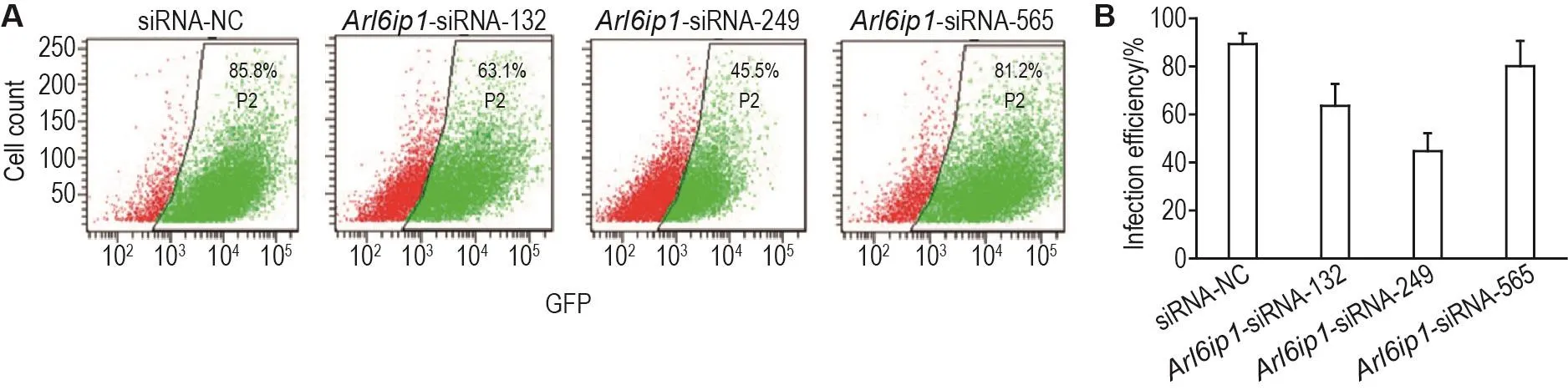
Fig.2 lnfection efficiency of different siRNA-LV5(EF-1aF/GFP&Puro)assayed by flow cytometry.IEC-6 cells were infected with siRNA-NC,Arl6ip1-siRNA-132,Arl6ip1-siRNA-249 or Arl6ip1-siRNA-565 lentivirus for 3 d.The infection efficiency was detected with flow cytometry by calculating the percentage of green fluorescent protein(GFP)positive cells.B was the quantitative result of A.±s,n=6.
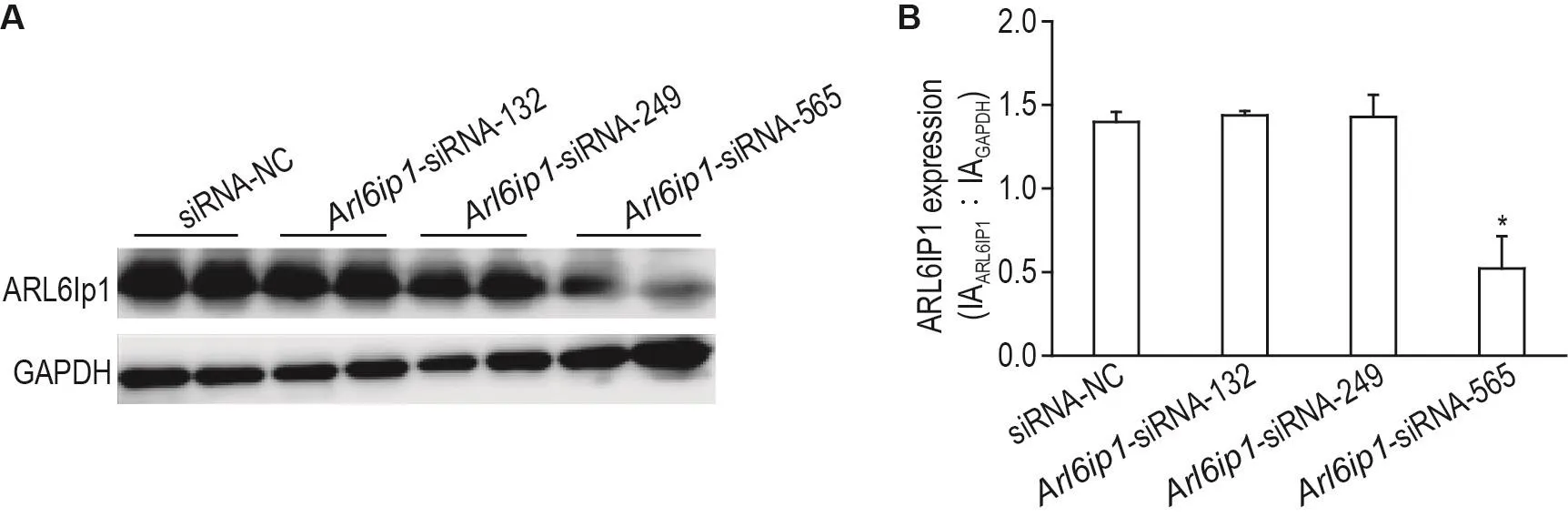
Fig.3 Protein expression of ARL6lP1 in Arl6ip1 knockout lEC-6 cells assayed by Western blotting.See Fig.2 for the cell transfection.B was the semi-quantitative result of A.±s,n=6.*P<0.05,compared with siRNA-NC group.

Fig.4 Effect of Arl6ip1 knockdown on survival rate of lEC-6 cells after radiation assayed by cell counting Kit 8.See Fig.2 for the cell transfection.IEC-6 cells were exposed to 15 Gy of radiation.Cell survival rate(%)=[A450 nmof the test well-A450 nmof the blank well]/[A450 nmof the cell control well-A450 nmof the blank well].±s,n=6. **P<0.01,compared with cell control group;#P<0.05,compared with cell radiation group;△△P<0.01,compared with siRNA-NC+ratiation group.
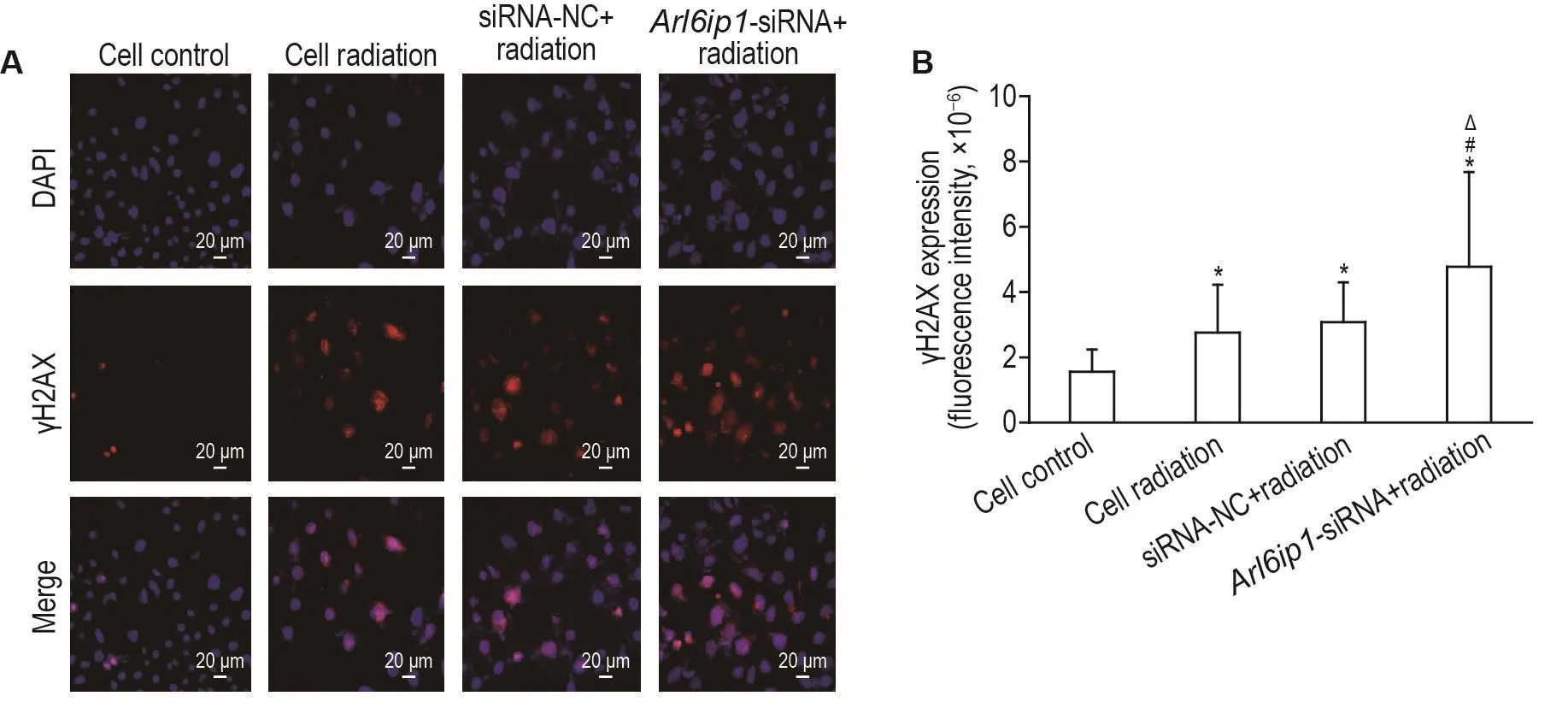
Fig.5 Effect of Arl6ip1 knockdown on expression of phosphorylated histone H2AX( γH2AX)in lEC-6 cells after radiation assayed by immunofluorescence.See Fig.2 for the cell transfection and Fig.4 for the cell radiation.DNA damage was measured by the fluorescence intensity of γH2AX-positive cells 3 h post radiation.B was the quantitative result of A.±s,n=6.*P<0.05,compared with cell control group;#P<0.05,compared with cell radiation group;△P<0.05,compared with siRNA-NC+radiation group.
3 讨论
RⅢ主要包括小肠上皮细胞损伤和炎症反应2个过程[3-4],其中小肠上皮细胞损伤和修复受多种因素影响,如肠道免疫应答[7]、P53通路调控[18]和局部循环系统改变[19]等。前期单细胞转录组测序结果发现,小肠上皮细胞损伤和修复在RⅢ中具有重要作用,其中Arl6ip1基因在小肠上皮细胞存在表达,且在照射后存活细胞中特异性高表达。本研究制备小鼠RⅢ模型,初步探索ARL6IP1蛋白在RⅢ前后表达水平的变化规律,并利用siRNA干扰技术成功构建Arl6ip1基因敲低的IEC-6细胞,通过观察Arl6ip1基因敲低对电离辐射致细胞DNA损伤和存活的影响,探索Arl6ip1基因在电离辐射致细胞损伤过程中的作用。
动物实验结果表明,在小鼠RⅢ模型中,照射后1和3 d,空肠组织中ARL6IP1蛋白表达显著下降。本课题组单细胞转录组测序结果显示,Arl6ip1基因在小肠上皮细胞中高表达,结合既往研究结果,照射后3 d小肠上皮细胞凋亡和坏死,存活细胞减少[3]。由此推测,可能是由于RⅢ导致小肠上皮存活细胞数量下降,导致小肠组织中ARL6IP1表达下调。在照射后7和14 d,损伤的肠道黏膜逐渐修复,肠上皮存活细胞数增多,从而使肠道ARL6IP1蛋白表达逐步回升。上述结果表明,在RⅢ早期,肠上皮存活细胞中ARL6IP1表达虽然上调,但小肠组织中ARL6IP1表达下调。
细胞实验结果表明,与细胞照射组和siRNA-NC转染照射组相比,Arl6ip1-siRNA-565转染照射组中γ-H2AX表达显著上升,细胞存活率显著下降,表明照射可引发IEC-6细胞DNA损伤,而敲低Arl6ip1可进一步促进照射对IEC-6细胞DNA损伤。此外,照射能抑制IEC-6细胞存活,Arl6ip1敲低能进一步促进照射对细胞存活的抑制作用。上述结果提示,Arl6ip1低表达可促进照射后细胞DNA损伤,抑制细胞存活,从而加重电离辐射所致小肠上皮细胞损伤,提示ARL6IP1在RⅢ中可发挥抗DNA损伤活性。
电离辐射可直接作用于机体内的生物大分子,引起大分子结构的改变,或通过引发机体内生物分子或水分子的电离或激发,产生大量的自由基,导致DNA等生物大分子的损伤,诱发细胞凋亡[20-23]。本研究结果表明,Arl6ip1下调可促进电离辐射引发的DNA损伤及细胞凋亡,提示通过调控Arl6ip1的表达,可减轻RⅢ早期肠道上皮细胞DNA损伤和细胞凋亡,从而减轻肠道损伤,促进RⅢ的恢复,该结果待后续采用动物实验进一步验证。本研究为RⅢ机制和防治靶点研究提供了新思路,对于探索Arl6ip1基因在RⅢ发生中的抗损伤机制研究具有重要意义。

