新型冠状病毒肺炎治疗药物研发进展
王晓旭,吴心怡,梁 浩,崔 诚,刘东阳
(北京大学第三医院药物临床试验机构,北京 100191)
新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是一种单链RNA病毒,主要通过棘突蛋白(spike protein,S蛋白)与宿主细胞上的血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)结合,与细胞膜融合和内化后进入细胞,然后进行脱壳、释放基因,经过一系列翻译、组装和复制过程在宿主体内不断增殖[1]。
疫情暴发之初,SARS-CoV-2侵入人体的机制尚未阐明,无法依据病毒感染机制进行抗SARSCoV-2药物研发。因此,基于细胞和动物模型对已上市的临床应用药物进行治疗新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)新适应证开发成为应急情况下抗SARS-CoV-2的主要策略。同时,针对SARS-CoV-2感染机制进行了一系列深入研究,并在此基础上有针对性地开发抗SARSCoV-2创新药物,以期发现特异性佳且安全有效的新分子实体。已上市药物治疗COVID-19新适应证开发和基于病毒感染机制的创新药物开发结果亦可相互印证、相互促进,最终实现有效治疗COVID-19的目的。在此过程中,国内外研究团队均积累了丰富的研发经验,体现了近年来科学技术的进步,但面对前所未有的疫情,药物研发也遇到了很多困难和挑战,目前仍无明确的特效创新药物完成研究并通过药政部门的审批。
本综述基于SARS-CoV-2感染机制的靶点研究进展,分别就已上市药物治疗COVID-19新适应证和创新药物开发现状进行梳理,对其经验和不足进行总结,并提出对未来研发方向和关键问题的思考,以期为我国应急情况下新药开发提供参考。
1 SARS-CoV-2感染机制及抗SARS-CoV-2潜在靶点研究
病毒入侵是感染的第一个环节。研究发现,SARS-CoV-2可借助其S蛋白与宿主细胞表面受体ACE2结合[2]。细胞膜表面的蛋白酶在组织蛋白酶(cathepsin)B和组织蛋白酶L参与下水解S蛋白[3-4],随后SARS-CoV-2与宿主细胞膜发生融合,经由受体介导的内吞作用进入细胞,并在核内体中发生脱壳释放病毒RNA,启动病毒复制过程。SARS-CoV-2的基因组可以编码复制酶、S蛋白、包膜蛋白、膜蛋白和核衣壳蛋白等。其中,复制酶由2个多聚蛋白组成,需要被病毒蛋白酶水解释放才能发挥功能。冠状病毒中有2类蛋白酶,一类为类木瓜蛋白酶(papain-like protease,PLpro),负责水解多聚蛋白N端的少数几个位点;另一类为主蛋白酶(main protease,Mpro),司职水解多聚蛋白C端的大部分位点。在蛋白酶的作用下,多聚蛋白被水解,释放出RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)等 15个非结构蛋白,组成病毒复制和转录复合体,司职病毒RNA的合成。随后,病毒RNA转录成mRNA并合成病毒蛋白。病毒蛋白进行组装后包裹病毒RNA,经溶酶体途径释放出细胞,继续感染宿主其他细胞[5]。部分SARS-CoV-2蛋白已成为抗SARS-CoV-2药物研发的重要靶标。
病毒感染会引发人体的免疫反应,因此从调节宿主免疫反应的角度,部分免疫相关蛋白也成为抗病毒药物研发的靶标。有研究表明,干扰素α和干扰素γ均在细胞水平表现出抗SARS-CoV-2的作用[6]。此外,核因子E2相关因子2〔nuclear factor(erythroid-derived 2)-like 2 protein,Nrf2〕激活剂富马酸二甲酯可通过激活Nrf2-Kelch样环氧氯丙烷相关蛋白(Kelch-like ECH-associated protein)通路发挥抗SARS-CoV-2作用,且其抗病毒效果并不依赖于干扰素α[7]。另外2个Nrf2激活剂甲巴多索隆(bardoxolone methyl)和巴多索隆(bardoxolone)也在Vero细胞模型上表现出抗SARS-CoV-2活性[8]。托珠单抗(tocilizumab)是一种重组人源化抗人白细胞介素6受体单克隆抗体,可抑制过度免疫反应,已被批准用于治疗嵌合抗原受体T细胞(chimeric antigen receptor T-cells,CAR-T)疗法引起的细胞因子释放综合征。SARS-CoV-2引起的细胞因子风暴释放综合征是重症COVID-19患者死亡的主要原因之一。因此,托珠单抗对过度免疫反应的抑制效果也可能有助于抗SARS-CoV-2治疗。临床研究表明,托珠单抗可有效改善重症COVID-19患者的预后并降低死亡率[9]。
2 已上市药物治疗COVlD-19新适应证的研究
SARS-CoV-2疫情暴发之初,我国迅速分离了SARS-CoV-2病毒,并建立了SARS-CoV-2感染的细胞模型,为快速进行治疗COVID-19药物开发奠定了良好基础。按照传统新药开发程序,新药首先需要经过严格的动物有效性、安全性评价,然后再在少量健康人、少量患者和足够样本量的患者体内逐步进行剂量探索及有效性和安全性评价,最终为合适的患者推荐具备科学给药方案的新药,这个过程一般会耗费5~10年时间。在应急情况下,COVID-19患者处于无药可救情形,此时根本无法允许按照传统程序开发救治药物。应急情况下药物开发经验丰富的美国曾针对炭疽孢子恐怖袭击下药物快速开发发布动物法则(Animal Rule),提出因伦理道德或不具有可行性等原因,无法获得临床数据的新药和新生物制品可以在符合药物非临床研究质量管理规范(Good Laboratory Practice,GLP)的实验室完成动物药效和安全性试验的基础上直接申请上市使用,以解决重大疫情或军事活动时药物因时间和不可操作性所限,不能快速发挥临床治疗作用的问题[10]。但需要证明验证新药的动物模型可靠,这在SARS-CoV-2疫情暴发初期很难达到,并且新药在动物体内的有效性和安全性评价需要很长时间,很难满足。在选择抗微生物药物剂量时,该指南也建议可采用体外数据对人体剂量进行外推,这种快速研究方法结合已上市药物已有的临床安全性数据的优势,可既能快速推荐有效剂量,又可快速证明该剂量下药物的安全性,从而快速进行验证性临床试验,以实现借助“老药新用”支持其治疗患者。
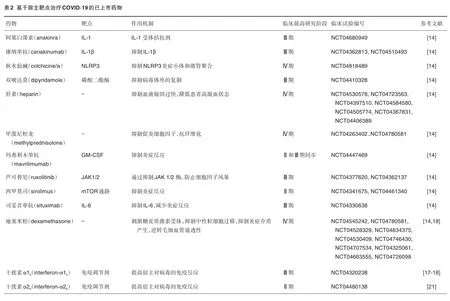
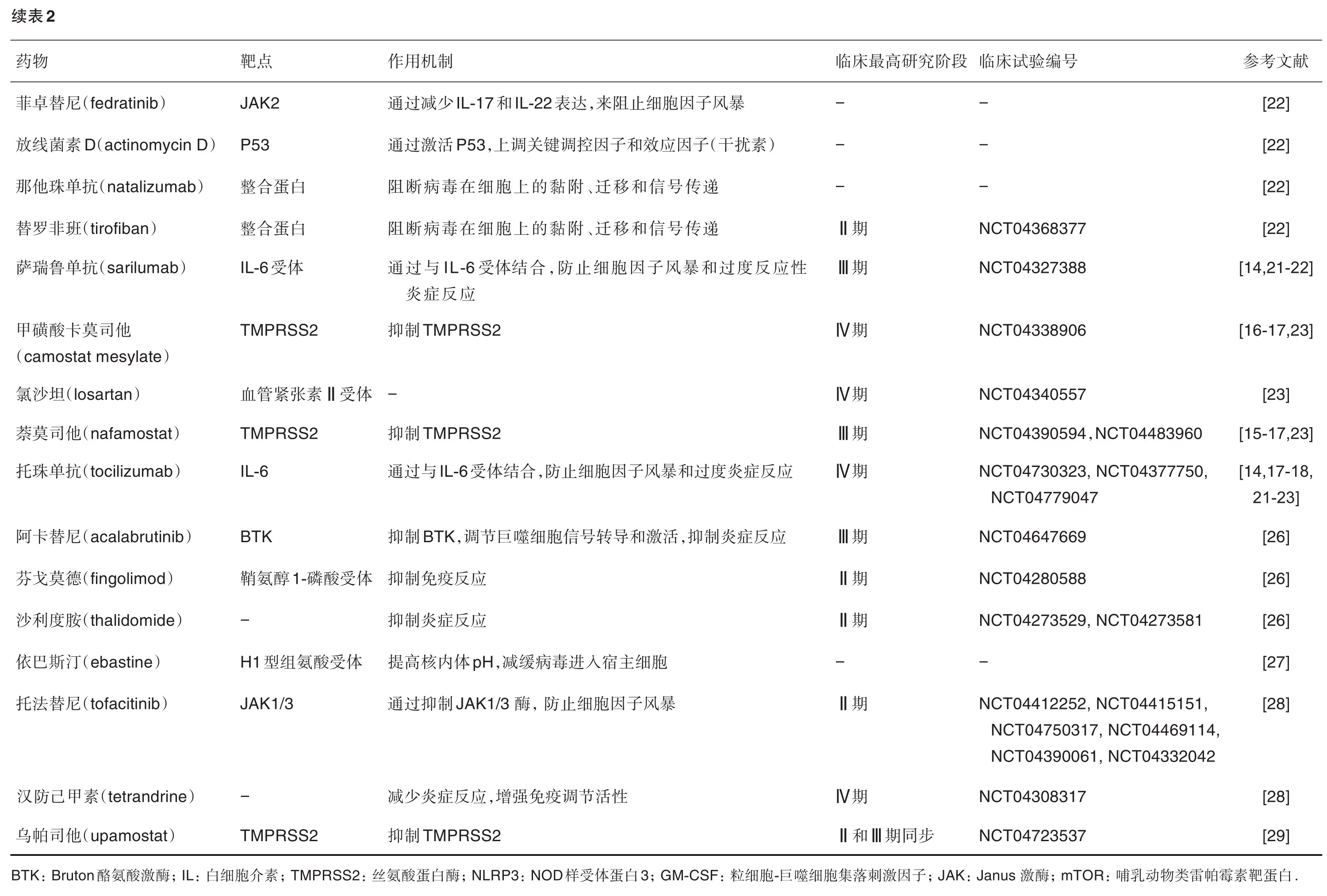
为此,SARS-CoV-2疫情暴发之初,我国科研工作者即借助细胞模型快速评估了利巴韦林(ribavirin)、喷昔洛韦(penciclovir)、硝唑尼特(nitazoxanide)、萘莫司他(nafamostat)和氯喹(chloroquine)及2种已知的广谱抗病毒药物——瑞德西韦(remdesivir,GS-5734)和法匹拉韦(favipiravir,T-705)对临床分离SARS-CoV-2株的抗病毒效果,采用标准测定方法检测上述化合物对SARS-CoV-2的细胞毒性、病毒产量和感染率的影响,并推荐氯喹和瑞德西韦等为潜在治疗药物,在此基础上快速进行了一系列相关临床试验,探索其治疗COVID-19的潜在能力,这些临床数据支持了我国早期临床COVID-19诊治指南的出台[11-13]。利巴韦林、喷昔洛韦、硝唑尼特、萘莫司他和氯喹5种药物后来在美国也得到了美国食品药品监督管理局快速批准。同时,鉴于SARS-CoV-2感染后,人体自身的抗SARS-CoV-2感染能力和抵抗SARS-CoV-2触发的炎症等能力发生变化,这对临床治疗也非常重要。我国科学家针对上述情况,对增强先天免疫系统和抑制炎症反应的托珠单抗等已上市药物快速展开临床研究。本文按照药物作用机制对目前正在开发的可用于治疗COVID-19新适应证的已上市药物和创新药物进行系统总结,按照作用于病毒感染、宿主免疫与治疗以及同时作用于病毒和宿主的机制将已上市药物分别列于表1、表2和表3。尽管部分药物在体外表现出抗SARS-CoV-2活性,但只有较少的双盲双对照临床研究在一定程度上证明了疗效,尚未发现特效药物。
这种加速临床开发的应急策略中,基于细胞数据和(或)动物数据预测临床有效剂量及特定情况下(如肝损伤、肾损伤或儿童患者)剂量调整方案至关重要,而本次应急开发中一个明显的特色就是模型引导的新药开发策略得到了充分应用[30]。本课题组与国家疾病预防控制中心联合科研攻关,依据细胞学抗病毒活性数据建立生理药动学模型,以当时最新报道的氯喹唯一临床试验有效性数据(n=22)为基础,通过总结羟氯喹临床使用的药物剂量-暴露量-安全性规律,对与氯喹等效的羟氯喹临床剂量进行预测,保障了氯喹和羟氯喹临床试验高效安全进行[11,31-32]。同时还用动物实验探索了羟氯喹在药效靶部位(肺组织)中的药动学特征,基于细胞学研究探索了羟氯喹的药动学特征和安全性特征,从而预测了氯喹和羟氯喹在不同特定人群的药动学特征,并使用临床数据验证和进一步分析,最终为快速推荐两者在特定人群中的合理使用方案奠定数据基础[33-37]。这种策略也被全球同行应用于上述药物其他情形和其他抗SARS-CoV-2药物开发中。但在应用中需要充分考虑体外模型质量及其与患者疾病机制的相似性、体外药物与体内活性物质的相似性、临床患者病情演变以及病毒临床特征高度变异对临床试验的苛刻要求[38-41]。
3 我国中药用于COVlD-19治疗的研究
中药以复方的形式给药,是一种多分子-多靶标的系统性治疗方法,可以在多个环节同时阻断病毒复制周期,还可以调节人体免疫反应。此外,由于中药有上千年的人体使用经验,其临床用量和安全性已得到充分探索,且无需化学合成,易于获取,是应急情况下治疗药物开发的另一个重要策略。鉴于中药的低毒性、可快速获得性及在控制临床患者症状中的有效作用,从中药中筛选针对病毒或宿主靶点的活性化合物也是治疗COVID-19的潜在策略之一。目前已有中药治疗COVID-19的研究汇总见表4。然而,传统中药复方设计多是基于对病证的观察而非基于明确靶标,因此很难清晰阐明其分子机制,从而降低了中药的国际认可度,影响了中药在世界范围内的应用。对此,一方面需要突破创新中药临床研究方法,另外也需要建立系统的中药数据库,以更高效高质地推动中药临床研究质量,让中药发挥更大作用。
4 治疗COVlD-19的创新药物研发和前景
治疗COVID-19新药的开发重点不仅包括直接作用于病毒的广谱小分子蛋白和抗体,也应考虑对已上市或正在开发的药物增加COVID-19适应证研究。另一类具有巨大抗病毒潜力的新疗法是基于RNA的疗法。新药开发不仅要专注于已知的风险,还必须致力于对易暴发的病毒家族进行先发制人的研究,最终提供一种缩短暴发和应对之间差距的战略。如有可能,还应着重于门诊使用的口服药物,并确定对抗病毒和免疫介导的病理的联合疗法,扩大治疗窗口的有效性和减少耐药性[46]。
根据药渡数据库显示,截止2021年6月30日,全球正在进行Ⅰ期临床研究的抗SARS-CoV-2新药研发,除疫苗外,主要集中在化学药(11项)和生物药(28项),另有3项正在进行细胞治疗研究(表5)。





在抗SARS-CoV-2创新药物研发中也有我国科学家的突出贡献。西湖大学团队首先解析出SARS-CoV-2受体ACE2的全长结构,然后针对该结构筛选和设计出特异性抑制剂,构建了多种ACE2三聚体蛋白,其中T-ACE2与SARS-CoV-2 S蛋白亲和力很高,亲和力常数KD<1 pmol·L-1,同时极大提高了对病毒的抑制活性,目前该药正在开发中[47]。同时,中国科学院上海药物研究所联合上海科技大学和中国科学院武汉病毒研究所的科学家通力合作,发现一类结构新颖、高效、安全的抗SARS-CoV-2候选药物。该研究是基于冠状病毒Mpro三维结构设计并合成的2个拟肽类化合物11a和11b。两者在体外展示出对SARS-CoV-2 Mpro极佳的抑制活性,具有较好的抗病毒效果,更为重要的是两者均展示出良好的体内药动学性质和安全性[48]。
另一种新药快速研究方法可用于分离治疗或预防SARS-CoV-2感染的中和单克隆抗体[49-50]。北京基因组学高级创新中心利用人体免疫系统产生的中和抗体来阻止SARS-CoV-2感染细胞,从60例康复患者的血液中分离出抗体后,将中和抗体注射到感染SARS-CoV-2的小鼠体内,5 d后病毒载量减少2500倍,表明该类中和抗体可加快COVID-19治愈,甚至可提供短期的SARS-CoV-2免疫[51]。
5 应急情况下治疗COVlD-19创新药物开发的突破与挑战
与17年前的SARS时期相比,目前我国的基础科研能力与新药非临床开发能力得到显著提升。SARS-CoV-2疫情暴发之初,我国科学家迅速反应,于2020年2月4日即发表了SARS-CoV-2感染细胞模型并筛选出治疗COVID-19的潜在药物,2月18日发表了建立的SARS-CoV-2感染大鼠模型,3月9日即发表了新建立的SARS-CoV-2感染恒河猴模型,为治疗COVID-19新药非临床评价和疫苗疗效评价迅速奠定了科学基础,使已上市药物治疗COVID-19新适应证开发和创新药物非临床研究得以快速展开[13,52]。SARS-CoV-2 细胞受体空间结构的成功解析和虚拟受体的建立,实现了利用已有药物库对治疗COVID-19潜在药物的快速筛选,并为新药设计与开发系列研究提供了有力支持[47,53]。定量药理学是近年来新兴的交叉学科,建模与仿真技术的应用为验证性临床试验推荐给药方案,并密切分析疾病病理特征,基于科学为临床推荐药物开发策略[11,39],为患者推荐积极的治疗方案[12,32,54-55]。与此同时,药政管理部门也积极依据情况发布疫情期间新药开发相关指南[56],共同为后续一系列药物研发提供了坚实的研究基础。
虽然我国疫情控制取得了巨大成功,上述研究成果显著,最大程度上保证了人民健康,但应急情况下新药临床开发还有待改进。①我国生物安全防护三级或四级实验室数量较少,虽然可以支持率先做出突破性研究,但病情分析、新药与疫苗筛选与药效与安全性临床前评价,剂量推荐等研究需求很大,曾一定程度上影响了新药开发;②病毒感染机制及机体反应机制应从一开始就需有计划地开展系列研究,虽然不能为当时疫情控制建言献策,但会有效指导变异病毒的控制以及后续其他病毒防治策略的制定,尤其是考虑到目前疫情全球化导致的疫情长期化的潜在可能,更需要坚定不移地进行基础研究;③治疗COVID-19药物早期临床开发对推荐合适剂量至关重要,但我国本次新药临床评价过程中重视程度仍有待提升,需通过体外实验支持临床剂量选择避免临床试验的剂量处于“盲试”状态。导致上述情况的主要原因包括非临床细胞和动物模型资源较少、疫情形势紧急以及我国目前缺少专业的定量药理学研究平台和专业人才培养体系等;④治疗COVID-19药物临床试验信息化与样本检测能力亟待提升,该现状一定程度上限制了我国临床试验质量和效率,这在疫情期间病房人员严格管控情况下尤为突出。随着对上述问题认识越来越深刻,希望我国能够借此提高应急情况下新药开发能力,更好地保障人民健康。

