水通道4基因敲除对吗啡诱导小鼠条件性位置偏爱及神经发生的影响
王志媛,吴 宁,李 锦
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850)
水通道(aquaporin,AQP)是水转运的特异性孔道蛋白,广泛分布于众多组织中,为水分子快速透过细胞膜的运输提供主要途径[1]。在哺乳动物体内共发现了13种AQP蛋白亚型(AQP0~AQP12),其中AQP4是中枢神经系统中表达最丰富的AQP亚型,在星形胶质细胞足突中呈极化分布。直接与血管和神经突触发生接触[2]。AQP4一直被认为是脑内水和离子稳态的关键调节分子。近期的研究还表明,AQP4参与了包括脑缺血、脑水肿和情感障碍性精神疾病等多种中枢神经系统疾病的发生发展过程[3-5]。
阿片成瘾是一种慢性复发性精神疾病[6]。阿片类物质强大的奖赏效应是成瘾启动的前提,长期暴露于阿片类物质诱导的皮质、海马和伏隔核等多个脑区神经可塑性的改变是成瘾形成的关键。阿片成瘾本质上是由不良适应介导的异常的学习记忆,海马是参与学习记忆的重要部位,因此海马神经可塑性在阿片成瘾中的作用越来越受到关注[7-8]。神经发生是神经可塑性的重要组成部分,由一系列生物学事件构成,包括神经前体细胞的增殖、迁移和分化产生成熟的神经元,以及新生神经元与周围神经回路的整合[9-11]。成年哺乳动物海马齿状回颗粒细胞层下区(subgranular zone,SGZ)是神经元发生的重要区域之一,新生成熟的神经元在颗粒细胞层产生树突和轴突,整合到现有的神经回路中,参与海马的各种功能活动。吗啡(morphine,Mor)和可卡因等慢性给药可抑制海马神经发生[12-13],且主要影响SGZ神经前体细胞的增殖。此外,有文献报道,AQP4缺失可抵抗可卡因对海马神经发生的抑制作用[13],但其对成瘾记忆影响的研究未见报道。
条件性位置偏爱(conditioned place preference,CPP)模型是研究药物的奖赏效应和成瘾相关记忆的经典模型。本研究采用CPP模型研究AQP4基因敲除对Mor诱导的小鼠CPP效应形成以及海马神经前体细胞增殖、存活和分化的影响,探讨APQ4在阿片成瘾相关记忆中的作用。
1 材料与方法
1.1 动物
野生型(wild type,WT)及AQP4基因敲除型(knock out,KO)CD1小鼠,雄性,3月龄,体重25~30 g,南京医科大学神经药理研究室提供,由军事科学院军事医学研究院实验动物中心饲养繁殖,合格证号 SCXK-(军)2007-004,饲养环境温度 20~22℃,湿度40%~60%,12/12 h明暗循环,小鼠每笼5~6只,自由摄食饮水。所有实验遵循军事科学院军事医学研究院实验动物伦理委员会的规定。
1.2 药品、试剂和主要仪器
Mor(批号:910907),青海制药厂;5′-溴脱氧尿嘧啶(5-bromodeoxyuridine,BrdU),德国Calbiochem公司;小鼠抗BrdU多克隆抗体(批号:MAB3510)和小鼠抗神经元特异性核抗原(neuronspecific nuclear,NeuN)单克隆抗体(批号:MAB-377),美国Chemicon公司;大鼠抗BrdU多克隆抗体(一抗)(批号:MCA2060),英国Serotec公司;辣根过氧化物酶标记山羊抗小鼠IgG抗体(二抗)、FITC标记山羊抗大鼠IgG抗体(二抗)、TRITC标记山羊抗小鼠IgG抗体(二抗)、浓缩型3,3-二氨基联苯胺(diaminobenzidine,DAB)免疫组化染色试剂盒(批号:ZLI-9031)、Triton-100、防脱磨砂载玻片和盖玻片,均购自北京中杉金桥公司。恒温冰冻切片机,德国莱卡公司;光学显微镜,日本Olympus公司;激光共聚焦显微镜,德国Carl Zeiss公司。
1.3 小鼠CPP行为实验系统
小鼠3箱式CPP系统及视频分析软件,宁波安莱公司。左右2箱的墙壁分别为黑色和白色,内径均为25 cm×25 cm×30 cm,2箱底部分别安置横栏和网格的铁丝网各1块。中间箱位于黑、白箱之间,灰色墙壁光滑底面,大小为10 cm×25 cm×30 cm。中间箱与黑、白2箱之间各有穿梭门1个,3箱的顶部都有1个LED灯和1个摄像头。所有数据均通过计算机视频跟踪系统进行记录。
1.4 小鼠CPP实验[14]
47只小鼠随机分为WT对照组(WT-control,WT-Con,n=12)、WT-Mor组(n=11)、AQP4基因KO-Con组(n=12)和 AQP4基因 KO-Mor组(n=12)。各组小鼠在实验环境中饲养2 d后进行CPP实验,实验分为预适应期、条件性训练期和表达测试期3个阶段(图1)。
预适应期(D1~D3):移开CPP装置各室之间的隔板,使小鼠能在各室之间自由活动,每天适应1次(15 min),D3适应的同时记录小鼠在各箱停留时间,判断小鼠的天然偏爱性。根据前期实验结果,小鼠对黑箱表现出天然偏爱性,因此所有小鼠均在非偏爱侧(白箱)伴药。
条件性训练期(D4~D11):训练时插上隔板,使小鼠限制在黑箱或白箱中45 min。每只小鼠每天上、下午各接受1次训练,2次训练间隔至少6 h。D4,上午各组小鼠均sc给予生理盐水10 mL·kg-1,下午WT-Mor组和KO-Mor组sc给予Mor 10 mg·kg-1、WT-Con组和KO-Con组sc给予生理盐水;D5,上午WT-Mor组和KO-Mor组sc给予Mor 10 mg·kg-1、WT-Con组和KO-Con组sc给予生理盐水,下午各组均sc给予生理盐水;每次给药后,将小鼠放入非伴药侧(即黑箱)训练,以此类推,连续训练8 d。

Fig.1 Schematic representation of experimental procedures.Mice were devided into wild type-control(WT-Con),WT-morphine(WT-Mor),knockout(KO)-Con and KO-Mor groups.During the conditioning phase of conditioned place preference(CPP),mice were administered with Mor(10 mg·kg-1,sc)or saline once a day on D4-D11.For analysis of cell proliferation,mice were injected with bromodeoxyuridine(BrdU)(50 mg·kg-1,ip,once every 2 h for four times)on D13.Mice were sacrificed 24 h after last BrdU administration to detect proliferation.Mice were sacrificed on D41 to determine the survival and differentiation of newborn cells.
表达测试期(D12):将隔板打开,使动物可在3箱内自由穿梭,记录15 min内动物在伴药(白箱)侧停留的时间。
1.5 BrdU免疫组化染色检测SGZ神经前体细胞增殖
CPP表达测试后第2天(D13),各组小鼠ip给予BrdU 50 mg·kg-1(每2 h注射1次,共4次)标记神经前体细胞。每组随机取6只小鼠,在末次给予BrdU 24 h后处死,取脑组织在4%多聚甲醛中后固定24 h,在含30%蔗糖的0.1 mol·L-1PBS中脱水4 d,连续冰冻切片(厚度30 μm)。从海马喙侧向尾侧收集SGZ区(约大脑前囟后1.06 mm至前囟后3.08 mm)脑片,从每6张脑片中取1张,按照文献[13]方法进行BrdU免疫组化染色。每张切片滴加3%过氧化氢处理30 min,以消除内源性过氧化物酶,而后滴加含5%牛血清白蛋白和0.3% TritonX-100的0.1 mol·L-1PBS室温封闭1 h,将切片在小鼠抗BrdU一抗(1∶10 000)中4℃孵育过夜,0.01 mol·L-1PBS漂洗3次后,加辣根过氧化物酶标记的山羊抗小鼠IgG抗体(二抗)(1∶800),DAB显色,脱水封片。在光学显微镜下计数SGZ区BrdU阳性(BrdU+)细胞数以反映神经前体细胞增殖。光学显微镜和激光共聚焦显微镜下(×40物镜)对所有的位于海马齿状回颗粒细胞下区的BrdU+细胞进行计数,颗粒细胞层外2个细胞距离以外以及焦平面以外的BrdU+细胞不计在内。SGZ的全部BrdU+细胞数通过计数12张脑片数值相加后乘以6而得到。
1.6 BrdU/NeuN免疫荧光双染检测神经前体细胞的存活和分化[5]
每组5~6只小鼠在BrdU标记28 d后(D41)处死,脑组织处理及冰冻切片方法同1.5。用含5%牛血清白蛋白和0.3% TritonX-100的0.1 mol·L-1PBS室温封闭1 h后,同时加入大鼠抗BrdU一抗(1∶100)和小鼠抗NeuN一抗(1∶100),4℃孵育过夜。0.01 mol·L-1PBS漂洗3次后,加入荧光标记的二抗,分别为山羊抗大鼠IgG抗体-FITC(绿色荧光,1∶1000)和山羊抗小鼠IgG抗体-TRITC(红色荧光,1∶1000)。在激光共聚焦显微镜下观察计数BrdU+,NeuN+和 BrdU+NeuN+细胞数,小鼠海马SGZ内少数NeuN+细胞同时呈现BrdU+,表明是由存活下来的神经前体细胞分化而来的神经元。BrdU+细胞存活率(%)=存活的BrdU+细胞数/各组增殖的BrdU+细胞平均数×100%;神经元分化率(%)=BrdU+NeuN+细胞数/存活的BrdU+细胞数×100%。
1.7 统计学分析
2 结果
2.1 AQP4基因敲除对Mor诱导的小鼠CPP效应形成的影响
Mor诱导CPP实验结果(图2)显示,WT-Con组与KO-Con组小鼠伴药箱停留时间无显著差异;WT-Mor组和KO-Mor组的伴药箱停留时间分别显著高于WT-Con 组和KO-Con组(P<0.01,P<0.05),但KO-Mor组伴药箱停留时间显著低于WT-Mor组(P<0.05),提示AQP4基因敲除降低Mor诱发CPP效应的形成。
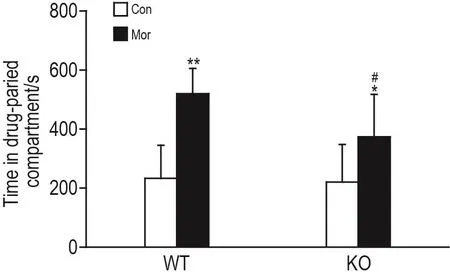
Fig.2 Effect of AQP4 knockout on acquisition of Morinduced CPP.See Fig.1 for the mouse treatment.±s,n=11-12.*P<0.05,**P<0.01,compared with Con group of the same genotype;#P<0.05,compared with WT-Mor group.
2.2 AQP4基因敲除对Mor慢性处理后小鼠海马SGZ神经前体细胞增殖的影响
WT和KO小鼠海马SGZ分布着一定数量BrdU+的神经前体细胞,呈单个或簇状分布,大多为不规则状(图3A)。BrdU+细胞计数(图3B)结果显示,WT-Mor组BrdU+细胞数显著减少至WT-Con组的(71.7±12.4)%(P<0.05),而WT-Con组与KO-Con组、KO-Mor组与WT-Mor组和KO-Mor组与KO-Con组间BrdU+细胞数均无显著差异。
2.3 AQP4基因敲除对Mor慢性处理后小鼠海马SGZ神经前体细胞存活和分化的影响
BrdU标记28 d后,小鼠海马SGZ内少数NeuN+细胞也呈现BrdU+,表明是由存活下来的神经前体细胞分化而来的神经元(图4A)。BrdU+细胞计数(图4B)结果显示,WT-Mor组BrdU+细胞数显著低于WT-Con 组(P<0.05),提示Mor连续处理8 d显著降低小鼠SGZ神经前体细胞的存活数量;KO-Con组与WT-Con组和KO-Mor组与KO-Con组间BrdU+细胞数无显著差异,提示AQP4基因敲除对基础状态下,神经前体细胞的存活数量无显著影响,且能消除Mor对神经前体细胞存活的抑制作用。BrdU+细胞存活率(即BrdU标记28 d细胞数与BrdU标记24 h细胞数的比率),WT-Mor组与WT-Con组相比和KO-Mor组与KO-Con组相比无显著差异,且KO-Mor组的BrdU+细胞存活率〔(60.2±10.1)%〕与WT-Mor组〔(35.3±9.3)%〕相比显著升高(P<0.05)(图4C)。提示AQP4基因敲除具有提高Mor处理8 d后小鼠海马SGZ神经前体细胞存活的作用。

Fig.3 Effect of AQP4 knockout on proliferation of neural progenitor cells in subgranular zone(SGZ)after chronic Mor treatment.See Fig.1 for the mouse treatment.A:neural pregenitor cell proliferation in SGZ by immunohistochemical staining.The arrows show BrdU immunostaining positive(BrdU+)cells.±s,n=6.*P<0.05,compared with WT-Con group.
新生神经元数量(即BrdU+NeuN+细胞数),WT-Mor组显著低于WT-Con组(P<0.05),提示Mor连续处理8 d显著降低新生神经元的数量KO-Con组与WT-Con组间和KO-Mor组与KO-Con组间均无显著差异,但KO-Mor组显著高于WT-Mor组(P<0.05)(图4D),提示AQP4基因敲除对基础状态下新生神经元的数量无显著影响,但能够消除Mor抑制新生神经元数量的作用。另外,各组神经元分化率无显著性差异(图4E),提示Mor连续处理8 d或AQP4基因敲除均不影响神经前体细胞向神经元的分化。
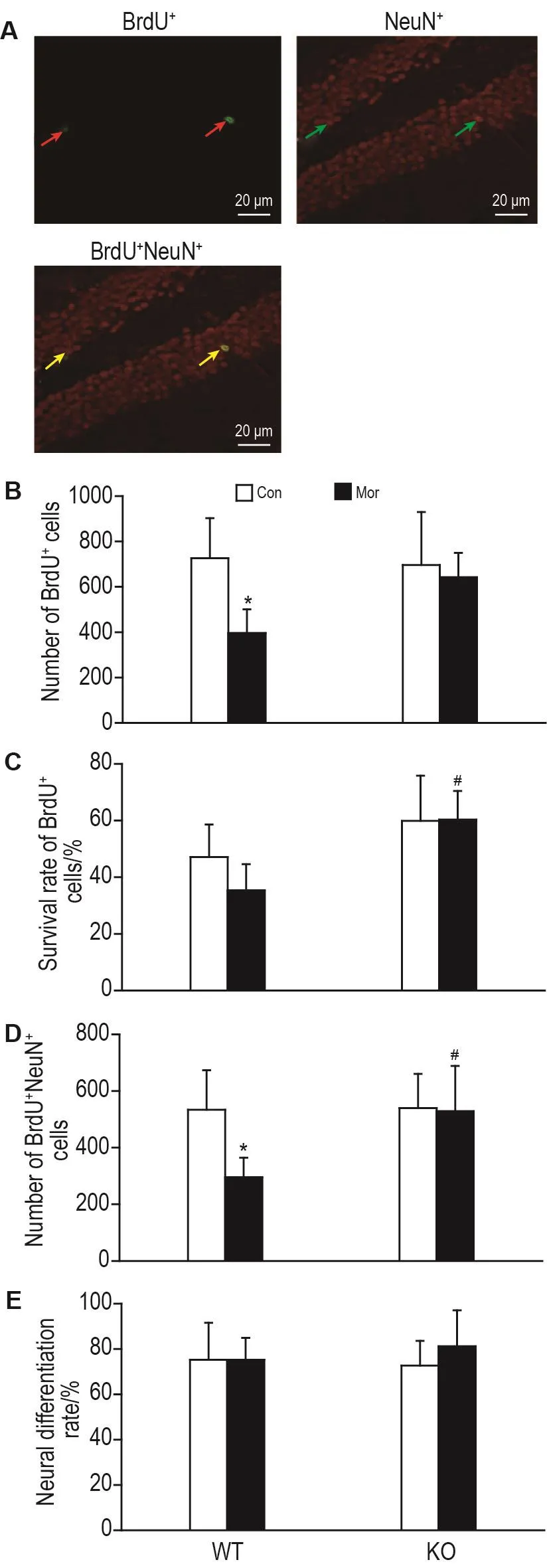
Fig.4 Effect of AQP4 knockout on survival and differentiation of neural pregenitor cells in SGZ after chronic Mor treatment.See Fig.1 for the mouse treatment.A:the survival and differentiation of BrdU+cells by immunofluorescent staining.The red,green and yellow arrows indicate the neuron-specific nuclear(NeuN)immunostaining positive(NeuN+),BrdU+and BrdU+NeuN+cells,respectively.Survival rate of BrdU+cells(%)=the number of surviving BrdU+cells/average number of proliferated BrdU+cells×100%.Neural differentiation rate(%)=the number of BrdU+NeuN+cells/the number of surviving BrdU+cells×100%.±s,n=5-6.*P<0.05,compared with Con group of the same genotype;#P<0.05,compared with WT-Mor group.
3 讨论
神经发生对于正常脑功能具有重要意义,目前对成年海马齿状回SGZ神经发生的生理学功能研究显示,增强SGZ的神经发生能促进依赖于海马的学习记忆过程[15-16]。阿片成瘾是一种病理性的学习记忆,已有文献报道Mor和可卡因慢性处理能抑制SGZ神经前体细胞的增殖[17-18],而AQP4敲除后能抵抗可卡因对神经前体细胞增殖的抑制[18],这与本文的研究结果一致。而新生的神经前体细胞必须存活下来并迁移到适当的脑区,分化成为神经元与周围神经回路产生突触联系,才具有功能。因此,本研究观察了AQP4在神经前体细胞增殖中的作用,重点关注了AQP4对新生的神经前体细胞存活和分化的影响,并应用CPP模型考察AQP4通过调节神经发生参与阿片成瘾的病理性学习记忆过程的可能性。
CPP模型是研究与奖赏相关的学习和记忆的经典范式,通过一段时间的情境因素与药物奖赏效应的关联性训练,动物产生对这种情境因素的记忆,被称为经典的巴甫洛夫联合学习[19]。Mor和可卡因等成瘾性物质诱发的强大而持久的奖赏效应及奖赏相关记忆是形成及维持成瘾状态、以及戒断后复吸的重要原因,两者缺一不可,共同促成CPP效应的形成。包括本课题组在内的以往研究发现,AQP4基因敲除能增强Mor镇痛、降低Mor的镇痛耐受和躯体依赖[20]以及可卡因诱导的高活动性及多巴胺释放[18]。本课题组最近的研究显示,在小鼠高活动性实验和静脉自身给药实验中,AQP4基因敲除减弱阿片类物质(Mor和海洛因)引起的精神兴奋效应和强化效应(待发表);但对奖赏相关记忆有何影响尚不清楚。本研究发现,AQP4基因敲除能降低Mor诱导的小鼠CPP效应的形成与表达,提示AQP4除直接参与阿片类的奖赏及强化效应外,还有可能参与奖赏相关记忆的形成,有助于从多角度理解AQP4在药物成瘾中的作用。成瘾性物质CPP效应的形成依赖于海马介导的情境关联性学习,有研究发现AQP4基因敲除降低了小鼠水迷宫任务中空间参考记忆的形成与巩固[21],提示海马依赖的学习能力降低。
动物及临床相关实验都证明了海马齿状回在情境线索依赖的奖赏记忆中起重要作用[22-23]。齿状回SGZ区是成年脑神经发生的重要区域,其中成年后产生的颗粒细胞神经元涉及海马依赖性功能的许多方面,包括与情境相关的学习和记忆,如对相似情境线索的辨别、记忆的巩固以及消退学习等[24-26]。研究显示,在基于奖赏的情境线索学习相关范式(如CPP)中,在成瘾记忆消退学习期间,消融成年海马神经发生能增强药物奖赏记忆的长期保留能力[27-29]。本研究在Mor诱导的CPP表达测试24 h后给予BrdU标记,标记24 h的BrdU+细胞是新发生的神经前体细胞,BrdU标记4周后的BrdU+细胞为存活下来的细胞,BrdU+/NeuN+细胞为由存活下来的神经前体细胞分化的功能性神经元。结果发现,AQP4基因敲除能抵抗Mor慢性处理引起的新生神经前体细胞存活和分化的功能性神经元数量的降低,提示AQP4可能通过参与神经发生影响成瘾性药物奖赏相关记忆的消退学习,进而对长期觅药行为产生影响。结合本研究结果及文献报道,我们推测AQP4基因敲除减弱Mor诱导的小鼠CPP效应的形成,可能与AQP4参与多巴胺释放进而减弱奖赏效应有关;而AQP4基因敲除对神经发生的影响可能参与CPP长期效应,如消退学习以及成瘾记忆的长期保留等。脑内学习记忆的编码和储存,需要突触在数量、结构、功能上发挥有序的变化,这些变化统称为神经可塑性[30]。在本研究中,我们应用免疫荧光染色重点观察了新生的神经前体细胞分化为神经元的数量,对于神经元的发育指标(树突棘的长度、分支及其复杂度)的研究能更详细地反映分化后的神经元功能及突触可塑性的变化,将是后续研究的重点。
综上所述,本研究发现,AQP4基因敲除降低Mor诱导的小鼠CPP效应的形成,同时抵抗Mor慢性处理对海马神经发生的抑制,主要是通过减轻Mor对神经前体细胞增殖、存活和分化的抑制而实现的。AQP4对神经发生能力的调节可能是其影响阿片奖赏相关记忆及成瘾的机制之一,但详细机制尚需进一步研究。

