姜黄素通过调控脂多糖诱导的炎症抑制软骨细胞凋亡
李亚楠,倪 娟,方禹舜,谈鸿飞,周观金,张青松*
(1.武汉市第四医院,华中科技大学同济医学院附属普爱医院运动医学科,湖北 武汉430030; 2.武汉市第四医院,华中科技大学同济医学院附属普爱医院血液风湿科,湖北 武汉 430030)
骨关节炎(Osteoarthritis,OA)是一种多因素导致的退化性肌肉骨骼疾病,软骨细胞炎症反应可能介导其发展[1⁃2]。OA 的主要病理特征为软骨细胞减少,细胞外基质代谢紊乱,滑膜炎症反应以及软骨和软骨下骨深层形态的改变[3]。据估计,全世界10%~20%人口受到OA 的影响,其发病率可能随着寿命延长而增长[4]。OA 的病因尚未确定,软骨细胞的异常凋亡可导致软骨损伤从而引起OA[5]。目前,OA 的治疗大多只针对临床症状而非病因,仅仅缓解了疼痛,不能防治软骨损伤和其他关节组织的破坏[4]。
姜黄素是一种从姜黄根茎中提取的多酚物质,具有抗炎、抗氧化等药理作用[6⁃7]。前期研究发现,姜黄素可缓解脂多糖诱导的软骨细胞炎症反应,并抑制软骨细胞凋亡[8],但其抑制细胞凋亡的相关机制并未进行深入探讨。本研究将从线粒体功能损伤介导细胞凋亡的角度,进一步探讨姜黄素抑制软骨细胞凋亡的可能机制。
1 材料
1.1 动物 4 周龄清洁级SD 雌性大鼠5 只,体质量(150±20)g,购自三峡大学实验动物中心[实验动物生产许可证号SCXK(鄂)2017⁃0012],适应性喂养1 周后进行实验(实验动物合格证号42010200002112)。
1.2 药物与试剂 姜黄素(美国Sigma⁃Aldrich 公司,批号C1386⁃5G);脂多糖(LPS,美国Sigma⁃Aldrich 公司,批号L2630⁃10MG);DMEM 培养基(美国Hyclone 公司,批号SH30022.01B);胎牛血清、II 型胶原酶(美国Gibco 公司,批号10270⁃106、17101015);青⁃链霉素⁃两性霉素B 溶液(三抗)、甲苯胺蓝染色液、Hochest 33258 染色液、活性氧(Reactive oxygen species,ROS)检测试剂盒、RIPA裂解液、兔抗B 淋巴细胞瘤⁃2(B⁃cell lymphoma⁃2,Bcl⁃2)抗体、兔抗Bcl⁃2 相关X 蛋白(Bcl⁃2 associated X protein,Bax)抗体、兔抗细胞色素c(Cytochrome c,Cyt⁃c)抗体、兔抗半胱氨酸天冬氨酸蛋白水解酶⁃3(cysteinyl aspartate specific proteinase⁃3,caspase⁃3)抗体、兔抗caspase⁃9 抗体(武汉贝茵莱生物科技有限公司,批号 PAB180056、PAB180070、PAB180033、PAB180052、PAB180006、PAB30599、PAB30727、PAB30055、PAB30074、PAB30094);ATP 测试盒(南京建成生物工程研究所,批号A095);PVDF 膜、化学发光试剂(美国Millipore 公司,批号IPVH00010、WBKLS0010)。
1.3 仪器 DMIL LED 倒置荧光显微镜(德国Leica 公司);CytoFLEXS 流式细胞仪(美国Beckman 公司);MK3酶标仪(芬兰雷勃公司);mini protean 3 cell 电泳仪(美国Bio⁃Rad 公司);Tanon⁃5200 全自动化学发光分析仪(上海天能科技有限公司)。
2 方法
2.1 大鼠软骨原代细胞的分离 将大鼠颈椎脱臼致死,于无菌条件下取其膝关节处软骨,使用PBS 清洗3 次。将软骨剪成大小为1 mm3碎块,加入0.2% II 型胶原酶,置于振荡器上振荡1 h。加入0.25% 胰蛋白酶消化30 min 后,终止消化。收集上清液,200 目筛网过滤,收集滤液,1 500 r/min 离心10 min,弃上清,使用含10% 胎牛血清,100 U/mL 青霉素和100 mg/L 链霉素的DMEM 培养基重悬细胞,离心后收集细胞,再重悬于DMEM 培养基中进行培养。每隔2 d 更换1 次培养基,每日在倒置显微镜下观察细胞状态,待细胞铺满瓶底80% 左右时,离心收集细胞,使用新鲜培养基重悬细胞进行传代培养。
2.2 甲苯胺蓝染色鉴定软骨细胞 将软骨细胞培养于放有载玻片的培养基中,培养48 h 后使用4% 甲醛进行固定。加入甲苯胺蓝染液,完全覆盖细胞染色5 min,PBS 冲洗,将细胞置于显微镜下观察并拍照。
2.3 细胞模型制备与分组处理 参考文献[8]。取生长状况良好的大鼠软骨细胞,加入0.25%胰蛋白酶消化制备成单细胞悬液,以1.0×105/mL 将细胞接种于24 孔板内,每孔加入2 mL 含10%胎牛血清的DMEM 培养基。将细胞分为对照组、模型组及姜黄素低、中、高剂量组,除对照组外,其他4 组细胞均采用含有5 μg/L LPS 培养基刺激1 h 构建软骨细胞炎症模型。姜黄素低、中、高剂量组的培养基中分别加入5、10、20 μmol/L 姜黄素干预24 h 后,进行各项指标检测。
2.4 Hoechst 33258 染色观察细胞形态及凋亡情况 收集上述分组处理后的细胞,4%多聚甲醛固定10 min,PBS 清洗2 次,Hoechst 33258 染色液覆盖细胞,室温染色5 min,PBS 清洗5 次,于荧光显微镜下观察细胞形态及凋亡水平。
2.5 流式检测细胞线粒体膜电位 收集1.0×105~5.0×105个细胞重悬于0.5 mL 细胞培养液中,加入0.5 mL JC⁃1 染色工作液,混匀,室温孵育30 min。4 ℃、1 500 r/min 离心3 min,收集细胞沉淀。JC⁃1 染色缓冲液(1×)洗涤2次,将细胞重悬于JC⁃1 染色缓冲液(1×)中,4 ℃、1 500 r/min 离心3 min,收集细胞沉淀,再加入1 mL JC⁃1 染色缓冲液(1×)重悬细胞,4 ℃、1 500 r/min 离心3 min,收集细胞沉淀。JC⁃1 染色缓冲液(1×)重悬,流式细胞仪检测。
2.6 流式检测细胞ROS 水平 稀释DCFH⁃DA,使其终浓度为10 μmol/L。将细胞悬浮于DCFH⁃DA 中,细胞浓度为1.0×107/mL,室温孵育30 min,每隔5 min 混匀一下,使细胞和探针充分接触。用无血清培养液洗涤细胞3 次,收集各组细胞,流式细胞仪检测。
2.7 ATP 测试盒测定细胞内ATP 水平 收集各组细胞,按照ATP 测试盒说明书严格操作,测定细胞内ATP 浓度。
2.8 Western blot 检测凋亡相关蛋白表达水平 RIPA 裂解液裂解细胞,提取总蛋白,BCA 法进行蛋白定量,以20 μg蛋白上样量进行SDS⁃PAGE 电泳,将蛋白转印至PVDF 膜,5%脱脂奶粉室温封闭2 h,加入一抗(Bcl⁃2、caspase⁃3、caspase⁃9,1 ∶2 000;Bax、Cyt⁃c,1 ∶1 000),室温孵育1 h,PBS 洗涤3 次,加入经辣根过氧化物酶标记的二抗,室温孵育1 h,PBA 洗涤3 次,滴加化学发光试剂,充分接触后,于全自动化学发光分析仪中检测,读取条带灰度值。
2.9 统计学分析 采用SPSS 22.0 软件进行统计学分析,重复3 次,计量资料以()表示。多组间比较使用单因素方差分析。以P<0.05 表示差异具有统计学意义。
3 结果
3.1 软骨细胞鉴定 甲苯胺蓝染色鉴定软骨细胞,细胞呈贴壁生长,细胞形态不一,多呈梭形,胞浆着浅蓝色,细胞核清晰呈圆形,着深蓝色,见图1。
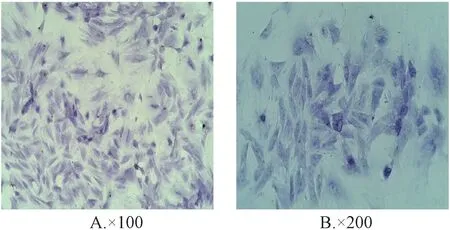
图1 甲苯胺蓝染色鉴定软骨细胞
3.2 姜黄素对软骨细胞凋亡的影响 与对照组细胞相比,模型组出现部分细胞核固缩深染,凋亡小体呈亮蓝色,说明模型组部分细胞出现凋亡。中、高剂量的姜黄素干预后,凋亡小体减少,见图2。

图2 Hoechst 33258 染色观察细胞凋亡水平(×200)
3.3 姜黄素对细胞线粒体膜电位的影响 与对照组比较,模型组细胞绿色荧光增强(C4 区),细胞占比增多(P<0.05),说明模型组细胞的线粒体膜电位去极化,发生早凋的细胞增多;姜黄素低、中、高剂量组线粒体去极化细胞少于模型组(P<0.05),且中、高剂量组效果更明显(P<0.05),见图3。

图3 流式检测软骨细胞线粒体膜电位变化
3.4 姜黄素对软骨细胞ATP 浓度的影响 对照组ATP 浓度为(364.74±24.41)μmol/g prot,模型组[(148.77±20.37)μmol/g prot] 降低(P<0.05);姜黄素低剂量组ATP 浓度为(214.64±18.09)μmol/g prot,中剂量组为(243.26± 13.37)μmol/g prot,高剂量组为(297.74 ±16.83)μmol/g prot,均高于模型组(P<0.05),高剂量组ATP 浓度高于低剂量组(P<0.05)。
3.5 姜黄素对软骨细胞ROS 水平的影响 与对照组比较,模型组ROS 水平升高(P<0.05);与模型组比较,姜黄素低、中、高剂量组ROS 水平降低(P<0.05);与低剂量组比较,高剂量组ROS 水平降低(P<0.05)。见图4。

图4 流式检测软骨细胞ROS 水平变化
3.6 姜黄素对软骨细胞凋亡相关蛋白表达的影响 与对照组比较,模型组Bax、Cyt⁃c、caspase⁃3、caspase⁃9 蛋白表达升高(P<0.05),Bcl⁃2 蛋白表达减低(P<0.05);与模型组相 比,姜黄素 低、中、高剂量 组 Bax、Cyt⁃c、caspase⁃3、caspase⁃9 蛋白表达降低,Bcl⁃2 蛋白表达升高,以中、高剂量组更明显(P<0.05),呈现出剂量依赖性。见图5。

图5 Western blot 检测软骨细胞Bax、Cyt⁃c、caspase⁃3、caspase⁃9 和Bcl⁃2 蛋白表达
4 讨论
软骨细胞作为软骨中存在的唯一细胞类型,分散于细胞外基质中,发挥着维持软骨结构完整性和负重功能等作用[9]。与健康软骨相比,OA 中软骨细胞凋亡的发生率更高,可能是关节持续机械损伤的结果,且软骨细胞的凋亡水平与软骨损伤的严重程度呈正相关[10]。软骨细胞凋亡在OA 的发生发展中起着关键性作用,由于目前对OA 的治疗仅对症状起作用,不能预防和治愈OA,因此,抑制软骨细胞凋亡可能是调节OA 软骨变性的有效靶点[11⁃12]。
细胞凋亡由复杂的信号途径有序地触发而引起,其中死亡受体介导的外源性途径和线粒体控制的内源性途径为调控细胞凋亡的主要途径,且这两种途径间相互关联[13]。Yang 等[14]研究发现线粒体功能障碍及其级联反应诱导了OA 软骨细胞的凋亡。在OA 的发展过程中,炎症细胞因子进入软骨细胞,导致线粒体膜电位降低,通透性增加释放Cyt⁃c,招募caspase⁃9 形成复合凋亡体,再激活下游凋亡效应器caspase⁃3,产生一系列的酶联激活反应,导致软骨细胞凋亡[15⁃16]。Bcl⁃2 家族可调控线粒体膜通透性,其中促凋亡蛋白Bax 接收到凋亡信号后向线粒体转移,促进Cyt⁃c 释放,而抗凋亡蛋白Bcl⁃2 存在于线粒体外膜,抑制Cyt⁃c 的释放[17]。当线粒体功能发生故障时,可引起一系列的代谢变化,增加ROS 的产生,减少ATP 和氧气的消耗[18]。Shi等[19]研究也发现受损的软骨细胞释放出ROS 并激活炎症因子,进而加重软骨细胞的凋亡。
姜黄素是中药材姜黄中主要活性成分,具有抗炎症、抗氧化、抗分解代谢等药理活性,在OA 中具有保护关节软骨的作用[20]。前期研究[8]以及郭杨等[21]研究结果均证实姜黄素具有抑制OA 软骨细胞凋亡的作用,但其具体作用机制仍需明确。袁伟等[22]认为姜黄素可能通过抑制线粒体凋亡途径,从而减少硝普钠诱导的大鼠软骨细胞的凋亡。本次研究结果进一步验证了姜黄素对软骨细胞线粒体凋亡途径的作用,姜黄素明显升高了炎症软骨细胞的线粒体膜电位以及ATP 浓度,降低ROS 水平,并抑制Bax、Cyt⁃c、caspase⁃3、caspase⁃9 蛋白表达,促进Bcl⁃2 蛋白表达,且表现出姜黄素的剂量依赖性。
综上所述,姜黄素可通过调控线粒体介导的内源性途径抑制脂多糖诱导的炎症软骨细胞的凋亡,并改善线粒体功能故障。

