参麦注射液对脂多糖诱导HUVECs 细胞损伤的影响
陈勇德,俞维英,沈志华
(绍兴市中心医院医共体总院,浙江 绍兴 312030)
随着生活水平的提高,动脉粥样硬化(atherosclerosis,AS)相关疾病已跃居于人口死亡的主要原因之列。动脉粥样硬化的发病机制很复杂,一般认为其发生的机制包括自由基损伤、炎症反应、脂质代谢紊乱等。这些机制不是独立发挥作用的,而是相互影响,最终导致斑块的破裂,造成严重心脑血管疾病。这些机制中炎症机制是研究者普遍认可的动脉硬化机制,炎症是机体对损伤产生的一种保护性反应,但过度的炎症反应也可直接导致组织细胞的损伤和凋亡[1],抗炎治疗目前已经成为动脉粥样硬化的主要治疗手段[2]。
参麦注射液是红参、麦冬的提取物,益气固脱,养阴生津,生脉。用于治疗气阴两虚型之休克、冠心病、病毒性心肌炎、慢性肺心病、粒细胞减少症[3⁃4]。有研究表明参麦注射液能调节炎症因子的表达[5⁃6],对机体细胞起保护作用,同时降低细胞黏附因子的表达[7⁃9],从而影响单核细胞向内皮黏附、迁移[10],降低细胞凋亡的发生本研究从参麦注射液参麦注射液对人脐静脉内皮细胞相关炎症因子及黏附因子的表达来探讨其抗动脉粥样硬化的机制[11]。
1 材料
1.1 试剂与药物 参麦注射液,批号1712137,购自正大青春宝药业有限公司,使用含血清培养基进行稀释至2%、5%;Human Endothelial⁃SFM(Thermo,批号41966052);Medium 199(Thermo,批号 43955451);胎牛血清(GIBCO,N170810PA);二甲基亚砜(Sigma,RNBJ1732);脂多糖(lipopolysaccharide,LPS)(Sigma,089K0733);磷烯醇丙酮酸(Aladdin,批号180752);RIPA 细胞裂解液(南京建成生物工程研究所,批号170511);BCA 试剂盒(南京建成生物工程研究所,批号180107);PVDF 膜(Millipore,批号R9AA8534);ICAM⁃1 单抗(CST,批号875147);VCAM⁃1 单抗(CST,批号457814);β⁃actin(CST,批号854275)。
1.2 细胞株 THP⁃1 细胞,购自上海中国科学院细胞库。
1.3 仪器 3111 CO2培养箱(美国Thermo 公司);C6 plus 流式细胞仪(美国BD 公司);Ti2⁃U 荧光倒置显微镜(日本尼康公司);EPS 300 电泳仪(上海天能科技有限公司);Tanon 4100 凝胶成像仪(上海天能科技有限公司);CFX connect 荧光定量PCR 仪(美国伯乐公司)。
2 方法
2.1 细胞培养
2.1.1 原代HUVECs 细胞培养 无菌条件下取新生儿脐带,参照Human Endothelial⁃SFM(GIBCO)培养基说明,用含双抗的Medium 199 培养基灌洗脐静脉;灌洗后一端用止血钳夹闭,另一端灌入含0.1% Ⅰ型胶原酶的Medium 199,待静脉充盈后,用止血钳夹闭灌入端。于22 ℃孵育25 min;收集静脉中的消化液,并用50 mL Medium 199 继续灌洗静脉,收集灌洗液并合并。置于离心机中,常温下100×g离心5 min,弃去上清,用50 mL Medium 199 重悬并洗涤细胞;细胞经洗涤后,用5 mL Endothelial⁃SFM(20 μg/mL)重悬细胞,将细胞接种至培养皿中,37 ℃、5%CO2培养箱内培养。同时观察细胞生长情况;待细胞长至单层80%融合时,传代培养[12]。
2.1.2 THP⁃1 细胞培养 细胞系采用含10% FBS、1%PEP、1%双抗的RPMI⁃1640 培养基进行培养,细胞生长密度至85%~90%时,按1 ∶2 比例进行传代。
2.2 细胞黏附测试 THP⁃1 细胞生长至70%~80%左右时进行慢病毒(GFP 标记)转染,24 h 后更换培养基,继续培养48 h。HUVECs 细胞生长至80%~90%时进行接种,细胞接种至12 孔板中继续培养至贴壁,细胞各组除空白组外给予1μg/mL LPS 处理24 h,移去培养基后给药组分别给予不同浓度的参麦注射液(2%、5%),继续培养24 h 后,每孔加入GFP 标记的THP⁃1 细胞(2×105/孔),培养30 min后用PBS 洗去漂浮细胞,使用荧光显微镜观察细胞[13⁃14]。
2.3 RT⁃PCR 检测用TRIzol 试剂盒提取细胞总RNA。产物经First⁃Strand Synthesis System(Takara)试剂盒反转录生成cDNA,采用SYBR Green 荧光染料法进行实时定量PCR检测各组mRNA 表达,反应体系为25 μL,各引物序列为GAPDH正向5′⁃CAGGGCTGCTTTTAACTCTGGT⁃3′,反向5′⁃GATTTTGGAGGGATCTCGCT⁃3′;ICAM⁃1 正向5′⁃ TCTGTGT CCCCCTCAAAAGTC⁃3′,反向5′⁃ GGGGTCTCTATGCCCAA CAA⁃3′;VCAM⁃1 正向5′⁃ GCTGCTCAGATTGGAGACTCA⁃3′,反向5′⁃CGCTCAGAGGGCTGTCTATC⁃3′;TNF⁃α 正向5′⁃CCCGAGTGACAAGAATGTAG⁃3′,反向 5′⁃TGAGGTA CAGGCCCTCTGAT⁃3′;IL⁃6 正向 5′⁃AATGAGGAGACT TGCCTGGT⁃3′,反向5′ ⁃GCAGGAACTGGAT CAGGACT⁃3′;IL⁃1β 正向5′⁃CAGATGAAGTGC TCCTTCCA⁃3′,反向5′⁃ACCAGCATCT TCCTCAGCTT⁃3′。
2.4 Western blot 检测 采用RIPA 细胞裂解液提取各组HUVECs 细胞总蛋白,用BCA 试剂盒进行蛋白定量。总蛋白中加入1/4 体积的上样缓冲液,沸水浴处理后,上样进行10% SDS⁃PAGE 电泳(50 μg/孔)。电泳后进行转膜(PVDF)并封闭,加入一抗4 ℃孵育过夜。经荧光标记的二抗室温孵育1 h 洗膜后,将膜置于凝胶成像仪上成像。以目的蛋白与β⁃actin 条带光密度值之比值表示目的蛋白表达水平。
2.5 ELISA 检测 取对数生长期的HUVECs 细胞接种于6孔板中,培养至细胞贴壁后,加入1 μg/mL LPS 孵育24 h[15],给予含不同体积分数的参麦注射液(2%、5%)培养基继续培养细胞,24 h 后收集细胞上清液,按ELISA试剂盒说明,检测上清中IL⁃1β、TNF⁃α、IL⁃6 等炎症因子的水平。
2.6 细胞凋亡检测 取对数生长期的HUVECs 细胞接种于6 孔板中,于37 ℃、5% CO2培养箱中培养24 h,加入LPS,以含普通培养基为实验空白组。LPS 作用24 h 后分别给予不同浓度的参麦注射液,继续培养24 h 后,收集各组细胞,1 000 r/min 离心5 min,弃上清,用预冷的PBS重悬和洗涤细胞2 次,然后进行细胞计数。按照AnnexinV/PI 试剂盒说明书加入细胞重悬结合液190 μL,再加入10 μL PI,避光孵育5~10 min,然后用流式细胞仪检测并分析细胞凋亡情况。凋亡率=早期凋亡率+晚期凋亡率。
2.7 统计学分析 采用GraphPad Prism 5.0 软件进行数据分析,计量资料以()表示。多组间比较采用单因素方差分析(ANOVA)进行统计。P<0.05 为差异有统计学意义。
3 结果
3.1 参麦注射液抑制LPS 诱导的HUVECs 细胞凋亡 空白组的凋亡率为(4.87±1.26)%,模型组的凋亡率升高至(37.86±5.61)%,2% 参麦注射液组为(25.78±3.97)%,5% 参麦注射液组为(17.34±4.15)%,呈剂量依赖性抑制HUVECs 细胞凋亡。与模型组比较,2%、5%参麦注射液凋亡率均降低(P<0.01)。见图1。

图1 参麦注射液对脂多糖诱导的HUVECS 细胞凋亡的影响(n=3)
3.2 参麦注射液抑制LPS 诱导的细胞黏附及相关因子表达LPS 处理HUVECs 细胞后,细胞的黏附能力增加,与空白组相比较THP⁃1 细胞黏附量增加,ICAM⁃1、VCAM⁃1 蛋白和mRNA 表达升高(P<0.05,P<0.01);给予2%、5%参麦注射液处理后,细胞的黏附能力下降,ICAM⁃1、VCAM⁃1 蛋白和mRNA 表达降低(P<0.05,P<0.01)。见图2~3。

图2 参麦注射液抑制LPS 诱导的细胞黏附(n=3)
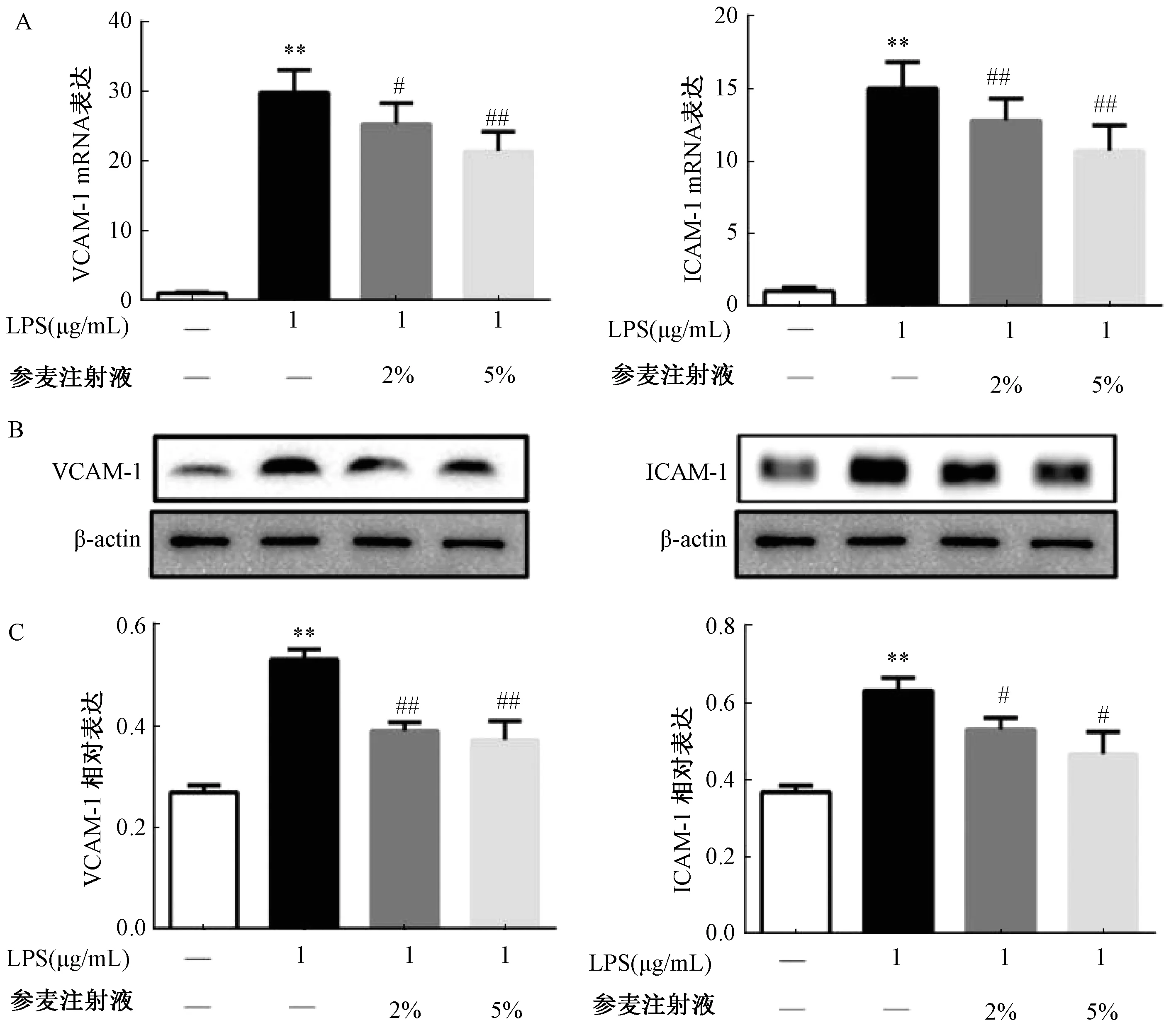
图3 参麦注射液对LPS 诱导的VCAM⁃1 和ICAM⁃1 表达影响(n=6)
3.3 参麦注射液抑制LPS 诱导的炎症因子表达 LPS 处理HUVECs 细胞后,细胞IL⁃1β、IL⁃6、TNF⁃α 表达增加(P<0.01);给予2%、5% 参麦注射液处理后,IL⁃1β、IL⁃6、TNF⁃α 表达降低(P<0.05,P<0.01)。见图4。
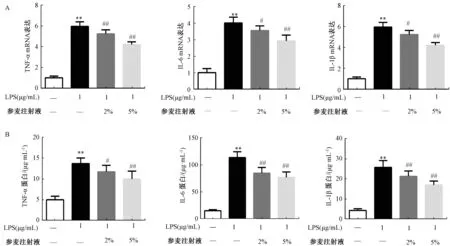
图4 参麦注射液抑制LPS 诱导的炎症因子(TNF⁃α、IL⁃6、IL⁃1β)表达(n=6)
4 讨论
炎症是动脉粥样硬化性疾病的基本特征,同时亦是AS的始动因子。炎症参与了AS 的不同病理过程。在AS 发展过程中,始终有大量的炎症因子参与其中。其中TNF⁃α 具有直接的促炎作用,可诱导炎症因子的表达和释放,促进炎性细胞的生成,导致内皮细胞功能障碍,最终促进AS的发生和发展。而IL⁃6 是由多种细胞分泌,能够放大急性炎症反应,促使机体产生慢性炎症,并处于中心地位。炎症因子IL⁃1β 可通过上调ox⁃LDL 及LOX⁃1 表达,参与死亡蛋白介导的内皮细胞损伤,促进平滑肌细胞增殖、趋化。故调整上述炎症因子能有效缓解细胞炎症的发生。本研究证实LPS 诱导HUVECs 细胞可导致细胞IL⁃6、IL⁃1β 和TNF⁃α 的蛋白和mRNA 表达明显增高,当给予参麦注射液孵育后,这三种炎症因子显著下调。实验表明参麦注射液可以通过抑制炎症因子的表达,从而抑制细胞炎症的发生和发展。炎症反应的发生和发展,会进一步导致细胞细胞凋亡的发生。当给予人脐静脉内皮细胞LPS 处理后,HUVECs 细胞凋亡率显著增加,而给予参麦注射液后凋亡率显著降低。说明参麦注射液能有效保护LPS 导致的细胞凋亡。
动脉粥样硬化的发生与发展还与黏附因子密切相关,细胞黏附因子能介导细胞间的黏附,并参与细胞的信号传导与活化、细胞的生长与分化等一系列重要生理和病理过程。在病变形成早期VCAM⁃1 能促进单核细胞向内皮黏附、迁移,在进展期病变,促进已迁入病灶的单核细胞滚动、T淋巴细胞的激活,并增加其它细胞与细胞间的相互作用。而在内皮细胞表达的黏附因子ICAM⁃1 涉及单核细胞、淋巴细胞向内皮的黏附及迁移。本研究发现LPS 可以促进内皮细胞中VCAM⁃1、ICAM⁃1 的产生,最终导致内皮细胞的黏附能力增加。而给予参麦注射液后,人脐静脉内皮细胞对THP⁃1 细胞的黏附能力下降,同时黏附因子的mRNA 及蛋白表达均显著下降。综上所述,参麦注射液具有抑制炎症因子表达,降低黏附因子生成,并缓解细胞凋亡发生的作用。

