伤寒沙门菌激活TRAIL信号通路促进巨噬细胞凋亡
尹芬芬,杨帆帆,谢中艺,王雨柔,黄新祥,生秀梅,张 盈
(江苏大学医学院,江苏 镇江 212013)
伤寒沙门菌(Salmonellaentericaserovar Typhi,简称S.Typhi)是一种寄生在人类肠道的革兰氏阴性杆菌,属胞内寄生菌,具有严格的宿主特异性,人是其惟一的感染宿主[1].粪口传播是S.Typhi主要的传播途径,S.Typhi通过污染的食物和水源进入机体,经消化道感染,最终引起严重的全身系统性疾病,伤寒热是其典型症状,此外还会出现一些其他症状,如躯干上出现玫瑰疹、腹痛、腹泻、肝脾肿大、胃肠出血等[2].
凋亡是由基因调控的细胞主动性死亡,包括外源性和内源性途径.外源性通路主要是配体和死亡受体结合募集FADD和caspase-8前体,形成死亡诱导信号复合物DISC,进一步激活caspase-8以及下游caspase-3蛋白,caspase-8是外源性途径的关键蛋白.内源性线粒体通路主要由DNA损伤、毒素等多种因素诱发线粒体释放细胞色素c,协同凋亡蛋白活性因子-1激活caspase-9,进而激活caspase-3、caspase-7,caspase-9是内源性途径的关键蛋白[3];内源性内质网通路主要是由内质网失常引起Ca2+紊乱、大量未折叠或错误折叠蛋白堆积等引起内质网应激,特异性激活caspase-12,进而剪切活化caspase-3,诱导细胞凋亡[4].三条通路最终的执行蛋白均为caspase-3,caspase-3被认为是凋亡的关键蛋白酶.
沙门菌感染巨噬细胞后能够诱导细胞凋亡,逃避宿主的免疫识别,有利于细菌在宿主内更好的存活.S.Typhi感染巨噬细胞后激活TNF-α,通过增加机体活性氧ROS、减少抗氧化物酶SOD产生来介导细胞凋亡,TNF-α和其受体结合后激活caspase-8、caspase-3介导的外源性凋亡途径[5];鼠伤寒沙门菌三型分泌系统(Type Ⅲ Secretion System,T3SS)分泌的效应蛋白SipA能够促进RAW264.7细胞中caspase-3的激活,诱导细胞凋亡[6].
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是肿瘤坏死因子(tumor necrosis factor,TNF)家族的一员,属于Ⅱ型跨膜蛋白.TRAIL蛋白和死亡受体4/5(Death receptor,DR4/5)结合介导的凋亡通路是近些年的研究热点,外源加入重组TRAIL蛋白或TRAIL受体激动剂能够诱导乳腺癌、肾癌等肿瘤细胞凋亡,从而起到较好的疾病治疗效果[7-8],TRAIL处理也可以诱导鼠巨噬细胞RAW264.7呈现时间依赖性凋亡[9];也有研究发现,TRAIL蛋白能够诱导某些正常细胞如人肝细胞、人角质细胞等发生凋亡[10-11].沙门菌感染机体过程中,巨噬细胞是抵抗细菌入侵过程中重要的吞噬细胞,在机体免疫应答及维持内环境稳态中发挥着重要的作用,沙门菌也进化出相应的机制如在巨噬细胞内形成含沙门菌的囊泡SCV (Salmonell-containing vacuole)等得以在细胞内生存及增殖[12].但是TRAIL凋亡通路在细菌影响巨噬细胞凋亡方面的研究较少.因此,本研究通过S.Typhi感染巨噬细胞来探究沙门菌对巨噬细胞凋亡通路的影响以及TRAIL信号通路在其中发挥的作用.
1 材料和方法
1.1 材料
1.1.1 菌株和细胞株S.Typhi 野生株GIFU10007(以下简称为WT)由日本岐阜大学医学院微生物学教研室馈赠;人髓系白血病单核细胞THP-1购买自上海生科院细胞库,由本实验室保存及培养.
1.1.2 主要试剂 RNA提取试剂(Sigma公司),逆转录试剂、SYBR荧光定量试剂(Vazyme公司),RPMI1640细胞培养液、佛波酯PMA (Phorbol-12-myristate-13-acetate)、胎牛血清(Gibco公司),Annexin V FITC/PI凋亡试剂盒(联科生物科技公司),caspase-3、caspase-8、caspase-9抗体(ABclonal生物科技公司),TRAIL、DR5抗体(Proteintech公司),RIPA裂解液(上海生工生物工程有限公司).
1.1.3 主要仪器 恒温摇床、CO2细胞培养箱、核酸检测仪(Thermo scientific公司),分光光度计、PCR扩增仪(Eppendorf公司),定量PCR仪、免疫印迹凝胶成像系统(Bio-Rad公司),流式细胞仪(Beckman公司).
1.1.4 引物 实验中所用引物均由苏州泓讯生物科技有限公司合成,序列见表1.
1.2 方法
1.2.1 细菌培养 将WT接种于2 mL新鲜液体LB培养基中,置于摇床中37 ℃、250 r·min-1培养过夜作为种子液.次日,按1∶100的比例将种子液转接至20 mL新鲜液体LB培养基中,继续培养至对数早期(A600为0.4左右).
1.2.2 细胞培养 THP-1细胞置于37 ℃、5% CO2细胞培养箱中,用含10%胎牛血清的RPMI1640细胞培养液培养,按7×105mL-1的细胞密度接种于六孔板中,加入150 μg·L-1PMA诱导48 h,THP-1细胞分化为巨噬细胞.

表1 qPCR特异性引物名称及序列Tab.1 Specific primer names and sequences used for qPCR
1.2.3 细胞感染 实验前1 h吸去培养液,用无菌PBS洗涤2次后加入新鲜的细胞培养液.按MOI为20∶1的比例感染巨噬细胞,加入WT菌株的时间点记为0 h;细菌感染1 h后,每孔加入100 mg·L-1庆大霉素杀死胞外细菌,继续培养1 h,每孔弃去一半培养液,加入等量的新鲜培养液继续培养至不同时间点.TRAIL抗体处理实验中细胞分为3组,细菌感染细胞前1 h即未加入细菌时,第1组细胞加入TRAIL抗体,其终浓度为500 μg·L-1,作为实验组,第2组细胞加入无菌PBS,作为对照组;前2组细胞均加入细菌感染,第3组细胞加入等量新鲜的RPMI1640培养液,不加入细菌,作为未感染组;感染2 h更换一半新培养液时,补充一半抗体,使其终浓度保持不变.
1.2.4 RNA-seq WT感染THP-1细胞0 h、4 h和26 h时,弃去培养液,无菌PBS洗涤2次,用Trizol法提取细胞RNA,进行转录组测序.
1.2.5 qPCR检测凋亡相关基因转录水平 取2 μg RNA,Oligo(dT)为引物逆转录为cDNA.以β-actin作为内参基因,相对定量法检测凋亡相关基因的表达水平,对RNA-seq结果进行验证.实验有3次以上生物学重复.
1.2.6 流式细胞术检测细胞凋亡 WT感染THP-1细胞0 h、6 h和24 h时收集细胞,Annexin V FITC/PI染色法对细胞进行染色,1 h内完成流式细胞仪上机检测,操作过程严格按照凋亡试剂盒说明书进行.实验有3次以上生物学重复.
1.2.7 蛋白质免疫印迹法检测细胞凋亡 WT感染THP-1细胞0 h、6 h、24 h时,弃去培养液,无菌PBS洗涤2次后,加入RIPA裂解液冰上裂解,12 000 r·min-1、4 ℃离心10 min,取上清液进行后续蛋白质免疫印迹检测.
1.3 统计学分析
利用GraphPad Prism 8.0、SPSS统计软件分析数据,两组间均数比较采用t检验.P<0.05表示差异有统计学意义.
2 实验结果
2.1 qPCR检测凋亡相关基因表达水平
取S.Typhi感染THP-1细胞0 h、4 h和26 h后的RNA样本进行RNA-seq,将4 h和26 h的转录组数据分别与0 h比较,筛选出与细胞凋亡密切相关且存在变化的基因(表2).进一步使用qPCR对RNA-seq结果进行验证.qPCR结果显示caspase-3、caspase-8在4 h表达未有明显变化,26 h表达水平显著增加(图1A、1B),caspase-9在4 h表达下降,26 h表达水平增加(图1C),Tnfsf10(编码TRAIL蛋白)、Tnfrsf10b(编码DR5蛋白)、Tnf、Fas在4 h、26 h均出现明显的转录增加(图1D~1G).RNA-seq中caspase-9在4 h表达基本无变化,caspase-3、Fas基因26 h表达略有下降,与qPCR结果存在差异,其余基因验证结果与RNA-seq一致.以上数据表明TRAIL、TNF、FAS三条外源性凋亡通路在感染早期和后期均发生不同程度的激活.
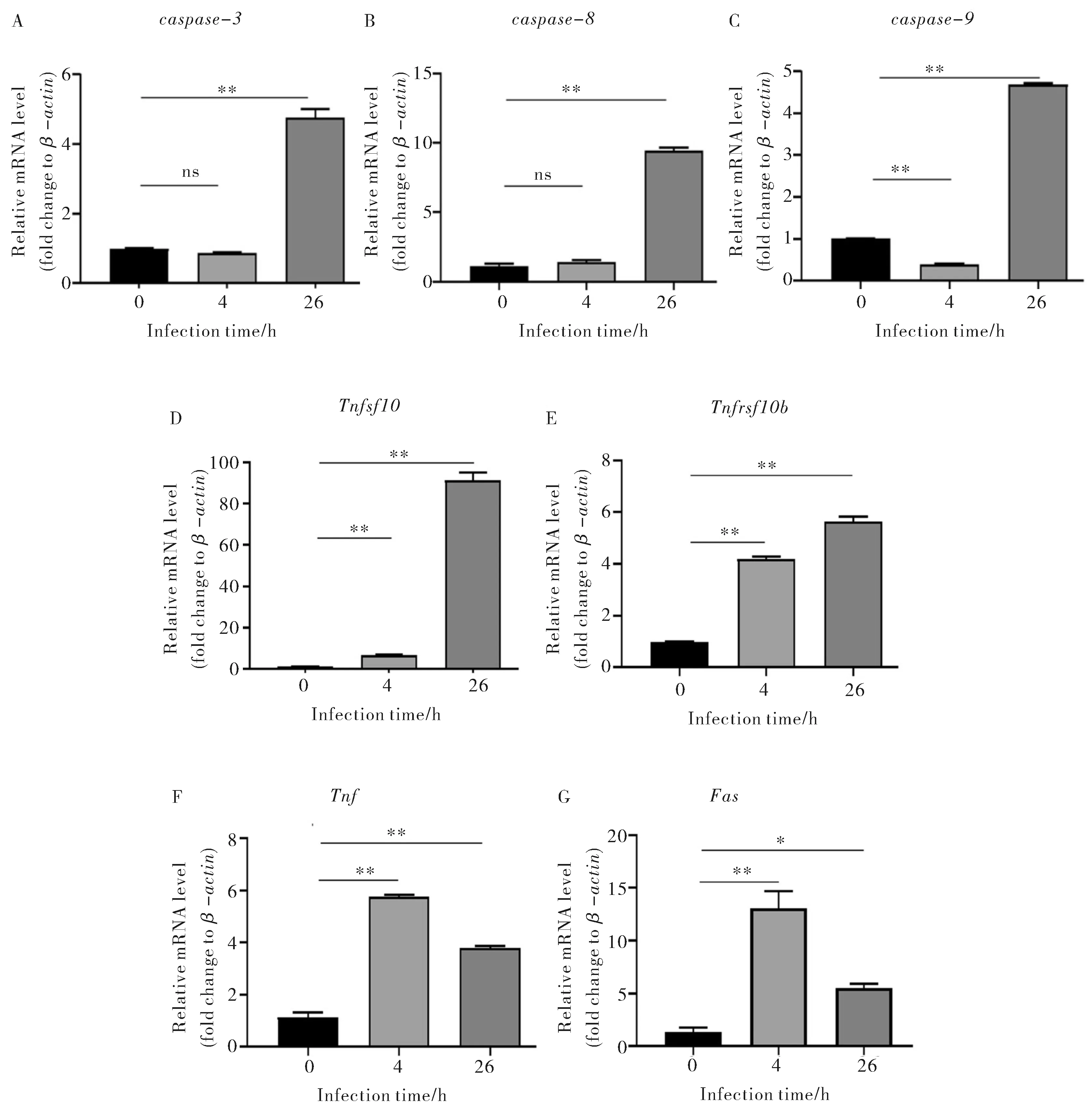
注:*:P<0.05,**:P<0.01,ns:P>0.05图1 qPCR检测THP-1细胞凋亡相关基因的表达Fig.1 Expression of apoptosis-related genes in THP-1 cells was detected by qPCR
2.2 S. Typhi诱导巨噬细胞凋亡
S.Typhi感染THP-1细胞0 h、6 h和24 h后,流式细胞术检测细胞凋亡情况.结果如图所示,S.Typhi感染6 h和24 h后,细胞凋亡较未感染(0 h)时明显增加,24 h细胞凋亡率较6 h也明显增多(图2A、2B,P<0.05,差异有统计学意义),说明S.Typhi能够诱导THP-1细胞凋亡,且随着感染时间的增加,细胞凋亡越明显.
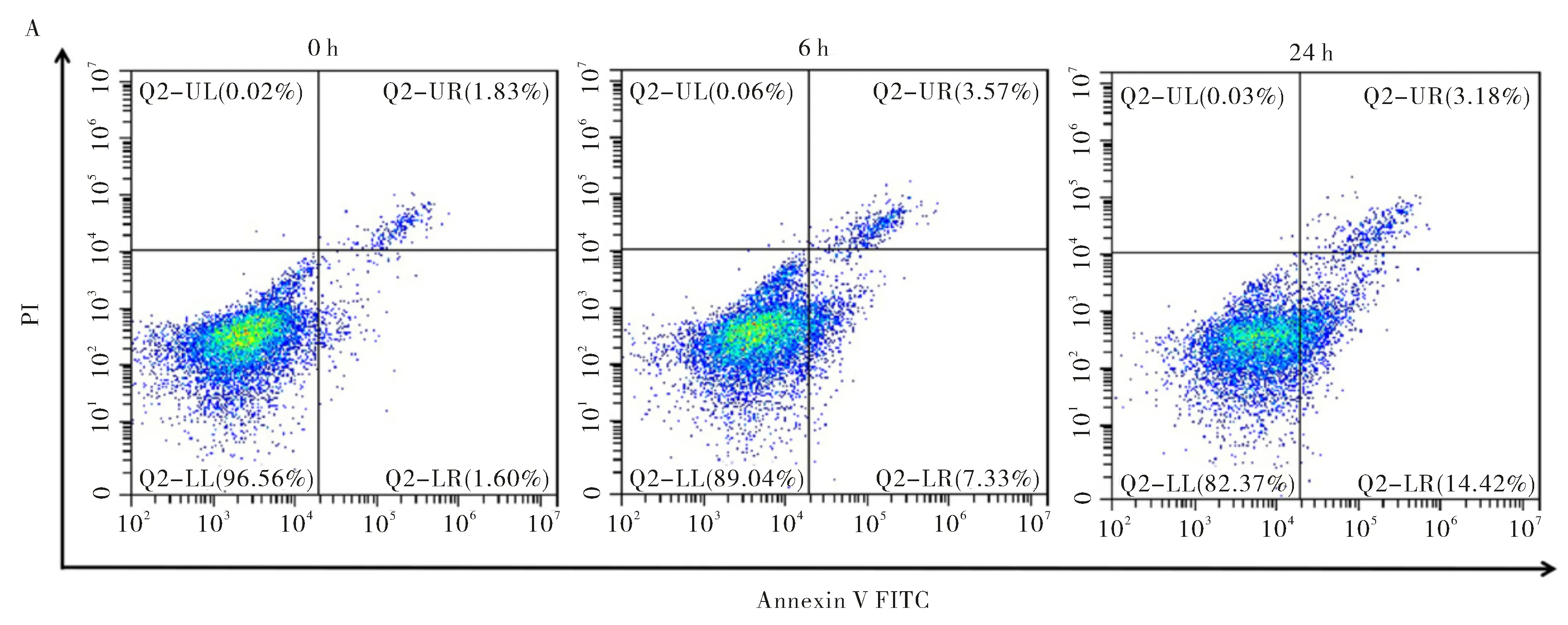
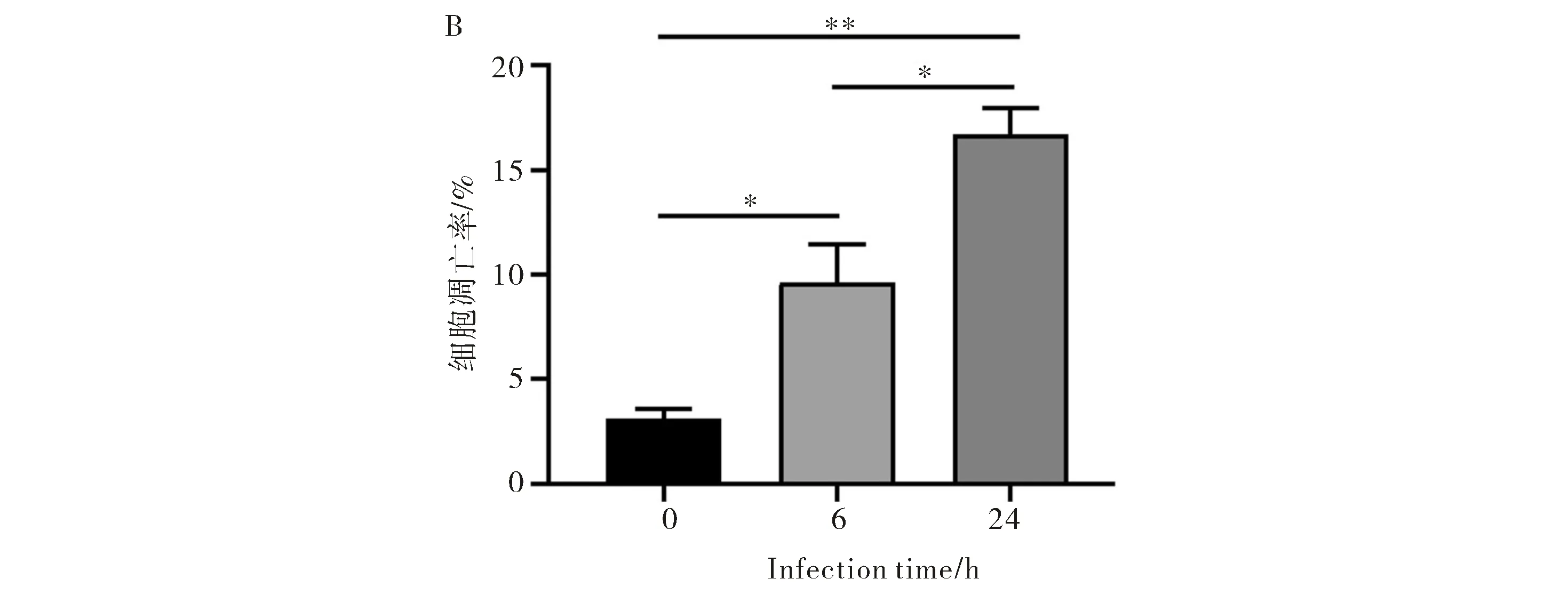
注:*:P<0.05,**:P<0.01图2 流式细胞术检测THP-1细胞凋亡(A)及其统计结果(B)Fig.2 Apoptosis rate in THP-1 cells was detected by flow cytometry (A)and its statistical results (B)
凋亡相关蛋白在细胞凋亡过程中发生级联反应,上游caspase蛋白特异性剪切激活下游底物蛋白,进而在细胞凋亡中发挥作用.通过蛋白质免疫印迹法检测凋亡相关蛋白caspase-3、caspase-8、caspase-9剪切条带的表达水平,结果如图3所示,S.Typhi未感染细胞(0 h)时,三个蛋白未发生剪切活化,细菌感染THP-1细胞6 h和24 h时均检测到三个蛋白的剪切条带,24 h caspase-3、caspase-9剪切条带明显强于6 h,表明S.Typhi感染细胞后激活外源性、内源性途径诱导其凋亡,感染后期细胞凋亡明显增加,此结果与前述qPCR和流式细胞术结果一致.
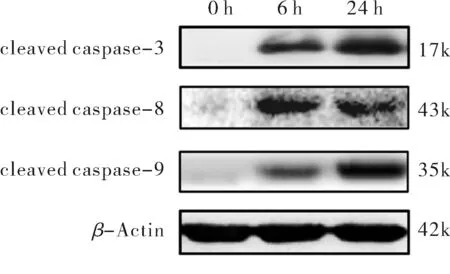
图3 蛋白质免疫印迹法检测caspase-3、caspase-8、caspase-9剪切蛋白的水平Fig.3 Levels of cleaved caspase-3,caspase-8 and caspase-9 detected by western blot
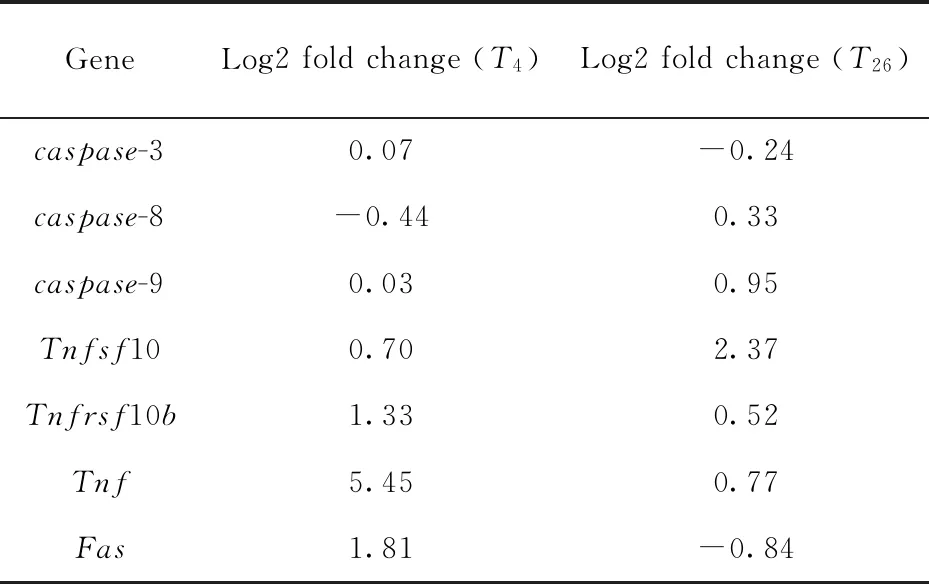
表2 RNA-seq 凋亡相关基因表达变化Tab.2 Expression changes of apoptosis-related genes in RNA-seq
2.3 S. Typhi激活TRAIL信号通路
蛋白质免疫印迹法检测S.Typhi感染细胞0 h、6 h和24 h后TRAIL信号通路中死亡配体TRAIL和其受体DR5的表达情况.结果如图4所示,S.Typhi未感染细胞(0 h)时TRAIL几乎不表达,细菌感染后TRAIL的表达显著增加,DR5蛋白表达水平较未感染时也明显增加,但未呈时间依赖性.以上结果表明S.Typhi感染THP-1细胞后能够诱导TRAIL信号通路的激活.
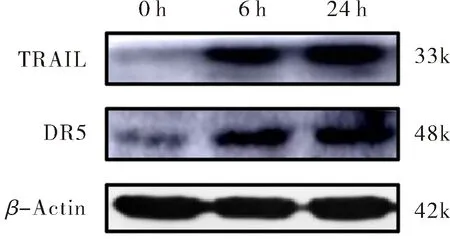
图4 蛋白免疫印迹法检测TRAIL及其受体DR5的蛋白水平Fig.4 Protein levels of TRAIL and its receptor DR5 detected by western blot
2.4 TRAIL抗体处理减少THP-1细胞凋亡
在S.Typhi感染细胞前1 h加入TRAIL抗体(anti-TRAIL Ab)来结合活化的TRAIL蛋白,另外未加菌感染和加无菌PBS作为对照.S.Typhi感染THP-1细胞6 h时,通过蛋白质免疫印迹和流式细胞术来检测细胞凋亡情况.实验结果显示,与PBS对照组相比,加入TRAIL抗体处理后凋亡相关蛋白caspase-3剪切条带明显减弱(图5),凋亡细胞数量也明显下降(图6A、6B,P<0.05,差异有统计学意义).以上结果表明TRAIL抗体通过结合活化的TRAIL蛋白,一定程度上阻断了TRAIL凋亡通路的激活,进而减少细胞凋亡的发生,进一步证实了S.Typhi能够激活TRAIL信号通路,且TRAIL信号通路在S.Typhi诱导巨噬细胞凋亡过程中发挥着一定的作用.
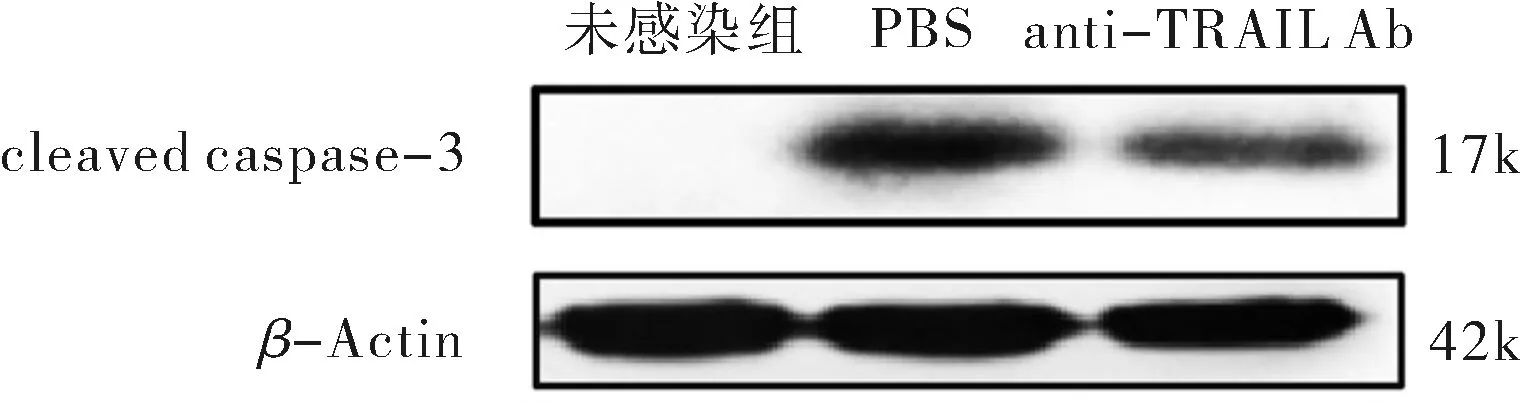
注:未感染组为未加S.Typhi感染,为阴性对照;PBS为S.Typhi感染细胞前1 h加入无菌PBS,为对照组;anti-TRAIL Ab为S.Typhi感染细胞前1 h加入TRAIL抗体,为实验组.图5 蛋白质免疫印迹法检测TRAIL抗体处理后caspase-3的剪切水平Fig.5 Level of cleaved caspase-3 after TRAIL antibody treatment detected by western blot
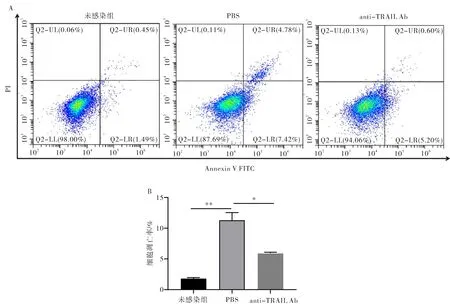
注:未感染组为未加S.Typhi感染,为阴性对照;PBS为S.Typhi感染细胞前1 h加入无菌PBS,为对照组;anti-TRAIL Ab为S.Typhi感染细胞前1 h加入TRAIL抗体,为实验组;*:P<0.05,**:P<0.01.图6 流式细胞术检测TRAIL抗体处理后THP-1细胞凋亡变化(A)及其统计结果(B)Fig.6 Apoptosis rate changes in THP-1 cells after TRAIL antibody treatment detected by flow cytometry (A)and its statistical results (B)
3 讨论
S.Typhi感染每年可引起2 000多万病例,导致40多万人死亡[13],在人口密度大、医疗卫生落后的国家和地区,S.Typhi感染仍然是值得关注的公共卫生问题[14].S.Typhi属于粪口传播致病菌,进入机体后突破胃酸屏障,粘附并入侵小肠上皮细胞,而后被巨噬细胞、中性粒细胞、树突状细胞等免疫细胞吞噬,在胞内生存增殖,引起全身系统性感染.
沙门菌感染机体过程中巨噬细胞是其重要的宿主细胞.沙门菌可以抑制巨噬细胞凋亡,有利于细菌在宿主内更好的增殖和生存,也可以诱导巨噬细胞凋亡,逃避机体的免疫识别,同时将凋亡细胞作为载体扩散到全身,造成机体的持续性感染.
沙门菌感染细胞后抑制细胞凋亡已有相关文献报道.沙门菌T3SS-1分泌的效应蛋白AvrA具有乙酰转移酶活性,通过乙酰化抑制丝裂原活化蛋白激酶4/7(MKK4/7)水平的JNK通路激活,进而对细胞凋亡发挥抑制作用.鼠伤寒沙门菌感染小鼠肠上皮IEC6细胞、骨髓来源的巨噬细胞时,AvrA能够抑制其凋亡,AvrA缺陷可引起全身细胞因子反应强烈、上皮细胞及巨噬细胞凋亡增加[15].沙门菌感染细胞后也可以诱导巨噬细胞凋亡,逃避机体的免疫识别,减少炎症反应.沙门菌T3SS-1分泌的双功能效应蛋白SipA能够促进宿主细胞肌动蛋白聚合,在鼠伤寒沙门菌感染RAW264.7细胞早期激活caspase-3,诱导细胞凋亡[6];S.Typhi感染巨噬细胞后TNF-α和其受体结合激活caspase-8、caspase-3介导外源性途径诱导细胞凋亡.
本研究结果和文献报道[5]一致,检测到Tnf、caspase-3、caspase-8转录水平和caspase-3、caspase-8蛋白水平表达上调,说明外源性途径在凋亡过程中发挥了重要作用.然而文献[5]中S.Typhi感染THP-1细胞8 h后未检测到caspase-9的增加,加入caspase-9抑制剂后细胞凋亡未发生明显变化,认为caspase-9介导的内源性途径不参与凋亡过程,本研究中却检测到细菌感染细胞26 hcaspase-9表达显著增加,感染6 h和24 h caspase-9剪切条带明显增强,猜测可能是caspase-9介导的内源性途径在细胞凋亡过程中发挥的作用弱于外源性途径,以至于加入caspase-9抑制剂未对细胞凋亡产生较大的影响.此外,文献[5]中通过S.Typhi标准菌株感染巨噬细胞8 h使用比色法检测caspase-9含量,其MOI感染比例、感染时间、检测方法以及所使用菌株均与本研究不同,这些因素对结果存在差异也产生一定影响.
本研究中,S.Typhi感染细胞早期,THP-1细胞凋亡发生较弱,可能感染前期细菌表达的组分如荚膜多糖等或分泌的效应蛋白能够抑制巨噬细胞凋亡,从而保证细菌在巨噬细胞内进行大量增殖;随着感染时间增加,细胞凋亡逐渐增强,这也使得在感染后期,胞内增殖的细菌可以释放至细胞外,继而引起持续性和系统性感染.
TRAIL属于Ⅱ型跨膜蛋白,C端在胞膜外,N端在胞膜内,在特异性蛋白酶作用下,TRAIL蛋白胞外区域被剪切为可溶性分子存在于细胞外液中,TRAIL蛋白和DR4/5介导的外源性凋亡通路在诱导肿瘤细胞凋亡方面已经有广泛研究.TRAIL通过降解sigma1受体激活caspase-8、caspase-3诱导人前列腺细胞凋亡[16];喹啉和TRAIL协同作用增强线粒体凋亡通路介导的癌细胞凋亡[8].然而,TRAIL在细菌感染中的作用尚不清楚.TRAIL与受体蛋白的亲和力与温度有关,37 ℃时TRAIL对DR5表现出极强的亲和力,对DR4蛋白的亲和力较弱[17],且RNA-seq中编码DR4的基因未有明显变化,因此本研究通过S.Typhi感染THP-1细胞检测TRAIL及其受体DR5蛋白的表达,发现S.Typhi感染巨噬细胞激活细胞TRAIL信号通路,猜测S.Typhi的某种组分如LPS、Vi荚膜多糖、鞭毛蛋白等或细菌分泌的某种效应蛋白被宿主细胞识别,细胞接收胞外凋亡信号,促进TRAIL和受体的结合,激活TRAIL通路介导的凋亡.加入TRAIL抗体结合剪切活化的TRAIL蛋白阻断TRAIL信号通路后,发现细菌诱导巨噬细胞凋亡作用减弱,再次表明TRAIL通路在细胞凋亡中发挥着一定作用.
沙门菌LPS激活炎性通路后能够激活细胞产生外源性刺激物TNF-α等,可以激活TNF通路介导细胞凋亡,LPS还可以上调细胞中TRAIL的表达诱导细胞凋亡.羊肺炎支原体荚膜多糖诱导气道上皮细胞凋亡,上调Fas和FasL蛋白表达,caspase-8剪切条带增强激活外源性凋亡途径,促进ROS生成及氧化应激,破坏线粒体膜完整性、线粒体膜电位下降,进而激活内源性途径[18].新生隐球菌荚膜多糖激活Fas-FasL通路介导巨噬细胞凋亡,caspase-8直接或通过Bcl2家族蛋白放大凋亡信号间接激活caspase-3[19].沙门菌鞭毛蛋白可以促进原代人巨噬细胞、Jurkat细胞等死亡,以RIP1依赖的方式增加Fas、TNF介导的细胞凋亡[20-21].病原菌通过自身结构组分激活TNF、Fas介导细胞凋亡已有一定的研究,S.Typhi何种组分或效应蛋白介导TRAIL通路的激活尚未可知,有待于深入探究和讨论.
综上所述,S.Typhi感染巨噬细胞可诱导细胞发生凋亡,且TRAIL通过DR5受体激活外源性信号通路在S.Typhi诱导巨噬细胞凋亡过程中发挥了重要的作用,本研究对进一步了解沙门菌的致病机制提供了一定的思路.

