磷限制对三角褐指藻脂质含量及相关基因表达的影响
朱文娜 龚一富 郭芮栋 杨 雨 蔡嘉硕 王何瑜 汪 如
(宁波大学海洋学院1,宁波 315832)(宁波大学食品与药学学院2,宁波 315832)
微藻是一类结构简单、生长迅速的单细胞光合自养藻类。它们可以通过固定大气中CO2在全球生态系统中扮演着重要角色[1]。由于微藻内含有维生素、氨基酸和某些次生代谢产物,使其在医药、食品、化妆品行业大受青睐[2,3,4]。近年来,化石燃料的日益减少和人类环保意识的加强,人们开始紧急地寻找可替代化石燃料的新能源。微藻被认为是替代化石燃料的理想来源。微藻油脂中的甘油三酯可用于不同的生物燃料的生产,包括生物柴油、生物合成气、生物油和生物氢[5]。微藻中的不饱和脂肪酸具有调节人体生理健康的多种功能,如改善炎症水平、促进大脑和视力发育、缓解代谢类疾病、预防心脏类疾病和抗氧化作用等[6],所以如何高效生产微藻油脂受到人们越来越多的关注。
磷是生物体必需的大量元素之一,能够用于合成DNA、ATP、磷脂等生命活动所必需的重要细胞物质,并参与众多的新陈代谢反应[7]。磷元素还是植物生长发育过程中不可或缺的一部分,在物质代谢、信号传导等方面承担重要角色[8]。Jiang等[9]研究发现磷元素可以缓解铝胁迫对柑橘(Citrusgrandis)幼苗的生长和光合抑制。还有大量的研究表示磷对脂质的影响较大。合适的磷酸盐浓度可显著提高紫菜(Porphyridiumpurpureum)的总脂肪酸(TFA)和花生四烯酸(ARA)的生物量,随着磷酸盐浓度的持续下降,UFA/TFA和ARA/EPA的比例也相应增加[10]。Canavate等[11]指出海洋浮游植物已经发展出一种多样化的机制,可以在磷的影响下重塑其脂质类别。Yu等[12]研究发现,磷的缺乏也促进了微藻生物量中脂肪酸(FA)的含量增加。
三角褐指藻(Phaeodactylumtricornutum)是一种重要的海洋微藻,是研究海洋微藻的模式物种。三角褐指藻生长迅速,能高度适应温度、盐度、光照强度和酸碱度。它可以在没有硅的情况下生存且是易于高密度培养的藻种[13]。三角褐指藻细胞内不饱和脂肪酸含量比较高,脂质存储量可以达到细胞干重的三分之一。脂肪酸合成主要的4步反应包括缩合、还原、脱水和还原。ACP转酰酶(FABD)、脂酰胺脱氢酶(DLD)、Δ12脂肪酸去饱和酶(FAD2)、烯酰-ACP还原酶(FABI)、Δ6脂肪酸去饱和酶(PTD12)和乙酰辅酶A羧化酶(ACC1)等都与脂质合成路径有关。目前,磷限制是否对三角褐指藻油脂合成及油脂合成的分子机理等方面的研究还鲜有报道,所以本实验研究了磷限制对三角褐指藻生长、脂质含量的影响,并分析脂质合成通路中关键基因的表达量,为在基因层面上更高效地提高微藻油脂含量提供理论支撑。
1 材料与方法
1.1 藻类的培养
本实验所用的藻种来源于宁波大学植物资源开发重点实验室。将藻液和f/2培养基按1∶3的比例接种培养。培养光照强度5 000 lx,光照与黑暗时间各为12 h,温度20 ℃,pH为7.5,培养周期8 d。每天定时摇藻3次,防止藻细胞下沉。
1.2 磷浓度设置
本实验所用的是f/2培养基培养三角褐指藻。以硝酸钠和磷酸二氢钠作为氮源和磷源。保持氮浓度不变,设置磷浓度限制分别为0、16、32、48、64 μmol/L,以64 μmol/L为对照组,剩下4组为实验组,每个处理组设3个平行。
1.3 三角褐指藻生长曲线的测定
磷限制处理实验开始后每隔24 h取三角褐指藻藻液3 mL用UV-5200型紫外可见分光光度计测其在680 nm处的OD值并根据标准曲线回归公式y=977.73x-12.311(R2= 0.999)[14]换算成细胞数,其中y为细胞密度(104/mL),x为吸光值。计算并绘制磷处理后的三角褐指藻生长曲线。
1.4 三角褐指藻总脂含量的测定
采用尼罗红染色法[15]测定总脂含量。取2.5 mL藻液加入26 μL二甲基亚砜(DMSO)于试管中,微波处理40 s后再加入78 μL尼罗红,混匀后50 ℃水浴染色5 min,用FLX800型荧光酶标仪测其在激发波长480 nm,发射波长580 nm处的荧光值,再经过计算得出总脂的相对含量。
1.5 三角褐指藻叶绿素a含量的测定
按照徐润洁等[16]方法测量并计算叶绿素a含量:叶绿素a(μg/L)=13.95×A665-6.88×A649
1.6 荧光定量PCR检测基因表达水平
取50 mL的藻液放入冷冻离心机中,4 ℃,6 500 r/min离心10 min,结束后弃藻液,留下的藻泥按照试剂盒(Plant RNAKit,OMEGA)提取总RNA。用Takara PrimeScript RT Reagent kit(Prefectory Realtime)试剂盒对总RNA进行反转录,并作为实时荧光定量PCR反应(RT-QPCR)检测的模板。在NCBI上找到与三角褐指藻脂质合成相关的基因,采用primer premier 6.0 软件设计上下游引物,引物设计好后由上海生工公司合成,用于RT-QPCR的基因信息见表1。用actin基因作为内参基因[17]。RT-QPCR反应体系为:SYBR Mix 10 μL,引物各0.5 μL,模板cDNA 1 μL,ddH2O 8 μL。总体系为20 μL。QPCR的反应条件:预变性,95 ℃,30 s。40个循坏反应(延伸95 ℃,10 s。退火60 ℃,30 s。),72 ℃,10 min。

表1 用于RT-QPCR的基因信息
1.7 数据处理
根据2-ΔΔCt方法对定量数据进行分析,利用 SPSS 23.0 软件对实验数据进行显著性分析、相关性分析和主成分分析,P<0.05为显著性(用*表示),P<0.01为极显著性(用**表示)。
2 结果与分析
2.1 磷限制对三角褐指藻细胞生长的影响
研究磷限制对三角褐指藻细胞生长的影响,磷限制对三角褐指藻细胞生长和细胞密度的影响如图1所示,结果表明(图1a),三角褐指藻细胞生长曲线呈S型生长,第1~5天是对数生长期,第5~7天是平台期,第7天后藻细胞进入衰亡期。比较不同磷限制处理下在第7天时藻细胞的密度,结果表明(图1b),随着磷限制程度的加强,藻细胞密度逐渐减少。当磷浓度为0 μmol/L时,藻细胞衰亡最快,藻细胞密度比对照组下降了21%。说明磷限制明显地抑制了三角褐指藻的生长。

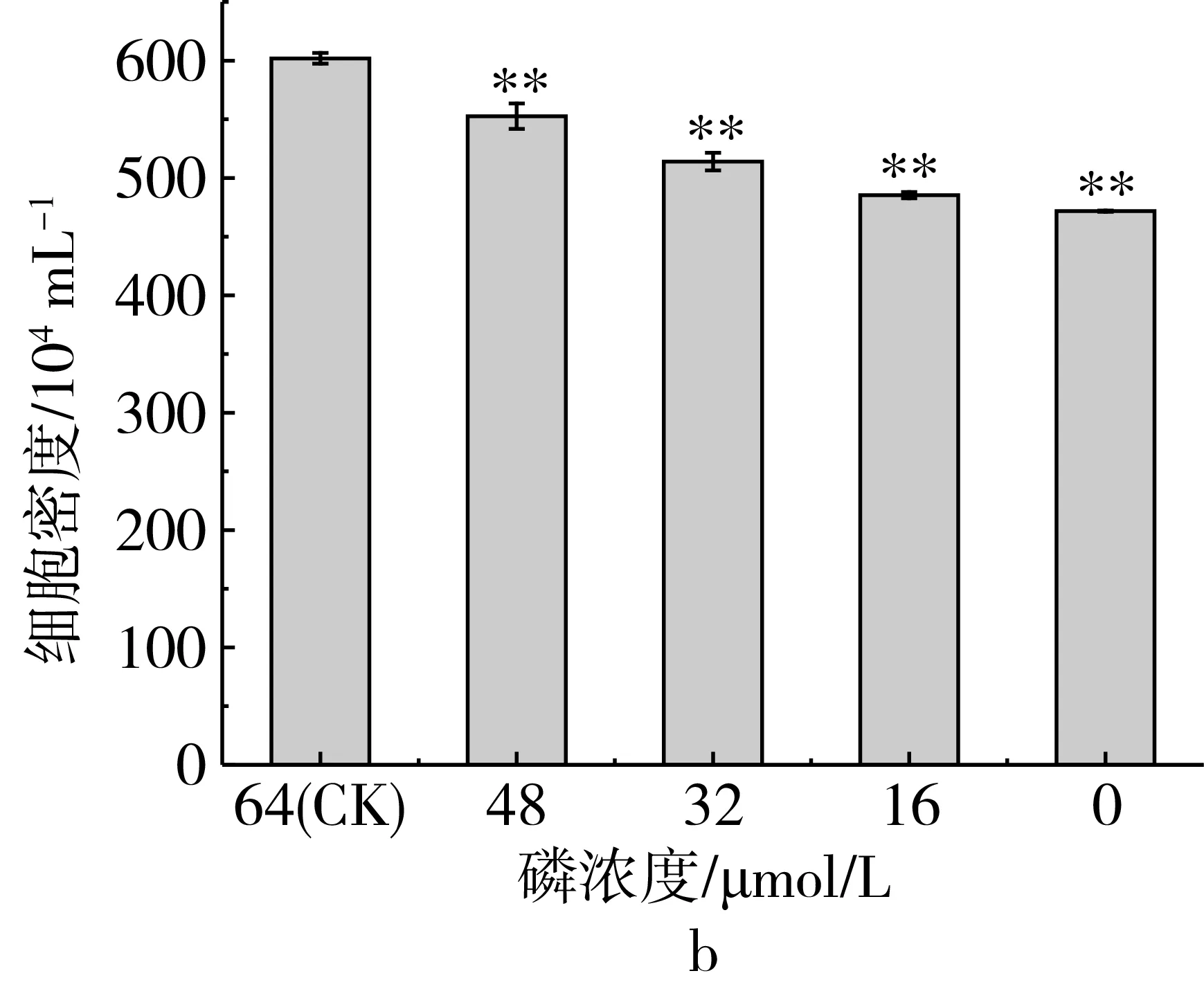
图1 磷限制对三角褐指藻细胞生长(a)和细胞密度(b)的影响
2.2 磷限制对三角褐指藻细胞总脂含量的影响
研究磷限制对三角褐指藻细胞总脂含量的影响,磷限制对三角褐指藻总脂和叶绿素a含量的影响如图2所示,随着磷限制程度的加强,总脂含量呈逐渐上升的趋势。当磷浓度为0 μmol/L时,其总脂含量均极显著高于对照组。总脂含量分别比对照组提高了48.8%(第5天)和61.64%(第7天),说明磷限制可显著提高总脂含量。

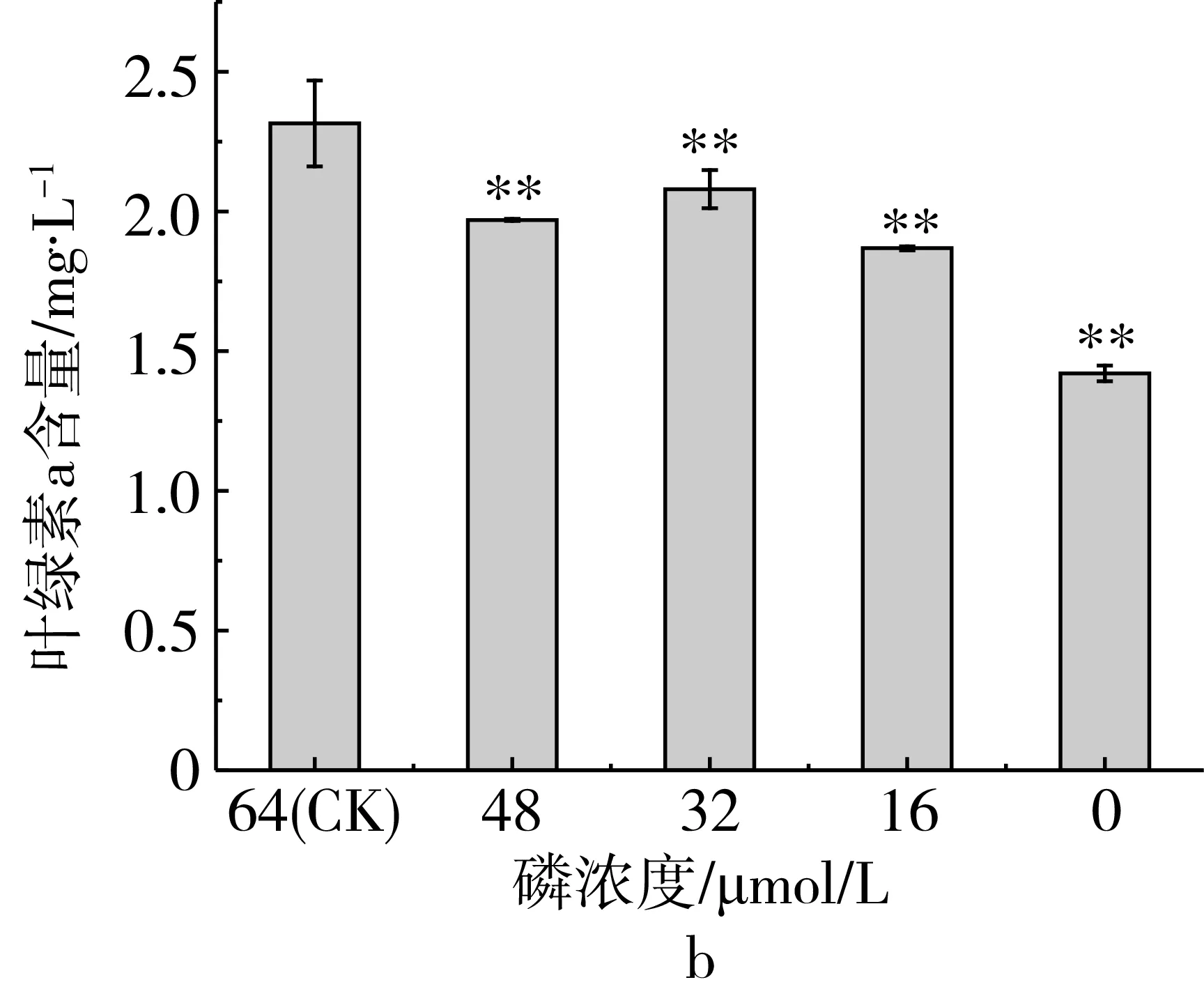
图2 磷限制对三角褐指藻总脂和叶绿素a含量的影响
2.3 磷限制对三角褐指藻细胞叶绿素a含量的影响
研究磷限制对三角褐指藻细胞叶绿素a含量的影响,结果表明(图2b),随着磷限制程度的增加,叶绿素a含量整体呈下降趋势。实验组叶绿素a含量跟对照组相比均极显著降低。当磷浓度为0 μmol/L时,叶绿素a含量比对照组下降了60.8%。表明磷限制抑制了叶绿素a的合成。利用Pearson相关分析磷限制下三角褐指藻总脂与叶绿素a含量的关系,结果表明,总脂含量和叶绿素a含量之间存在显著的负相关,Pearson相关系数为-0.949。
2.4 磷限制对三角褐指藻脂质合成相关基因表达的影响及主成分分析
用RT-QPCR技术对脂质合成相关基因表达进行定量分析,磷限制对三角褐指藻油脂合成基因表达的影响,结果表明,当磷浓度为0 μmol/L时,FABD、DLD、FAD2、FABI、PTD12和ACC1等6个基因的表达量都极显著上调,这与总脂含量变化一致。当磷浓度为16 μmol/L时,FABD、DLD、FAD2、FABI、ACC1 等5个基因的表达量都极显著上调。当磷浓度为32 μmol/L时,FABD、DLD、ACC1等3个基因的表达量都极显著上调。当磷浓度为48 μmol/L时,ACC1基因的表达量极显著上调。说明脂质合成基因对不同程度的磷限制有偏好性。
磷限制对三角褐指藻中脂质合成相关基因对脂质合成的累计贡献率见表2。与脂质合成有关的6个基因,其表达量对脂质合成的贡献率不一。前3个主成分因子对脂质合成的达89.916%。由主成分载荷矩阵可知,载荷矩阵见表3,前3个主成分主要以DLD、FAD2和ACC1基因为主,说明DLD、FAD2和ACC1 等3个基因是油脂合成的主要贡献因子。
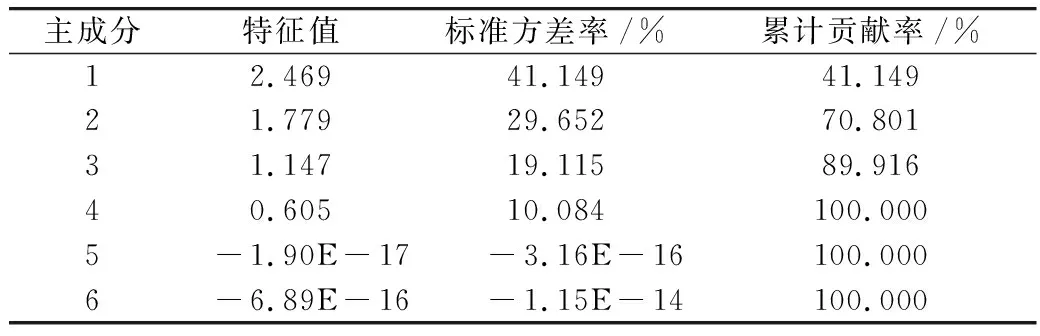
表2 磷限制对三角褐指藻中脂质合成相关基因对脂质合成的累计贡献率
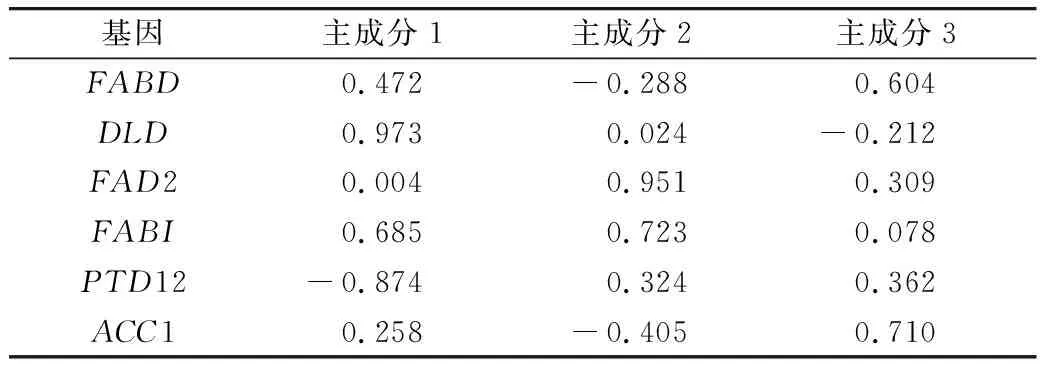
表3 载荷矩阵
3 讨论
磷是仅次于氮元素的植物第二大限制元素,磷可调节微藻的细胞生长。不同种类藻对磷的敏感度不同。若夫小球藻(Chlorellazofingiensis)培养过程中磷质量浓度为7.0~14.0 mg/L时藻细胞生长最好[18]。Wang等[19]研究表明,当氮浓度为24~72 mg/L、磷浓度为4.5~13.5 mg/L时,莱茵衣藻(Chlamydomonasreinhardtii)的最终生物量和蛋白质含量达最大值,叶绿体、线粒体等细胞器显示出良好的结构。但在高氮和低磷情况下,细胞器结构会受到破坏。李小梅等[20]研究表明,强烈的磷限制会抑制三角褐指藻细胞的生长速率,这与本研究结果相一致。可能因为磷元素缺少,细胞会自发减少生长和代谢速率,从而充分利用细胞内有效资源[21]。
有研究表明,低磷胁迫可促进微藻脂质积累。Liang等[22]研究表明,低磷使小球藻(Chlorellavulgaris)脂质含量和脂质生产率达到最大值。但也有一些研究发现,微藻在低磷胁迫下脂质含量会减少,如微绿球藻(Nannochloropsisoculata)和绿色鞭毛藻(Greenflagellates)在磷限制下脂质的含量降低[23]。本实验结果表明,磷限制可促进三角褐指藻脂质的积累,这与Yang 等[24]的实验结论一致。究其原因,这可能与植物的适应性机制有关。植物长时间在低磷或缺磷环境中生存,会进化一套适应机制,如能量代谢的变化、生物合成的变化、磷酸盐转运蛋白表达水平的变化等[25]。三角褐指藻在低磷和缺磷环境下,后期细胞可能会利用碳水化合物和蛋白质转化为脂质[24]。中性脂质被确定为微藻中碳储存的主要形式,所以细胞生长后期总脂含量增长较快。
磷对细胞生命活动有重要的作用,一般与细胞的能量转换、呼吸作用、光合作用和某些分子生物合成有关。磷是合成ATP和叶绿素的重要元素。磷的缺乏会使光合作用受到抑制,叶绿素a是光合作用的光合色素之一。添加磷元素可提高浒苔(Ulvaprolifera)藻体和考来木(Correacarmen)叶片叶绿素a含量[26,27],而磷限制使叶绿素含量降低[20]。本研究也表明磷限制可显著抑制叶绿素a的合成,且随着磷限制程度的加强,叶绿素a含量逐渐降低,而总脂的含量却逐渐增加,叶绿素a和脂质合成存在负相关关系。
油脂的积累与脂质合成相关基因的表达有关。刘鹏[28]研究表明ACCD基因的上调会促进微藻脂质合成。陈若莹等[29]发现氮限制条件下,油脂积累量和FAB2基因成正相关关系。Lung等[30]指出DGAT基因是甘油三酯(TAG)合成的关键基因。王振瑶[31]发现在氮限制条件下,胶球藻(Coccomyxasubellipsoidea)中甘油三酯合成相关基因ACCA、ACCB、ACCC和FABD的表达量上调。本研究结果也表明,磷限制下三角褐指藻ACC1、FABD基因表达上调。DLD基因编码的脂酰胺脱氢酶催化用于从头合成脂肪酸的乙酰辅酶a和NAPH的产生,为油脂合成提供原料和能量。本研究结果表明,在磷限制条件下,DLD基因是油脂合成的主要贡献因子,说明油脂合成和碳代谢联系紧密。这和之前推测磷限制条件下,油脂含量的增加与碳水化合物代谢和蛋白质分解有关的结论一致。FAD2 基因参与不饱和脂肪酸的合成,FAD2基因诱变可增加食用花生油油酸含量[32],说明FAD2基因是油脂合成的关键基因之一。与本研究主成分分析结果一致。在磷限制条件下,DLD、FAD2和ACC1是油脂合成的主要贡献因子,其中DLD基因对油脂合成的贡献率最大,这为进一步通过细胞培养和基因工程策略提高三角褐指藻油脂含量和探究油脂合成分子机理提供了目标基因。
4 结论
本研究结果表明,磷限制虽然极显著地抑制了三角褐指藻细胞生长和叶绿素a含量,但却极显著地促进了油脂的积累,油脂含量与叶绿素含量呈显著的负相关关系。油脂含量与脂质合成相关基因的表达水平有关,主成分分析表明,DLD、FAD2和ACC1是油脂合成的主要贡献因子,其中DLD基因对油脂合成的贡献率最大。

