远程缺血处理的应用及内源性保护机制的研究进展*
王 军, 朱启姜, 吕双瑜, 张 磊, 王红钢△
(河南大学1基础医学院人体解剖学教研室,2分子医学研究所,32018级临床学院,河南开封475004)
缺血处理(ischemic conditioning)是一种能够对重要器官/组织缺血损伤发挥保护作用的非药物干预措施,主要包括缺血预处理和后处理等,早在1986年被Murry等[1]首次发现。后来发展为远离重要目标器官/组织,间歇阻断远处相对比较耐受缺血的器官(如肢体等)的血供,进行缺血干预调节,被称为远程缺血处理(remote ischemic conditioning,RIC)。随着研究的深入,RIC的概念不断被扩展。目前RIC主要指当身体重要器官(心脏、脑、肾脏等)发生严重缺血/缺氧前后,对肢体血供实施间歇阻断及再通的调节,从而诱发出机体内源性保护机制,发挥对重要器官的缺血保护作用。这个过程主要包括3个方面:(1)RIC引起肢体缺血触发产生的各种因子,包括腺苷、谷氨酸、蛋白、外泌体等;(2)肢体缺血诱发的保护因子与重要器官缺血损伤之间的媒介和桥梁,包括靶细胞及受体;(3)RIC引起的对重要靶器官缺血损伤的终末保护效应,主要包括器官或细胞内的信号机制。因为RIC在实施过程中具有易于操作、安全、耐受好、无创伤、费用低等特点,所以关于RIC研究的应用范围也逐渐在扩展,尤其是临床转化试验也越来越多,使得RIC的关注度也不断增高。本文的主要目的是总结RIC的应用研究,包括基础研究和临床试验,揭示RIC的潜在应用价值;总结近年来RIC内源性保护机制的研究进展,为今后RIC的研究和应用提供参考。
1 缺血处理的概述
早在1986年Murry等[1]首次报道了缺血预处理对急性心梗保护的实验。该实验是在阻断冠状动脉回旋支之前的40 min,先对回旋支进行间歇短暂缺血再灌注处理(5 min阻断+5 min再灌注,重复4个循环),可显著降低心梗模型造成的心肌梗死体积。后来,研究者发现对急性脑缺血进行原位缺血处理,也可以减小脑梗体积,减轻脑水肿和炎症反应,减少细胞凋亡和氧化应激,从而产生保护效应。虽然原位缺血处理能够产生对靶器官的保护作用,但属于侵入性的操作,有一定的安全风险,很难适用于一般患者或支架植入/血管成形手术中,为此研究者提出了RIC。RIC常选择在双侧肢体作为远离重要脏器/组织的最佳部位,因为肢体对缺血处理有很好的耐受性,并且安全、易于操作,所以远程肢体缺血处理(re⁃mote limb ischemic conditioning,RLIC)就广泛应用在基础研究和临床试验之中。在过去的二十年,大量实验已表明RIC对心脏缺血损伤具有很好的拮抗作用。这种效应除了通过肢体缺血诱发产生外,也有通过肾脏、小肠和肝脏等器官的缺血来实现。在实验性脑梗动物模型中,RIC可以有效减小梗死灶体积,改善神经学功能评分;RIC用于脑梗患者的临床试验也取得了令人鼓舞的结果。除了心脏和脑以外,RIC还对肾脏、肝脏、肺脏、小肠、皮肤等器官的缺血损伤具有保护作用。RIC还可以提高运动员的中长跑运动成绩,在医疗、康复、健身等领域都具有潜在应用价值。
2 RIC的潜在应用
近年来,对RIC的应用研究越来越广泛,而且内容更新也比较快。本文着重从临床试验结合动物研究对近年关于RIC的应用进行综述。
2.1 脑 在急性脑缺血动物模型中,已有大量实验结果表明,RIC能减少脑梗死灶的体积,减轻脑组织水肿,改善神经功能评分,起到较好的神经保护作用[2-5]。临床随机对照试验也表明,RIC作为急性脑梗的辅助治疗是安全有效的,并且能够降低再次脑梗风险,促进神经功能恢复,尤其是在急诊入院前阶段实施RIC可以起到很好的神经保护作用[6-8]。目前,大规模临床随机试验方案已在欧洲提出并进行实施,目的是评估急性缺血性脑卒中患者实施RIPC后的神经保护作用,判断其是否能减小梗死面积,促进长期预后恢复。该临床试验在荷兰注册,到2020年完成招募[6]。
随着年龄增长,缺乏运动、经常熬夜、高脂饮食等不良行为的存在都会促进血管狭窄并引起慢性脑供血不足。由于脑供血不足症状不典型常被忽略,目前尚无特效治疗药物。而RIC可以改善脑血流量,降低急性脑缺血事件的发生,并促进脑认知功能。临床试验证明,RIC应用于慢性脑供血不足是安全、耐受良好的。RIC应用于蛛网膜下腔出血、颈内动脉内膜切除/支架术、创伤性脑损伤和脑小血管病(cerebral small-vessel disease,CSVD;包括腔隙性脑梗、脑白质疏松、脑内微小出血、血管周间隙增大等)均表现出较好的耐受性和安全性,并且收到了较好的效果[9]。关于脑出血的最新一项概念验证随机对照临床试验中,脑出血24~48 h内的病人,除接受按照指南的正常治疗外,干预组每天接受一次RIC,连续7 d。首要观察RIC的安全性,其次是血肿和血肿周围水肿体积变化、神经功能评分、副作用等。结果表明RIC用于脑出血病人是安全、可行的,并且具有初步疗效[10]。
2.2 心脏 Thielmann等[11]报道了冠状动脉旁路移植(搭桥)手术(coronary artery bypassgrafting,CABG)单中心随机对照临床试验中使用RIC的效果:手术前对右侧上肢进行5 min缺血+5 min再灌注连续3个循环的预处理,在术后6~48 h血清troponin T浓度(心肌损伤早期诊断和疗效检测的重要指标)与非RIC组相比显著降低,提示围手术期RIC干预可以对心脏起到一定的保护作用,并且能够显著改善CABG的预后情况。但后来的大规模多中心临床试验并没有得出一致的结论,考虑到不同的基础疾病、麻醉剂及体外循环等混杂因素使得RIC的作用机制变得更加复杂,RIC的心脏保护作用仍有待进一步研究[12]。对于经皮冠状动脉介入手术(percutaneous coronary intervention,PCI)、慢性缺血性心脏病和ST段抬高急性心梗,远程缺血预处理(remote ischemic precon⁃ditioning,RIPreC)或后处理(remote ischemic postcon⁃ditioning,RIPostC)都可以使心肌得到较好保护并减少并发症[13-14]。但也有少数阴性研究结果,认为RIC不能减少冠状动脉支架围手术期发生心肌损伤的概率。RIC的使用时机、频率,以及并存病、麻醉剂等都可能是影响多中心临床试验的因素。对于临床试验结果的不一致,有分析认为体外循环、低体温及心脏停搏技术本身就有心脏保护作用,因此更进一步的心脏保护或许本身就不可能;另外,一些麻醉药如丙泊酚及吗啡的使用可能消除了RIC的心脏保护效应。
2.3 肾脏 关于活体捐献肾脏移植的随机对照临床试验表明,在手术麻醉前给予RIPreC,能够长期提高存活肾的肾小球滤过率(3月~5年)[15];与之相反,死者供体肾移植试验中没有得出关于RIC干预的显著有益效果[16]。急性肾损伤是急危重病人常见并发症,感染、大手术和肾毒性药物是其最常见原因。RIC与急性肾损伤之间的研究积累了不少结果,均表明RIC是安全、可操作的并易于接受的。但是,因为RIC的剂量、程度和观测指标的不同,目前尚不能得出RIC对急性肾损伤比较一致的结论。在CABG和PCI中,RIC能够显著降低PCI术后急性肾功能障碍的发生率,对CABG没有显著影响。RIC对于造影剂肾病的干预近年来研究较多,有望成为肾脏保护的新选择[17]。总之,RIC在肾脏保护中的应用还需要进一步的探讨,以得出稳定的干预效果。
2.4 肺脏 早期有不少实验已表明RIC可以减轻动物肺脏急性缺血损伤程度。2014年,Li等[18]在一项随机对照临床试验中发现,单侧肺叶切除术前对一侧上肢实施RIC(5 min阻断+5 min再灌注,3个循环),结果术后氧合指数(PaO2/FiO2)、氧化应激和炎症因子(IL-6和TNF-α)水平、院内并发症、术后住院天数均优于对照组。新近也有研究表明RIPreC对肺叶切除术患者具有肺保护作用[19]。Garcia等[20]在一项非小细胞肺癌手术肺叶切除术中,使用了RIPreC,得出了类似的术后结果。最新一项超过千人的meta分析表明,RIPreC用于单侧肺通气的胸科手术时,可以减少病人ICU和肺机械通气时间,减轻肺部的炎症反应,改善肺损伤病人的临床预后[21]。
2.5 肝脏 早期一些动物实验表明,RIPreC可以减轻肝脏缺血再灌注损伤。近年,小规模肝脏移植随机对照临床试验表明RIC是安全的,并且易于接受和操作,但从中没有得到预期显著有益的近期效果,因此RIC的处理方式或者长期结果还需进一步的研究。一项关于结肠癌肝转移手术切除的小规模临床研究表明,RIC干预组术后丙氨酸氨基转移酶(ala⁃nine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平显著低于对照组,并且有较好的吲哚氰绿(indocyanine green,ICG;一种用于检测肝脏排泄能力的染料)清除率[22]。随后一项类似的临床研究表明原位缺血预处理和RIPreC在肝脏部分切除术中的应用均具有护肝作用,其观测指标主要有血清转氨酶、胆红素、白蛋白等[23]。这些研究结果说明,RIC可以安全用于肝脏手术中,并且能够为患者带来较好的护肝效应。
2.6 肠 动物实验表明,RIC可以减轻小肠缺血再灌注损伤,通过抑制自由基和炎症因子保护肠黏膜,降低小肠渗透性[24]。体外细胞模型实验也揭示了,RIPreC的培养液可以减轻人小肠细胞缺氧/复氧损伤[25]。一项关于腹主动脉瘤修补术的随机对照试验表明,RIC可以降低小肠损伤标志物(肠脂肪酸结合蛋白、内毒素和二胺氧化酶)水平及肠道损伤严重程度评分[26]。
2.7 脊髓 手术中钳夹胸腹主动脉会引起脊髓缺血,严重时会导致肢体瘫痪。研究表明,通过脊髓原位缺血预处理可以,提高脊髓的抗损伤能力。近年来,又观察到RIC对缺血损伤的脊髓同样具有保护效应,包括RIPreC和RIPostC。RIC可以提高脊髓缺血损伤后的神经功能评分,降低脊髓组织细胞凋亡比例和水肿程度[27]。
2.8 视网膜 线栓法通过大脑中动脉阻塞翼腭动脉引起视网膜缺血再灌注损伤后,给予RIC干预,可以减少神经节细胞的死亡,上调抗氧化应激蛋白表达水平,发挥视网膜神经保护作用[28]。同样,小鼠视神经横断损伤后,RIC也可以发挥视网膜保护作用[29]。在腹腔注射链脲佐菌素诱导的大鼠糖尿病模型中,RIC 12周可以通过抗炎、抗氧化作用,减少神经节细胞死亡[30]。新近一项临床试验发现,RIC作用于正常人时,可以影响视网膜周围动脉直径及回缩,这种反应在20~30年的I型糖尿病患者视网膜中减弱或者消失,提示如果在糖尿病早期,应用RIC可能会通过影响小动脉的生理反应而发挥保护效应[31]。
2.9 皮肤 缺血和皮瓣坏死是整形外科最担心的并发症之一,研究者渴望探寻有效改善皮肤微循环的辅助办法。随机对照试验表明,作用于上肢的RIC可以更好的促进皮肤血液循环[32]。实施RIC使肢体缺血10 min,对微循环促进的效果优于较短时间的缺血刺激[33]。为了探索能更好改善皮肤微循环的方法,Rothenberger等[34]对比了应用辣椒素(capsaicin,CAP)、远程CAP(remote CAP)、RIC和RIC+CAP几种实施策略,结果表明CAP和RIC都显著增加了皮肤的血液灌注,CAP叠加RIC并没有呈现更好的效果。这为RIC作为提高移植组织存活率的辅助办法提供了新的依据。
2.10 运动训练及康复 研究表明,自行车选手在腿部进行间歇缺血处理可以提高最大摄氧量、运动能力、游泳时间和跑步成绩[35]。中长跑竞技运动员进行RIPreC可以通过增加累积氧债、提高糖酵解能力来提高运动能力[36]。另外,利用对肢体进行缺血阻滞来进行抗阻力量训练或者有氧耐力训练可以起到模拟RIC的效果,能够通过改善交感神经张力和肌肉代谢来提高/保持运动能力并促进疲劳恢复[36-38]。
运动学习是躯体康复的一个重要元素。以往研究表明,RIC可以促进年轻健康成年人的平衡运动任务学习能力,对认知任务学习没有影响[39]。RIC对中老年人的平衡运动学习有一定的促进作用,但随着年龄增长,累积的并存病可能会影响RIC的效能[40]。在血管性痴呆的人群中,6个月的RIC干预可以促进患者认知功能学习,包括视觉空间、执行功能和注意力的提高[41-42]。
3 RIC的内源性保护机制
RIC的内源性保护模式可以概括为“诱导因素——介导通路——靶位点”模式。虽然对RIC已经有了广泛的研究,但到目前为止,RIC的具体保护机制仍然不十分清楚。目前,主要有神经学说和体液学说两方面:神经学说认为机体存在一个神经反射通路发挥RIC对靶器官的调节作用;体液学说是指RIC实施过程中,对终末动脉进行反复的缺血再灌注刺激会诱导机体产生一些内源性的保护因子释放入血液循环,如腺苷、一氧化氮(nitric oxide,NO)、谷氨酸、囊泡物质等,它们可以在相应受体水平发挥调节作用。关于对终末靶器官内的细胞机制和信号通路已有了广泛的研究。本文拟对RIC诱导产生的上游保护因素进行探讨和综述。
3.1 RIC保护效应的神经调节 在心肌缺血再灌注模型中,当切断下肢神经支配后,在该肢体实施RIPreC,则原有的心肌保护效应随之消失。同样,用传入神经阻断剂辣椒素预处理阻断传入纤维后,RIC对心肌、大脑、胃和小肠的保护效应也被抑制[9];用辣椒素局部注射兴奋C类纤维可以模拟出RIC的保护效应,说明在RIC实施过程中,传入神经发挥了重要作用。进一步研究表明,RIC引起降钙素基因相关肽(calcitonin gene-related peptide,CGRP)从传入神经向循环系统释放,从而发挥心肌保护作用[43]。在脊髓T7~T10水平离断脊髓,或者椎管注射阿片受体阻断剂都可以抑制RIC引起的心肌保护作用,这说明了神经传入单元在RIC过程中发挥的作用[8]。Ba⁃salay等[43]发现,双侧切断迷走神经可以消除RIC引起的心脏保护效应;Mastitskaya等[44]抑制脑干迷走神经背核同样可以消除RIC引起心脏保护效应,进一步说明迷走神经的传出效应在RIC介导的保护效应中的作用。相反,刺激迷走神经也可以得出与RIC相一致的效果,起到心、脑保护效应[9]。“传入神经——中枢——传出神经”构成的“远程预处理反射”在RIC的缺血器官保护现象中起到了重要作用。但关于RIC在大脑的神经保护机制仍不十分清楚,未来的深入研究将有助于更好地利用RIC,还能更好地揭示出RIC对多器官的保护机制,尤其是对心脏的保护机制。
3.2 RIC保护效应的体液调节 当在远离缺血器官的部位(如肢体)实施缺血刺激,会通过向循环系统释放特定体液介质,进入到缺血器官发挥保护功能。最初研究者通过血液置换的方式尝试验证该假设,结果可使猪的心肌梗死体积缩减57%,甚至在去神经支配的移植心脏也能受到这种介质的保护。Basa⁃lay等[43]证实了对健康受试者实施RIC后,人血浆透析液可以减小兔离体心脏的梗死体积并促进血流动力学恢复,进一步说明神经、体液因素的共同参与作用。这些研究都表明RIC产生的体液介质可能是某一种特定物质或者多种保护因子。虽然有不少蛋白质组学研究从RIC后人或者动物的血浆中分析这些物质,但结果参差不齐,目前还难以形成一致的结论。以下是对一些常见体液介质的研究总结。
3.2.1 热休克蛋白(heat shock protein,HSP) 一项临床试验表明,与对照组相比,RIC干预后血清总HSP27和磷酸化HSP27显著升高,可以持续4 d[45]。而RIC对血浆HSP60、HSP70、HSP90、C反应蛋白、S100-b、基质金属蛋白酶9、troponin T和内源性大麻素含量没有显著影响[6]。HSP27是小分子HSP家族的重要成员,在外界刺激如缺血情况下产生,能够起到抗炎、抗缺血损伤的作用。在实验性脑梗及心梗模型中HSP27及磷酸化HSP27具有较好的神经和心肌保护效应[45]。因此可以推测RIC诱导出的HSP27可能会通过循环系统发挥远距离的缺血器官保护作用。另外,在大鼠离体心脏灌注试验中,Kim等[46]检测到RIPreC产生的保护性体液调节因子为4~12 kD的疏水肽,用质谱分析法进一步检出HSP10也可能是减轻心肌缺血再灌损伤的候选蛋白。
3.2.2 细胞外囊泡 胞外囊泡裹有脂质双层外衣,能被多种类型的细胞分泌并释放进入血液循环及各种体液中。依据直径大小,胞外囊泡可分为3个类型:直径30~100 nm的外泌体(exosomes)、直径100~1 000 nm的细胞微泡(microvesicles)和直径>1 000 nm的凋亡小体(apoptotic bodies)。一般凋亡小体不被认为是体液调节因子(不能发挥远距离细胞间交流)。而外泌体和细胞微泡被细胞分泌、释放出来后,可以通过旁分泌或内分泌作用发挥体液调节作用。体外研究表明,人脐静脉内皮细胞通过缺氧/复氧模拟RIPostC,释放出的外泌体借助内含的miR-199a-5p通过抑制内质网应激和抗凋亡发挥缺氧神经元保护效应[47]。关于RIC产生的胞外囊泡在心血管保护方面的研究越来越多[48],对缺血损伤的肾脏和脑的保护作用也有一些报道。由RIC引发的具有缺血心肌保护效应的外泌体miRNA有miRNA-21、miRNA-22、miRNA-24、miRNA-29a等[49]。
3.2.3 腺苷 腺苷是细胞内ATP降解过程中的中间产物,广泛存在于机体各细胞。作为内源性的嘌呤核苷酸,腺苷可以抑制胶原酶基因表达,阻断白细胞表面L-选择素和整合素介导的血管黏附作用,降低组胺和缓激肽诱发的微血管通透性增加,具有抗炎和抗氧化作用。在应对代谢应激(如缺血)时,腺苷作为内源性活性物质能够被大量释放进入循环系统。研究者在肾脏缺血预处理过程中检测到颈动脉腺苷浓度急剧升高,在随后的心脏缺血保护中发挥了重要作用。也有研究者认为缺血预处理引起的血液腺苷浓度升高是通过激活传入神经而引发心肌保护效应的。随后研究表明,肠系膜动脉阻断和下肢缺血都可以通过腺苷发挥心脏缺血保护作用。近年来研究表明,RIC引起血液中浓度升高的腺苷来自内皮细胞或调节性T细胞。内皮细胞在缺氧时可以释放大量因子,其中包括腺苷。组织缺氧和酸性环境持续存在的情况又可以激活内皮细胞以外的其它细胞,释放更多的腺苷进入血液中。但RIC处理后,腺苷确切来源于哪种组织或者细胞目前尚不十分清楚,有待深入研究。关于腺苷在RIPreC和RIPostC发挥的远距离保护效应及机制可以参考Randhawa等[50]和Singh等[51]的综述。由于RIC的机制还不清楚,尤其高龄老人、基础疾病或者常用药物等都可能成为干扰因素。最近,Ng等[52]做了一项临床测试,募集了23岁左右健康青年人,测试了RIC(上肢5 min阻断+5 min开放,共4个循环)前后血液指标的变化,经ELISA和高效液相层析法检测,结果表明RIC后血液腺苷和亚硝酸盐(nitrite)水平显著升高,并且不受性别、腰臀比、身体质量指数、血压等因素的影响,进一步说明了腺苷可能作为一种体液调节媒介在RIC中发挥作用。
3.2.4 NO/nitrite NO作为一种新型气体信号分子,广泛存在于机体各组织中,有脂溶特性,可以不需要任何介质快速扩散通过生物膜。在血管内皮产生的NO可以很快进入平滑肌细胞,使平滑肌松弛,血管扩张。同时NO也会渗透扩散进入血液,有防止血栓和动脉粥样硬化的作用。由于NO半衰期短,很快被氧化形成nitrite,可以较稳定的在血液中传输,因此血浆nitrite浓度可以用来反映NO水平。在缺氧缺血时,组织可以产生大量NO,形成的nitrite在多个器官中已被证明具有抗缺血再灌注损伤的作用,包括心、肝、肾、脑等[53]。多个研究表明在RIC过程中,循环血液中nitrite浓度升高,并且能发挥器官保护效应[53-54]。但最近一项人体随机对照交叉试验研究表明,RIC并不能引起血浆nitrite水平的升高,反而还会降低缺血再灌注后nitrite的浓度[53]。这又增加了RIC与nitrite之间关系的复杂性。
3.2.5 谷氨酸(glutamate,Glu) 在中枢神经系统内,Glu是一种重要的兴奋性神经递质,生理状态下,细胞外维持较低浓度,当组织缺血损伤时可在细胞外大量聚集,作用于NMDA受体,产生神经毒作用。在外周组织中,缺血再灌注也会引起Glu释放并进入循环血液中。导致外周血Glu浓度升高的详细机制目前还不十分清楚,除了缺血组织释放外,血细胞如中性粒细胞和T细胞在缺氧时也会被激活释放Glu。RIPostC可以通过多种机制减少外周及中枢Glu水平,抑制中枢神经Glu毒性作用[55-56]。而RIPreC可以通过升高外周血Glu浓度,激活血管内皮细胞NMDA受体,产生NO和CO进入血液,发挥器官和神经保护作用[57-58]。关于Glu在中枢及外周的调节作用及RIC与Glu的关系仍有很多需要深入研究的问题。
关于RIC分类、机制和应用的总结见图1。
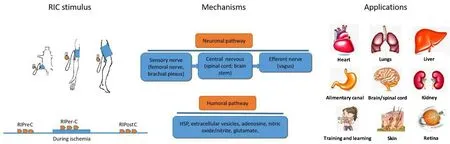
Figure 1.Diagram outline of remote ischemic conditioning(RIC).RIC can be carried out before,during and after the ischemia,called remote ischemic preconditioning(RIPreC),remote ischemic per-conditioning(RIPer-C)and remote ischemic post⁃conditioning(RIPostC),respectively.The possible mechanisms involved are mainly neural pathway and humoral pathway.Although accumulated researches mainly focused on the myocardial infarction and cerebral ischemia,the application of RIChas been extended in many fields,including the ischemia-reperfusion injury of multi-organs and exercise training.图1 远程缺血处理的分类、机制及应用
4 结语与展望
RIC从1986年首次提出后,到最近5~10年出现了大量的临床转化以及应用。作为一种新兴的治疗措施,RIC通过短暂、重复、不致死的缺血刺激,激发了内源性神经和体液调节机制,发挥对抗远距离易损器官的缺血损伤,起到对重要器官的保护效应。由于RIPreC、RIPostC等几种形式都能够起到相应器官保护作用,而RIC的最佳时间窗目前还没有定论,实际应用过程中以RIPreC和RIPostC比较多。两者涉及到的详细机制还不十分清楚。有研究表明,RIPreC主要依赖于远程缺血器官的传入神经和副交感神经,而RIPostC可能主要涉及体液调节因素。本文综述了近年来RIC在多种器官疾病中和不同领域的广泛应用,包括从基础实验研究到大小规模的临床试验。虽然大多数报道对RIC的应用价值和预期效果是肯定的,也有一些存在争议或者没有明显效果的结论,说明了RIC在实际应用中的复杂性及其机制的不确定性。
关于RIC的机制,本文主要介绍了神经学说和体液学说两种基本观点,不排除以此衍生出的其它机制。从RIC部位的传入神经单元经脊髓到脑干的迷走神经传出单元,构成了RIC神经反射通路的基础。切断该环路常常导致RIC失去原有效果。大脑皮层及内脏活动高级中枢的参与作用及机制目前还不十分清楚。关于体液学说,我们主要介绍了由RIC直接诱发产生并释放在循环血液中,经检测浓度明显升高的介质,并且这些介质经具有潜在的对缺血损伤器官的保护作用。还有一些没有介绍的介质,如内源性阿片肽、缓激肽、CGRP、细胞因子等,也有可能是RIC诱发的体液调节介质。
在实际应用研究中,由于并存病、年龄等混杂因素干扰,很难明确RIC的详细机制。因此,深入的细胞研究结合全身系统研究对明确RIC诱发的内源保护机制很有意义,也有助于向临床应用转化。另外,探讨RIC实施过程中的时间窗、间隔以及频率等参数的配置,可能使RIC发挥出最大作用。这些问题在今后的研究中需要进一步探讨。

