雷帕霉素通过激活LC3介导的细胞自噬改善ApoE4/5×FAD小鼠的认知功能*
崔晓丽, 魏 振, 沈 辉, 张 静, 戴晓曼, 张 健, 陈晓春, 曾育琦△
(1福建中医药大学附属人民医院老年病科暨干部病房,2福建省立医院神经内科,福建医科大学省立临床医学院,3福建医科大学附属协和医院干部病房,4福建医科大学附属协和医院福建省老年医学研究所,5福建医科大学附属协和医院神经内科,福建福州350001)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的以记忆障碍为主要表现的神经系统退行性疾病,β-淀粉样蛋白(amyloidβ-protein,Aβ)沉积和神经原纤维缠结(neurofibrolary tangles,NFTs)形成是其主要病理改变。AD的确切机制尚不清楚,目前缺乏有效的药物治疗手段。
细胞自噬对维持内环境稳态起重要作用,可降解并循环利用自身老化组分及功能异常的大分子物质,通过溶酶体水解酶降解长寿命蛋白和错误折叠蛋白,是神经元溶酶体降解途径所必需的。研究表明,自噬功能障碍参与了AD发病[1]。自噬在清除毒性或异常聚集蛋白(如Aβ和tau蛋白等)中起着至关重要的作用[2-4];抑制自噬可加重AD的病理损害[5],反之则减轻AD病理损害[6]。雷帕霉素(rapamycin,Rapa)是一种经典的自噬激动剂,通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)激活自噬,是自噬研究中最常用的药物。既往研究表明雷帕霉素可抑制mTOR、调节自噬相关通路后改善认知,延缓神经退行性疾病的进展[7-8]。
人类载脂蛋白E(apolipoprotein E,ApoE)主要有3种亚型:ApoE2、ApoE3和ApoE4,其中ApoE4是散发性AD最大的风险基因。ApoE4可上调脑内Aβ水平,促进淀粉样斑块沉积[9-11]。但ApoE与Aβ之间如何相互作用导致认知功能障碍以及ApoE4是否通过影响自噬作用参与AD的病理过程尚不明确。ApoE4增加AD患者脑内炎症和氧化应激,引起溶酶体膜脂质过氧化,导致溶酶体功能障碍[12]。在AD脑中,ApoE通过调节高密度脂蛋白胆固醇和胆固醇的代谢直接影响自噬体-溶酶体系统的激活[13],也可通过增加Aβ和磷酸化的tau水平诱导自噬。因此ApoE可能参与AD脑内自噬溶酶体的调节,但其潜在的机制却鲜为人知。同时表达5种家族性AD(fa⁃milial AD,FAD)突变基因(5×FAD)及人类ApoE亚型的小鼠(EFAD小鼠)为探索ApoE参与AD发病机制研究提供了很好的模型。本研究以EFAD小鼠为研究对象,观察ApoE3和ApoE4基因对其认知功能的影响及对自噬相关病理是否存在差异,进一步探讨雷帕霉素是否可通过增强自噬改善不同ApoE基因型EFAD小鼠的认知功能。
材料和方法
1 药物及试剂
雷帕霉素购自LCLaboratories;蛋白酶抑制剂购自Sigma;基因型鉴定DNA Ladder购自Fermentas;2×Go-Taq Green Master Mix购自Promega;hAPP695引物购自Sangon Biotech;BCA试剂盒购自Beyotime;鼠抗β-actin单克隆抗体、兔抗LC3B多克隆抗体购自Abcam;兔抗p-mTOR多克隆抗体和兔抗mTOR单克隆抗体购自Cell Signaling Technology;鼠单克隆抗体6E10购自Covance;Aβ1-42ELISA试剂盒购自Invitro⁃gen;BCA蛋白检测试剂盒购自Beyotime;生物素标记的抗鼠Ⅱ抗购自Vector。
2 动物及药物处理
所有实验都是根据福建医科大学动物护理和使用委员会协议的规则和规定进行的,并按照国际动物伦理使用指南进行。置换人ApoE3和ApoE4基因的C57/B6小鼠及5×FAD小鼠由Ladu教授(美国伊利诺伊大学芝加哥分校)赠送,在福建医科大学SPF级
实验动物中心建系、饲养、繁殖,许可证号为SYXK(闽)2008-0001。5×FAD小鼠转染了5个FAD突变基 因[APP K670N/M671L(Sweden)+I716V(Flori⁃da)+V717I(London)+PS1M146L+L286V)]。5×FAD小鼠与置换人ApoE3和ApoE4基因的小鼠杂交,经过基 因 型 鉴 定 后 筛 选 出ApoE3/5×FAD(E3FAD)和ApoE4/5×FAD(E4FAD)小鼠。将雷帕霉素溶解于二甲基亚砜中,配成200 g/L的储藏液,灌胃时稀释为75 mg/L。
3 主要方法
3.1 实验分组 将EFAD小鼠随机分为2组:溶媒对照组(vehicle组)和雷帕霉素治疗组(Rapa组),每组8只。6月龄时雷帕霉素(1 mg/kg)灌胃,每天1次,共6周。给药结束后检测行为学、收集标本。
3.2 水迷宫行为学检测 Morris水迷宫用于评价EFAD鼠的视空间学习记忆能力。隐藏平台实验包括连续6 d、每天4次尝试寻找隐藏平台的游泳训练。记录每次试验的逃避潜伏期。记忆保留实验(空间探索)是在最后一天的隐藏平台训练结束后24 h,将平台移出,记录小鼠60 s内游泳轨迹、穿越原平台的次数、平台所在象限停留时间百分比和距离平台的平均距离。
3.3 组织获取 行为学实验结束后,用10%水合氯醛(3 mL/kg)腹腔注射麻醉EFAD小鼠,右心室取血,冰上剥离脑组织,右侧大脑半球用4%多聚甲醛固定24 h,经脱水、快速冷冻后,−80℃保存至切片。左侧大脑半球分离出海马和皮层,一部分海马标本进行透射电镜观察,另一部分海马标本在液氮中快速冷冻,−80℃保存至组织裂解。
3.4 透视电镜观察 将上述用于电镜观察的海马组织CA1区切割成大小约1 mm×1 mm×1 mm的组织块,经脱水、两次固定、浸透、包埋、聚合等处理后切片,再经染色、水洗后,在透射电镜下观察拍照。
3.5 免疫组织化学 在冷冻切片机(CM1850,Lei⁃ca)上将右侧大脑半球切成30µm厚的切片,并在-20℃下保存于防冻溶液中。实验时用TBS洗涤6×10 min去除防冻溶液,3%过氧化氢淬灭内源性过氧化物酶,室温封闭1 h,加Ⅰ抗6E10(1∶20 000)4℃孵育48 h,经TBS洗涤后,生物素标记的抗鼠Ⅱ抗(1∶600)室温孵育90 min,ABC放大液室温孵育60 min,DAB显色,漂洗后贴片、封片,显微镜下拍照。
3.6 Western blot分析 将上述分离的海马组织按比例加入预冷的组织裂解液,超声裂解提取蛋白,用BCA蛋白检测试剂盒测定蛋白浓度。用8%或12%的SDS-PAGE分离等量的蛋白,并转移到PVDF膜上。室温封闭2 h后移入用封闭液稀释的Ⅰ抗(mTOR、pmTOR、LC-3和β-actin抗体,均1∶2 000)中4℃过夜,TBST洗涤,加入辣根过氧化物酶标记的IgGⅡ抗(1∶2 000)孵育90 min,化学发光法显色,X射线底片曝光。通过ImageJ软件进行灰度分析。
3.7 ELISA测定海马组织Aβ1-42含量 海马组织中加入预冷的组织裂解液,超声裂解提取蛋白,16 000×g、4℃离心25 min,吸取上清液为TBST溶解的Aβ1-4(2TBST-Aβ1-42);上述沉淀物16 000×g、4℃离心5 min,弃上清液,加入400µL 5 mol/L盐酸胍溶液,震荡EP管,使沉淀物与管底分离,室温摇4 h后16 000×g、4℃离心5 min,收集上清液即为胍溶性Aβ1-4(2guanidine-Aβ1-42)。测定蛋白浓度后,按照Aβ1-42ELISA试剂盒操作说明测定Aβ1-42浓度。
4 统计学处理
数据采用SPSS 16.0软件包进行分析,并用GraphPad Prism软件绘图。正态分布数据以均数±标准误(mean±SEM)表示。Morris水迷宫潜伏期的数据通过重复测量多因素方差分析进行统计,其余资料采用多因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 雷帕霉素改善EFAD小鼠的认知功能
通过Morris水迷宫实验评价雷帕霉素对不同ApoE基因型小鼠空间学习和工作记忆的影响。寻找隐藏平台训练的实验,记录小鼠寻找隐藏平台的潜伏期如图1A所示:在溶媒对照组,E3FAD小鼠的潜伏期比E4FAD小鼠更短(P<0.05);雷帕霉素处理后,E3FAD小鼠和E4FAD小鼠的潜伏期均明显缩短,且两2组之间的差异无统计学显著性。经过6 d的训练后,移去隐藏平台进行探索实验,结果显示,在溶媒对照组,与E3FAD小鼠比较,E4FAD小鼠穿越平台次数少、距离平台平均距离延长(P<0.05);雷帕霉素处理后,与相应溶媒对照组相比,E3FAD小鼠与E4FAD小鼠穿越平台次数均增加、在平台所在象限停留时间均延长、距离平台平均距离均缩短(P<0.05),雷帕霉素处理后E3FAD小鼠与E4FAD小鼠之间上述指标的差异无统计学显著性,见图1B~D。小鼠寻找隐藏平台的游泳轨迹(典型例子,图1E)可以直观观察对照组的EFAD小鼠漫无目的地寻找隐藏的平台,接受雷帕霉素治疗的EFAD小鼠大部分时间停留在平台所在象限。Morris水迷宫实验结果显示,E4FAD小鼠的空间学习记忆能力较E3FAD小鼠下降;雷帕霉素对E3FAD小鼠和E4FAD小鼠的认知功能均有改善作用,经其治疗后这两种基因型小鼠认知功能的差异无统计学显著性,提示雷帕霉素改善EFAD小鼠(特别是携带ApoE4基因的小鼠)的空间记忆能力。
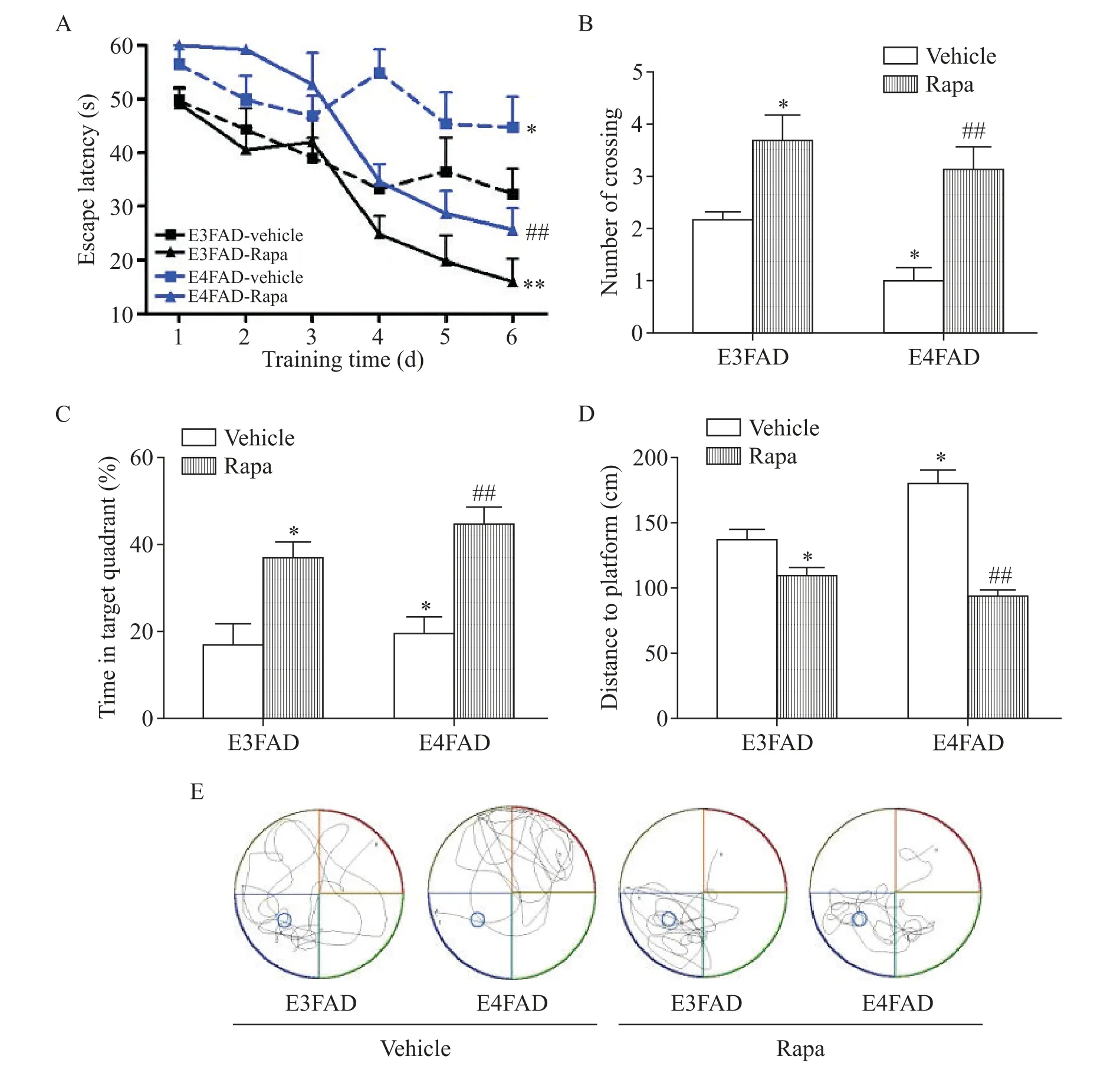
Figure 1.Rapamycin(Rapa)improved learning and memory in EFADmice.Escape latency(A)was significantly longer in E4FAD-vehicle group than that in E3FAD-vehicle group.It was shorten in both E3FAD and E4FAD mice after Rapa treatment.In the probe trial,the number of crossing(B),time spent in the target quadrant(C),the mean distance to the platform(D)and the swimming trajectories for the probe trials(E)were recorded.The number of crossing and the time spent in the tar⁃get in E4FAD-vehicle group were less than those in E3FAD-vehicle group,while the distance to the platform was longer than that in E3FAD-vehicle group.Treatment with Rapa increased the number of crossing and the time spent in the target,and decrease the distance to the platform in both E3FAD and E4FAD mice.Means±SEM.n=6.*P<0.05,**P<0.01 vs E3FAD-vehicle group;##P<0.01 vs E4FAD-vehicle group.图1 雷帕霉素改善EFAD小鼠的认知功能
2 雷帕霉素减少EFAD小鼠Aβ沉积,降低Aβ水平
通过免疫组化方法应用6E10抗体检测海马Aβ水平。与E3FAD小鼠相比,E4FAD小鼠海马内的Aβ沉积更明显;而雷帕霉素显著减少了E3FAD和E4FAD小鼠海马内Aβ的聚集,见图2A。我们进一步采用ELISA法检测了Aβ1-42水平,结果与免疫组织化学一致。雷帕霉素处理后,E3FAD小鼠和E4FAD小鼠的TBST-Aβ1-42水平与对照组相比分别下降了26.2%和22.3%(P<0.05);E4FAD小鼠脑内的gua⁃nidine-Aβ1-42水平几乎是E3FAD小鼠的2倍(P<0.01);与对照组比较,雷帕霉素处理后E4FAD小鼠脑内guanidine-Aβ1-42水平降低了30%(P<0.05),但E3FAD小鼠的guanidine-Aβ1-42水平无明显变化,见图2B。这些数据表明,E4FAD小鼠比E3FAD小鼠具有更高水平的guanidine-Aβ1-42,雷帕霉素治疗后,E3FAD小鼠和E4FAD小鼠脑内的TBST-Aβ1-42水平均显著下降,但是仅E4FAD小鼠脑内的guanidine-Aβ1-42水平降低。
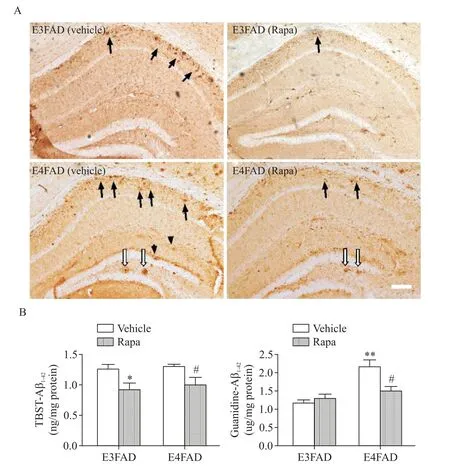
Figure 2.Rapamycin(Rapa)reduced Aβdeposits in the hippocampus of EFAD mice.A:immunohistochemical staining for Aβde⁃posits showed that amyloid plaques in the hippocampal CA1 region(black arrow)and dentate gyrus(white arrow)in E3FAD mice were fewer than those in E4FAD mice,and Rapa reduces Aβdeposits in EFAD mice(scale bar=100µm);B:Aβ1-42 levels in hippocampal homogenates of EFAD mice were detected by ELISA.Means±SEM.n=6.*P<0.05,**P<0.01 vs E3FADvehicle group;##P<0.05 vs E4FAD-vehicle group.图2 雷帕霉素减少EFAD小鼠Aβ沉积,降低Aβ水平
3 雷帕霉素抑制EFAD小鼠海马组织mTOR活化并激活细胞自噬
自噬小体能将细胞内待降解的大分子或毒性物质,如Aβ,运送至溶酶体内降解[14]。LC3-II的含量与自噬程度成正比。我们评估了mTOR及其磷酸化形式和自噬标志物LC3-II/LC3-I的蛋白水平。如图3所示,雷帕霉素处理后E3FAD和E4FAD小鼠海马组织中p-mTOR/mTOR蛋白水平较对照组分别降低了16%和50%(P<0.05);在对照组,E4FAD小鼠海马组织LC3-II/LC3-I蛋白水平较E3FAD下降40%(P<0.05),雷帕霉素可显著升高LC3-II/LC3-I的表达(P<0.05),并且雷帕霉素治疗后,E3FAD组和E4FAD组LC3-II/LC3-I蛋白水平的差异无统计学显著性(P>0.05)。以上结果表明,雷帕霉素在EFAD小鼠中抑制mTOR活化,进而上调自噬标记蛋白的表达。
4 雷帕霉素降低EFAD小鼠自噬小体电子致密物
透射电镜下自噬小体表现为双层膜囊泡结构(图4,白色箭头)。E3FAD和E4FAD小鼠海马CA1区可见大量功能障碍的自噬空泡,空泡中含有未降解的电子致密物,且缺乏完整的双层膜结构(图4,黑白箭头)。E4FAD组异常自噬体数量明显多于E3FAD组。雷帕霉素处理后EFAD组完整的双层膜结构增加,其内电子致密物减少、密度降低,提示雷帕霉素降低了EFAD小鼠自噬小体内的电子密度,增加了包裹在自噬小体中的异常聚集物质的降解。

Figure 3.Rapamycin(Rapa)inhibited the expression of mTOR(A),and up-regulated LC3-II/LC3-Iratio(B)in the hippocampus of EFAD mice.Mean±SEM.n=3.*P<0.05 vs E3FAD-vehicle group;##P<0.01 vs E4FAD-vehicle group;△P<0.05 vs E3FAD-Rapa group.图3 雷帕霉素抑制EFAD小鼠mTOR表达并激活自噬
5 雷帕霉素对EFAD小鼠的体重、血常规和生化指标无显著影响
雷帕霉素灌胃期间,每周测定小鼠体重(表1),灌胃结束后测定血常规(表2)和生化指标(表3)。以上数据显示,该治疗剂量下雷帕霉素对EFAD小鼠体重、血细胞及肝肾功能无显著影响(P>0.05)。
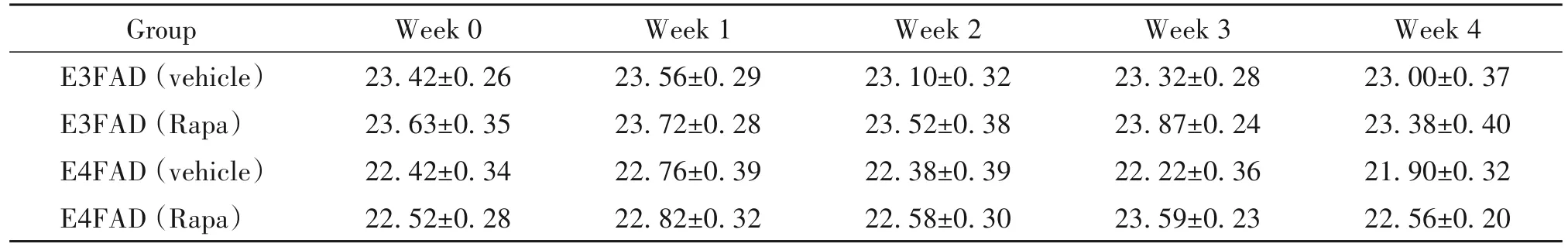
表1 雷帕霉素对EFAD小鼠体重的影响Table 1.Effects of rapamycin(Rapa)on body weight in EFADmice(g.Mean±SEM.n=8)

表2 雷帕霉素对EFAD小鼠血常规指标的影响Table 2.Effects of rapamycin(Rapa)on blood routine indexesin EFADmice(Mean±SEM.n=6~8)
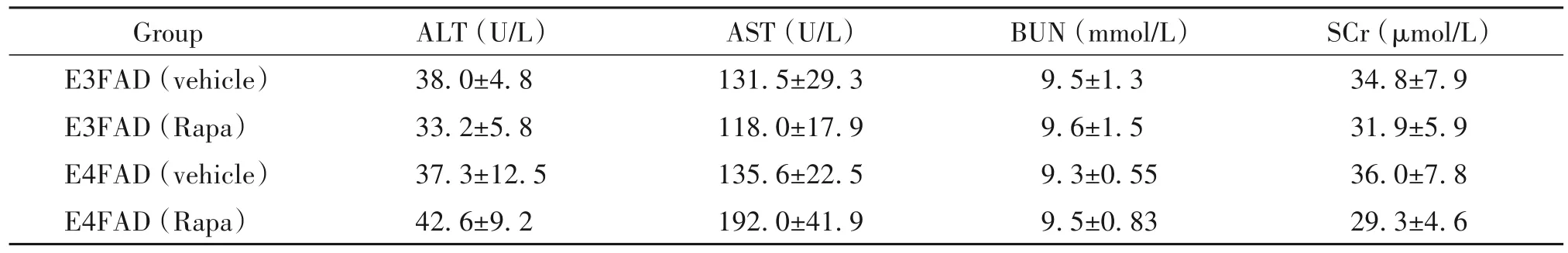
表3 雷帕霉素对EFAD小鼠生化指标的影响Table 3.Effects of rapamycin(Rapa)on biochemical indexes in EFADmice(Mean±SEM.n=6~8)
讨 论
AD一种严重威胁老年人身心健康的慢性进展性神经变性疾病,目前临床尚无有效的治愈手段和明确可延缓疾病进展的药物。ApoE4作为AD最重要的风险因素,是否参与调节AD病程中自噬功能,国内外鲜有报道。雷帕霉素是一种FDA批准的免疫抑制剂,在延缓衰老及相关疾病方面显示重要的保护作用。因此,本项目拟从老药新用的角度探讨雷帕霉素是否影响不同ApoE基因型的痴呆鼠脑内自噬通路、Aβ代谢以及认知功能。
脑内Aβ的形成和沉积是AD重要的病理特征。脑内Aβ包括神经元细胞浆内可溶性的Aβ和细胞外淀粉样斑块。Aβ有多种形式,其中Aβ1-42和Aβ1-40是最常见的。尽管Aβ1-42的数量仅为Aβ1-40的10%,但相对于Aβ1-40,Aβ1-42表现出更强的神经毒性作用,并且是脑内淀粉样斑块的主要成分。ApoE4是散发型AD最重要的遗传风险基因,不仅可减少Aβ的清除[15],还可增加tau蛋白的磷酸化[16],从而加剧学习和记忆障碍。与ApoE3神经元相比,ApoE4神经元分泌Aβ1-42增加,且ApoE4星形胶质细胞摄取Aβ障碍[10]。同时,ApoE4与Aβ的结合会导致Aβ构象从随机螺旋转变为β片层结构,从单体凝结成不溶性物质,参与Aβ的沉积[17]。我们的研究提示,与E3FAD小鼠比较,E4FAD小鼠脑内Aβ增多,认知功能明显下降,证实ApoE4可能通过促进Aβ的沉积加剧认知损害。由于人群中ApoE2基因型携带频率低,且已被证实具有神经保护作用[18],因此ApoE3和ApoE4这2个基因型如何影响AD病理受到国内外学者更多的关注。
自噬是一种依赖溶酶体的降解途径,主要过程包括自噬体的形成、成熟、自噬体与溶酶体的结合及溶酶体降解4个阶段,主要承担真核细胞内长寿命蛋白质和细胞器的降解,对细胞生长、增殖及维持内环境稳态起着重要作用[4]。自噬在清除受损细胞器及异常聚集的毒性蛋白中起重要作用,mTOR是自噬的负调控因子。在自噬过程中,LC3是自噬的标志物,LC3-II由LC3-I转化而来,被认为是自噬的分子标志物,存在于自噬小体的双层膜结构。正常脑组织内很少有自噬小体形成,但是在AD脑内自噬体的数量和溶酶体系统的形态学发生了显著的变化。有研究显示AD模型鼠出现自噬功能障碍,不能有效清除Aβ[19]和磷酸化tau[20],引起Aβ和tau的异常聚集。目前,关于不同的ApoE亚型(尤其是ApoE4)是否影响AD自噬系统和Aβ代谢的研究比较少。本研究发现,与E3FAD小鼠相比,E4FAD小鼠自噬标志物LC3的下降更明显,功能异常的自噬小体和待降解物质增多,Aβ的含量升高,提示ApoE4加重了自噬功能障碍和Aβ沉积。
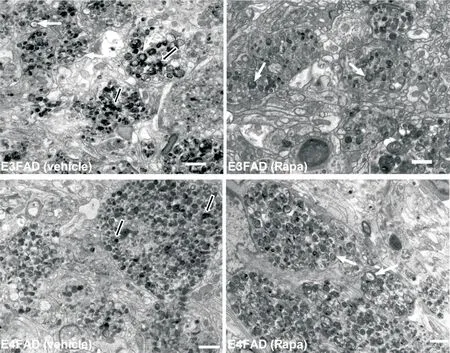
Figure 4.Autophagosomes in the hippocampal CA1 region observed under transmission electron microscope.Rapamycin(Rapa)in⁃creased the number of double-membrane vacuoles(white arrow)and lowered the density of undigested materials enclosed in autophagosomes(white arrow with black core).The scale bar=1µm.图4 雷帕霉素减少EFAD小鼠海马内细胞自噬小体电子致密物
mTOR参与神经元的发育和可塑性[21],在衰老的大脑中,mTOR通路调节紊乱导致认知功能下降[22]。mTOR、Aβ的产生和AD之间有着密切联系[23]。激活mTOR通过调节自噬途径可增加Aβ的合成并抑制其清除[19]。抑制PI3K/Akt/mTOR信号通路增强自噬后可减少Aβ聚集,从而改善APP∕PS1小鼠的认知功能[8,24]。临床病理学研究显示AD早期即出现mTOR信号通路的激活,但轻度认知障碍和AD患者之间pmTOR无明显差异[23]。这与本研究6月龄E3FAD和E4FAD小鼠的p-mTOR/mTOR水平没有显著差异是一致的,可能与mTOR信号通路激活后的“天花板效应”有关。
雷帕霉素通过抑制mTOR激活自噬,是目前最常用的自噬激动剂。既往研究显示雷帕霉素增强自噬,减轻AD转基因小鼠淀粉样蛋白沉积和tau蛋白相关的病理损害[25],同时具有延缓并减轻组织器官衰老作用[26]。但雷帕霉素对不同ApoE基因型的AD转基因小鼠自噬功能的影响尚不清楚。本研究首次探索ApoE3和ApoE4基因型对AD转基因小鼠的自噬溶酶体系统的影响及雷帕霉素的作用。我们发现雷帕霉素可以改善E3FAD小鼠和E4FAD小鼠的空间导航和参考记忆,减少Aβ沉积,与既往研究结果相一致[27]。雷帕霉素抑制EFAD小鼠p-mTOR表达,增加自噬标志物LC3-II的表达。有趣的是,雷帕霉素处理后不改变E3FAD组的guanidine-Aβ1-42水平,却显著地降低E4FAD小鼠脑内的guanidine-Aβ1-42水平,进而缩小E4FAD与E3FAD之间认知差距,提示雷帕霉素这一神经保护作用与ApoE基因型有关,在E4FAD组中尤为明显。
综上所述,我们的实验结果显示不同ApoE基因型对5×FAD转基因小鼠学习、记忆、Aβ代谢和自噬功能的影响存在差异。与E3FAD小鼠相比,E4FAD小鼠认知能力和自噬功能受损更为明显,Aβ水平更高。雷帕霉素可以改善E3FAD小鼠和E4FAD小鼠的认知功能,其可能的机制包括抑制mTOR活化、激活LC3介导的自噬和促进Aβ降解,这些作用对携带ApoE4基因型的转基因小鼠更明显,而且该治疗剂量(1 mg·kg−1·d−1)的雷帕霉素无明显毒副作用。以上研究提示雷帕霉素是一种潜在的治疗AD的药物,特别是对ApoE4基因携带者可能更有临床应用前景。
——雷帕霉素

