高迁移率族蛋白1 在直肠癌中的表达情况及与患者预后的关系
程世豪,乐建培,黄毅婷,冯嘉辰
1上海市静安区中心医院检验科,上海 200040
2上海市仁济医院病理科,上海 200127
直肠癌的发病率普遍较高,约为60%,且发病人群多为老年人,其作为一种免疫原性相对较强的恶性肿瘤,大多会伴有一定程度的淋巴细胞浸润,可能会直接影响患者的预后。而恶性肿瘤的基本生物学行为特征为局部组织侵袭或一定方式的转移,最终致死,但机制尚不明确。高迁移率族蛋白1(high mobility group box 1,HMGB1)是当前已经证实的一种与体内细胞增殖、代谢、分化等一系列过程存在明显关系的非组蛋白家族成员;其最初处于细胞核内,作为一种内源性危险信号,参与了多种肿瘤的生理活动。当其释放到细胞外,会引发机体的相关免疫反应,并且在肿瘤细胞的生长过程中,最终促进组织局部血管生成,有利于肿瘤细胞的侵袭转移,故其在直肠癌患者预后方面的作用值得研究。当前研究很少将焦点集中于HMGB1 在肿瘤组织内的表达情况、表达位置,以及对直肠癌的潜在意义。故本次研究对HMGB1 在直肠癌患者中的表达情况进行探索,同时明确其在肿瘤细胞内的表达位置,并且通过生存分析明确其对患者预后的影响,一方面,为临床此类疾病的诊断、治疗提供一定的理论依据,另一方面进一步探讨其在直肠癌中的作用,现报道如下。
1 资料与方法
1.1 一般资料
收集2016 年1 月至2017 年10 月上海市静安区中心医院收治的直肠癌患者的病历资料。纳入标准:符合直肠癌诊断标准;均行直肠癌根治术;未合并严重的脏器损伤;意识清晰,能够完成正常交流。排除标准:合并精神疾病;治疗期间不配合或者拒绝治疗;术后随访期间依从性差。根据纳入、排除标准,共纳入78 例直肠癌患者,其中男50例,女28 例;病程2~5 年,平均(3.2±0.7)年。收集78 例患者的肿瘤组织及癌旁组织。
1.2 检测方法
1.2.1 免疫组化法检测HMGB1 蛋白的表达情况将获得的临床病理组织脱蜡,以磷酸盐缓冲液(phosphate buffered solution,PBS)充分清洗3 次,每次5 min;完成后切片并放于室温环境下30 min,再以PBS 充分清洗3 次,每次5 min。室温环境下,牛血清白蛋白(bovine serum albumin,BSA)处理10 min,4 ℃条件下加入HMGB1 TREM-1 一抗。PBS 清洗3 次,每次5 min,再加入辣根过氧化物酶标记的链霉卵白素液,进行室温下孵育,10 min 后PBS 清洗3 次,每次5 min,羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗在同样环境下20 min,PBS 清洗3 次,每次5 min,再次采用Alexa-Fouor 488 羊 抗 兔IgG 二 抗,20 min 后PBS 清 洗3次,每次5 min,最后对获得的最终样本采用环辛二烯进行显色,苏木精复染,分化,脱水,胶封。由2名以上医师将最终的免疫组化样本于光镜下检测HMGB1蛋白表达情况,镜下可见直肠癌组织细胞呈棕色则为HMGB1阳性表达,其他则为阴性表达。
1.2.2 组织内免疫淋巴细胞浸润情况检测 组织样本剪碎,37 ℃RPMI 1640 和HEPES 混合并充分搅拌均匀2 h,有效分离获得样本上清,HBSS 清洗3 次,离心后收集淋巴细胞,以单细胞悬液的形式将样本与鼠抗人CD3-APC、CD45ROPE 荧光抗体混合均匀,并4 ℃孵育30 min,再以流式细胞仪检测组织内免疫淋巴细胞CD3、CD45RO的表达情况。400 倍显微镜视野下观察到CD45RO细胞个数24 个及以上为高密度,24 个以下为低密度;CD3细胞个数16 个及以上为高密度,小于16 个为低密度。
1.3 观察指标
①肿瘤组织中HMGB1 与免疫淋巴细胞浸润情况的关系;②HMGB1 与直肠癌患者临床特征的关系;③对患者术后随访40 个月,了解患者从术后到死亡/复发的生存时间。
1.4 统计学方法
采用SPSS 26.0 统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ
检验;等级资料的比较采用秩和检验;多因素分析采用Cox 风险比例模型分析;采用Kaplan-Meier 法绘制生存曲线,生存情况的比较采用Log-rank 检验;以P
﹤0.05 为差异有统计学意义。2 结果
2.1 HMGB1 表达情况的比较
直肠癌组织中HMGB1 表达情况高于癌旁组织,差异有统计学意义(Z
=3.152,P
﹤0.05),其中,直肠癌组织中HMGB1 高表达最为突出。(表1)
表1 直肠癌组织及癌旁组织中HMGB1 蛋白表达情况
2.2 不同临床特征直肠癌患者直肠癌组织中HMGB1 蛋白表达情况的比较
不同病理分期、肿瘤结节情况、CD3浸润情况、CD45RO浸润情况、脉管癌栓或神经侵犯情况、淋巴结转移情况、远处转移情况的直肠癌患者的直肠癌组织中HMGB1 蛋白表达情况比较,差异均有统计学意义(P
﹤0.05)。(表2)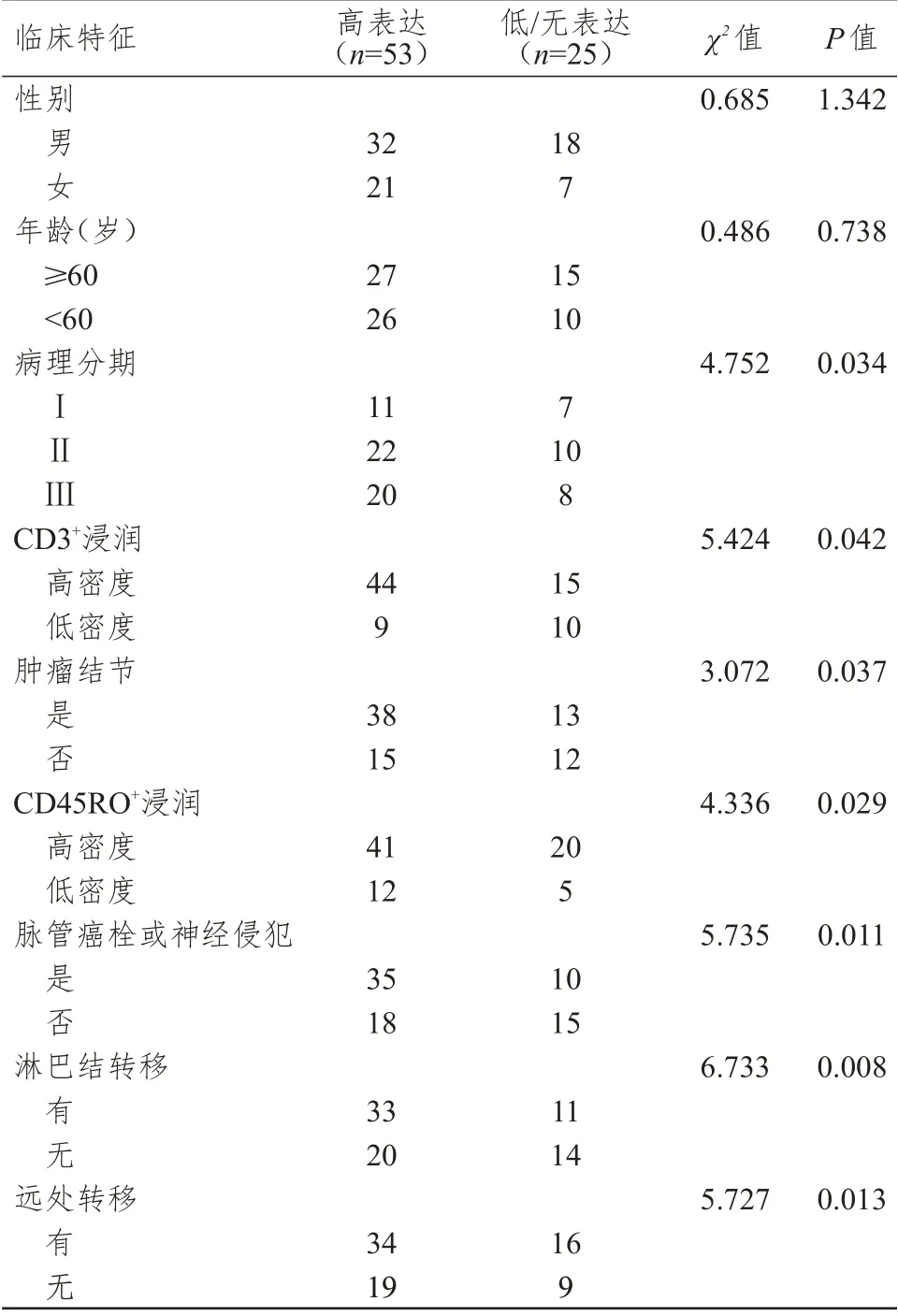
表2 不同临床特征的直肠癌患者直肠癌组织中HMGB1蛋白表达情况的比较
2.3 HMGB1表达部位与淋巴细胞浸润情况的关系
对70 例存在HMGB1 表达的组织进一步检测,其中核表达55 例,核质共表达15 例;HMGB1 核表达的直肠癌组织中淋巴细胞CD3、CD45RO高密度浸润比例较高,差异均有统计学意义(χ
=12.035、9.573,P
﹤0.05)。(表3)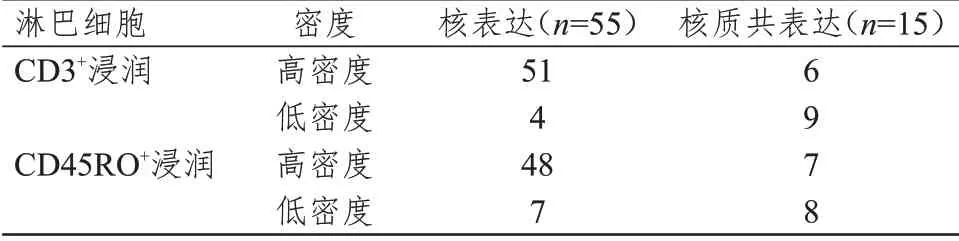
表3 HMGB1不同表达部位的直肠癌组织中淋巴细胞浸润情况
2.4 生存情况
随访40 个月,78 例患者中死亡59 例,生存19例,平均生存时间为(19.89±1.29)个月。比较不同HMGB1表达部位、表达情况、免疫淋巴细胞浸润情况的直肠癌患者的生存时间发现,HMGB1核表达、HMGB1高表达、CD3低密度浸润、CD45RO低密度浸润患者的生存时间分别短于HMGB1 核质共表达、HMGB1 低/无表达、CD3高密度浸润、CD45RO高密度浸润患者,差异均有统计学意义(χ
=12.235、14.560、4.192、5.753,P
﹤0.05)。(图1~图4)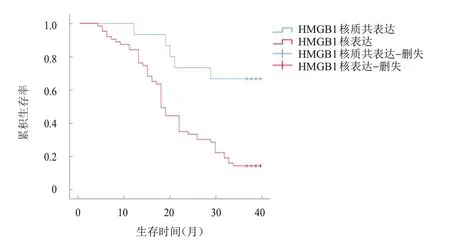
图1 HMGB1核表达(n=55)与核质共表达(n=15)直肠癌患者的生存曲线
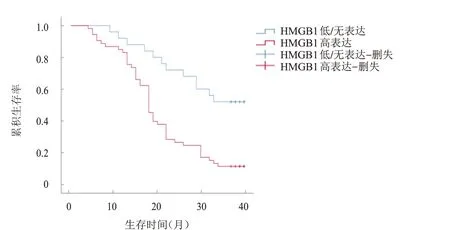
图2 HMGB1高表达(n=53)与低/无表达(n=25)直肠癌患者的生存曲线
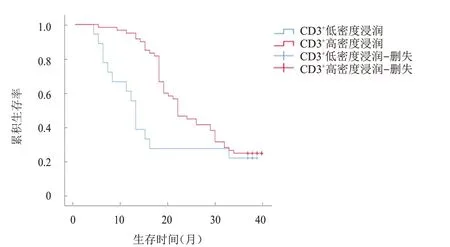
图3 CD3+高密度浸润(n=57)与CD3+低密度浸润(n=13)直肠癌患者的生存曲线
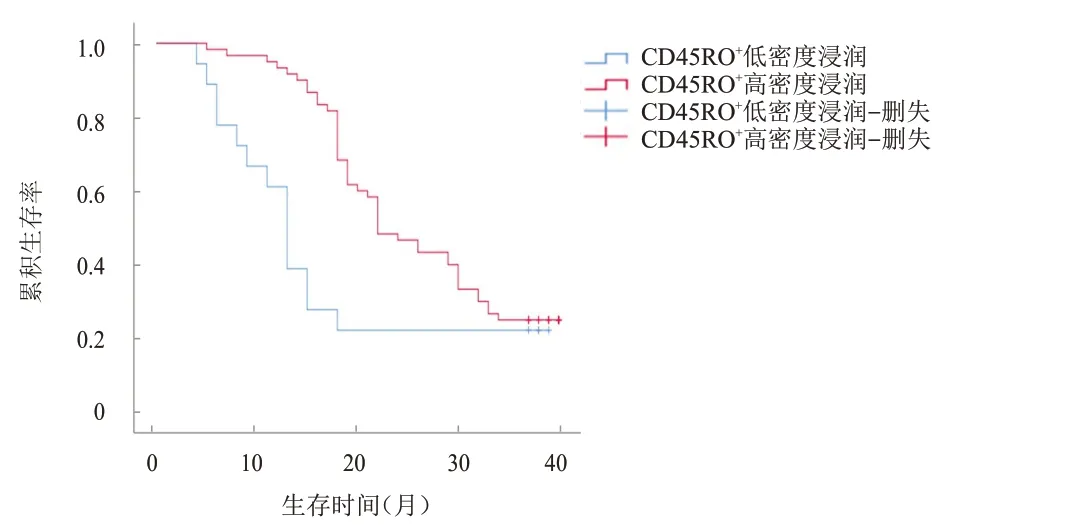
图4 CD45RO+高密度浸润(n=55)与CD45RO+低密度浸润(n=15)直肠癌患者的生存曲线
2.5 直肠癌患者生存时间的影响因素分析
多因素分析发现,HMGB1 表达部位、病理分期、CD3浸润情况、CD45RO浸润情况均为直肠癌患者生存时间的影响因素(P
﹤0.05)。(表4)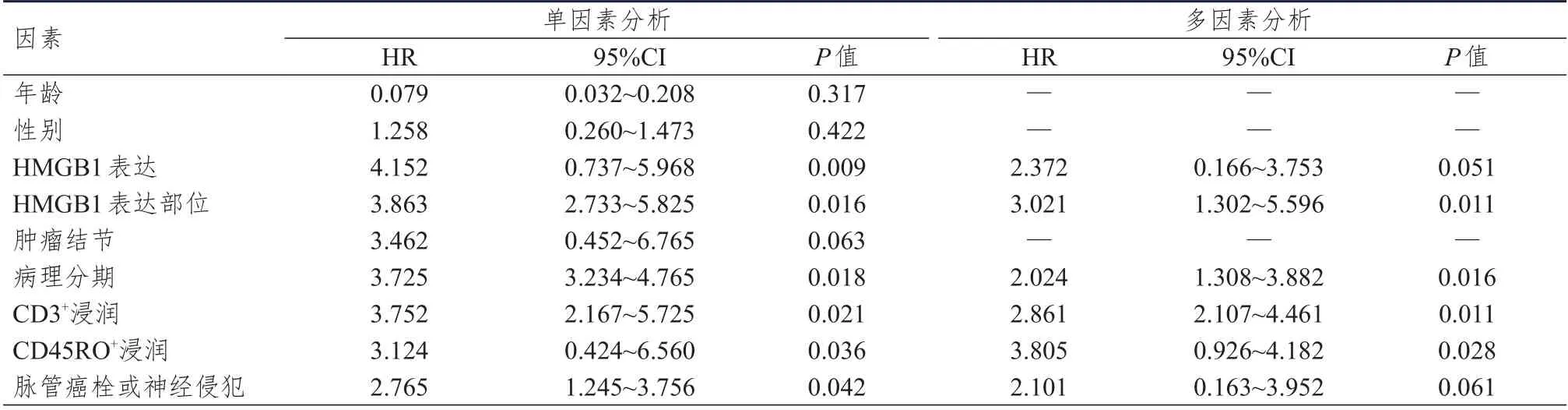
表4 直肠癌患者生存时间的影响因素分析
3 讨论
HMGB1 在细胞代谢过程方面,是一种能够与DNA 有效结合的蛋白,可广泛存在于细胞内,并且能够有效参与细胞的增殖、生长、运动等一系列过程,对该指标进行早期检测,有利于直肠癌的尽早发现,为临床的诊疗提供重要价值。此外,该指标作为当前临床肿瘤患者的诊断肿瘤标志物之一,也是临床靶向治疗的靶点之一。有研究显示,其能够一定程度有效激活p38、促分裂原活化的 蛋 白 激 酶(mitogen- activated protein kinase,MAPK)等一系列通路,介导肿瘤细胞的持续活化,激发其生长信号。本研究结果显示,直肠癌组织中HMGB1 表达情况高于癌旁组织,尤其以高表达为主要表现,且经显微镜下可见不同程度的染色,充分说明了这一事实。
此外,通过进一步对HMGB1 与患者临床特征的关系分析发现,不同病理分期、肿瘤结节、CD3浸润情况、CD45RO浸润情况、脉管癌栓或神经侵犯情况、淋巴结转移情况、远处转移情况的直肠癌患者的直肠癌组织中HMGB1 蛋白表达情况比较,差异均有统计学意义(P
﹤0.05)。直肠癌人群中HMGB1 的表达能够提示患者局部可能存在较为明显的淋巴细胞浸润或转移及远处转移等风险,也提示在已经确诊为直肠癌的患者中,HMGB1 高表达也与局部肿瘤组织的无限增殖或一定程度的血管生成有关。而有研究发现,对于接受放疗之后坏死的直肠癌细胞依旧能够激活肿瘤细胞的增殖,并且HMGB1 表达水平也会出现一定增高,这也充分说明了该指标是作为患者预后不良的一个新的标志物。另有研究针对转化控制肿瘤蛋白对机体内的HMGB1 相关行为进行一定的调控,进而促进直肠癌转移,这充分说明了HMGB1 高表达与直肠癌的复发风险关系紧密,也证实了本研究中提示的HMGB1 与转移的关系。此外,进一步对HMGB1 高表达情况与免疫淋巴细胞浸润的关系进行研究,发现HMGB1 高表达患者直肠癌组织中CD3、CD45RO的浸润情况较为显著;对存在HMGB1 表达的组织进一步检测,发现其细胞核表达与核质共表达共同存在,尤其以核表达情况下的免疫淋巴细胞浸润情况最为突出。这都提示,直肠癌患者体内HMGB1 表达以核表达为主,并且会伴随着典型的免疫淋巴细胞浸润。分析认为,这可能是因为肿瘤细胞内HMGB1释放至细胞外,可引发机体以CD3、CD45RO为典型代表的记忆性T 淋巴细胞(是肿瘤免疫反应的重要细胞之一)肿瘤相关免疫反应,在肿瘤的病灶组织内其密度相对较高。尤其在HMGB1 高表达情况下,患者可能存在一定程度的转移风险,局部组织内的免疫淋巴细胞也会相对呈现聚集,密度较大,以最大程度抑制肿瘤细胞的增殖和扩散,这也可能影响患者的生存时间,因此对于直肠癌患者,CD45RO较高急需及时进行临床干预,以改善患者预后,降低复发风险。而HMGB1一旦释放至细胞外环境,即可引起相应的树突状细胞、巨噬细胞有效活化,进而一定程度上诱导免疫耐受。但是其具体引起免疫调节的机制值得研究。此外,这也说明了HMGB1 在细胞核内表达较高的情况下,免疫淋巴细胞浸润情况也较为明显,一定程度上反映了HMGB1 可能通过机体内的免疫机制影响肿瘤进展。
随访40 个月,78 例患者中死亡59 例,生存19例,生存时间为(19.89±1.29)个月。比较不同HMGB1 表达部位、表达情况、免疫淋巴细胞浸润情况的直肠癌患者的生存时间发现,HMGB1 核表达、HMGB1 高表达、CD3低密度浸润、CD45RO低密度浸润患者的生存时间分别短于HMGB1 核质共表达、HMGB1 低/无表达、CD3高密度浸润、CD45RO高密度浸润患者,差异均有统计学意义(P
﹤0.05)。通过对生存时间的影响因素进行分析发现,HMGB1 表达部位、病理分期、CD3浸润情况、CD45RO浸润情况均为直肠癌患者生存时间的影响因素(P
﹤0.05)。也提示HMGB1 表达情况与患者的预后可能存在一定的关系,也提示临床对于结肠癌的治疗需要严密监测患者术后或化疗后的指标,为及时诊断患者是否存在复发、转移等情况,提供一定的帮助。综上所述,HMGB1 在结肠癌组织中高表达,且多存在于细胞核内,HMGB1 高表达的直肠癌患者的病灶内有较为明显的免疫淋巴细胞浸润,此类患者生存时间相对较短,这提示可通过机体内的免疫机制而影响肿瘤进展。且经多因素分析发现,HMGB1 表达部位、病理分期、淋巴细胞浸润均为患者预后的影响因素,而HMGB1 表达不能作为患者预后的影响因素。因此临床对于结肠癌HMGB1 表达及免疫淋巴细胞动态监测,能够帮助了解患者的预后情况,为调整治疗方案提供一定的帮助。

