MRI 及直肠腔内超声诊断低位直肠癌术前T 分期的准确度分析
庄咏,吴贤毅,卓长华,余辉,杨春康
福建省肿瘤医院/福建医科大学附属肿瘤医院胃肠外科,福州 350014
结直肠癌是常见的恶性肿瘤,根据2018 年全球肿瘤统计资料的数据,结直肠癌在恶性肿瘤中发病率居第3 位。随着生活水平的提高,饮食结构的改变,中国的结直肠癌发病率近年来也在不断升高,目前在中国恶性肿瘤中发病率居第3位。直肠癌在结直肠癌患者中所占比例较高。由于低位直肠癌解剖学具有其特殊性,盆腔空间狭小,直肠与周边相邻脏器关系紧密,前方紧邻前列腺、精囊腺、尿道(男性)及宫颈、阴道后壁(女性),两侧靠近髂内血管及其分支、盆神经,下方紧邻肛提肌。其环周切缘阳性率、局部复发率均较高位直肠癌高,预后较差。低位直肠癌的治疗方式随着术前分期的不同具有很大的差异,临床分期较早的患者(TNM期)可直接手术治疗,临床分期为T期或N期的患者,建议先接受同步放化疗后再接受手术治疗。由于新辅助放化疗能够使肿瘤体积缩小从而达到降期的目的,同时可消除亚临床病灶,提高切除率及保肛率,减少肿瘤局部复发,因此术前准确分期对直肠癌综合治疗方案的制订有重要意义。术前分期评估主要依据各种影像学检查,《中国结直肠癌诊疗规范(2017 年版)》推荐应用盆腔MRI 和直肠腔内超声(endorectal ultrasonography,ERUS)进行术前分期,部分研究发现MRI、ERUS 对术前T 分期的诊断准确度没有差异。本研究采用回顾性分析的方法,评估MRI 及ERUS 对低位直肠癌术前T 分期的诊断准确度是否存在差异,探讨MRI 及ERUS 在新辅助放化疗后低位直肠癌再分期中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2014 年4 月至2017 年6 月就诊于福建医科大学附属肿瘤医院的低位直肠癌患者的病历资料。纳入标准:年龄18~75岁;病理活检确诊为直肠腺癌,经硬质直肠镜确定肿瘤下缘距齿状线5 cm以内;心肺功能储备好,无严重器质性疾病;无远处转移;既往无恶性肿瘤史。排除标准:有金属内植物,伴有肠梗阻超声探头无法通过;有其他MRI 或ERUS 检查禁忌,无法耐受检查。根据纳入、排除标准,共纳入43 例低位直肠癌患者,其中男性19例,女性24 例;年龄(55.58±10.24)岁;术前临床分期:TNM期(直接手术组)24 例,T或N期(放化疗组)19 例;肿瘤下缘距离齿状线距离(25.23±14.26)mm;手术方式:腹腔镜辅助超低位直肠前切除术15 例,腹腔镜辅助腹会阴直肠癌联合切除术13 例,超低位直肠前切除术7 例,腹会阴联合直肠癌切除术7 例,经肛门直肠拖出外翻超低位前切除术1 例;病理分期:T期4 例,T期3 例,T期14 例,T期20 例,T期2 例。
1.2 检查方法
盆腔MRI 检查应用飞利浦3.0 T 核磁共振扫描仪,8 通道体部相控阵线圈作为接收线圈。检查前清洁肠道,未注射解痉药,膀胱适度充盈。经2 名有5 年以上MRI 诊断工作经验的医师分别对所获得图像进行分析并判断MRI T 分期。
ERUS 采用Philips iU22 彩色多普勒超声诊断仪,C9-5 腔内端扫探头,频率5~9 MHz。检查前清洁肠道,肠腔内灌注胃肠超声助影剂1000 ml,待肠腔充分扩张后再行超声检查。观察并记录肿瘤的位置、大小、形态、内部回声、血流情况、肿瘤浸润肠壁深度及范围、有无浸润周围组织及脏器,记录测量数据并保存图像。检查结束后,由2 名具有5年以上超声诊断经验的医师分别对灌注超声造影和超声双重造影图像进行分析并判断超声T 分期。
MRI 及ERUS T 分期均参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)结直肠癌T 分期:原位肿瘤(tumor in situ,Tis),肿瘤局限于上皮内;T期,肿瘤侵犯黏膜下层;T期,肿瘤侵犯固有肌层;T期,肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖的直肠周围组织;T期,肿瘤侵犯腹膜脏层或邻近盆腔器官、结构(肿瘤侵犯腹膜脏层为T期,侵犯其他器官或结构为T期)。
1.3 统计学方法
采用SPSS 22.0 统计软件进行数据分析,计数资料以例数及率(%)表示,采用Kappa 值评估一致性,准确度=(真阴性+真阳性)例数/(真阳性+真阴性+假阳性+假阴性)例数×100%,以P
﹤0.05 为差异有统计学意义。2 结果
2.1 直接手术组
直接手术组共24 例,术后病理T期3 例(12.5%),T期11 例(45.8%),T期10 例(41.7%),T期0 例(0%)。MRI T 分期准确度为70.8%(17/24),过高分期16.7%(4/24),过低分期12.5%(3/24),Kappa 系数为0.54(P
﹤0.01)(表1)。ERUS T 分期准确度为75.0%(18/24),过高分期8.3%(2/24),过低分期16.7%(4/24),Kappa 系数为0.60(P
﹤0.01)(表2)。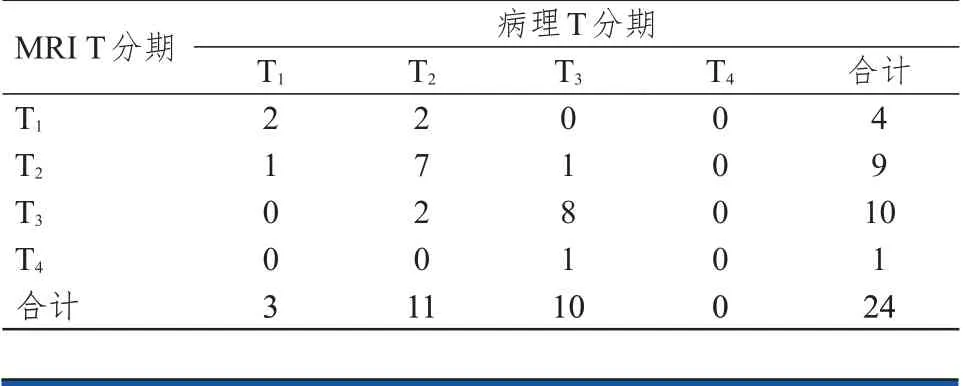
表1 直接手术组MRI T 分期与病理T 分期的对照
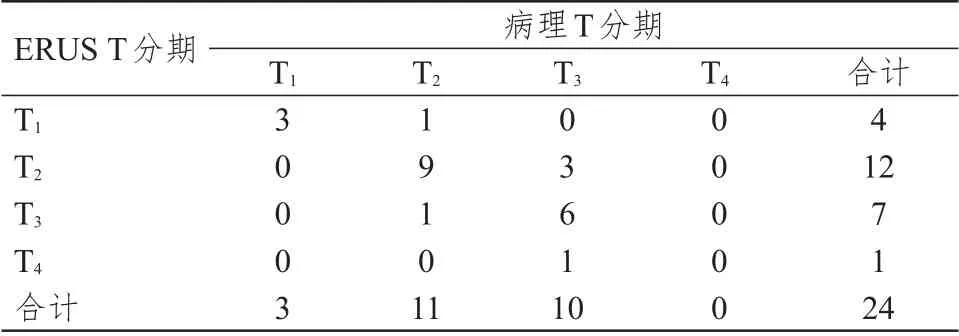
表2 直接手术组ERUS T 分期与病理T 分期的对照
2.2 放化疗组
放化疗组共19 例,术后病理完全缓解4 例(21.1%),T期0 例(0%),T期3 例(15.8%),T期10例(52.6%),T期2 例(10.5%)。放化疗后MRI T 分期准确度为57.9%(11/19),过高分期31.6%(6/19),过低分期10.5%(2/19),Kappa 系数为0.40(P
﹤0.01)(表3)。放化疗后ERUS T 分期准确度为36.8%(7/19),过高分期26.3%(5/19),过低分期36.8%(7/19),Kappa 系数0.15(P
=0.15)(表4)。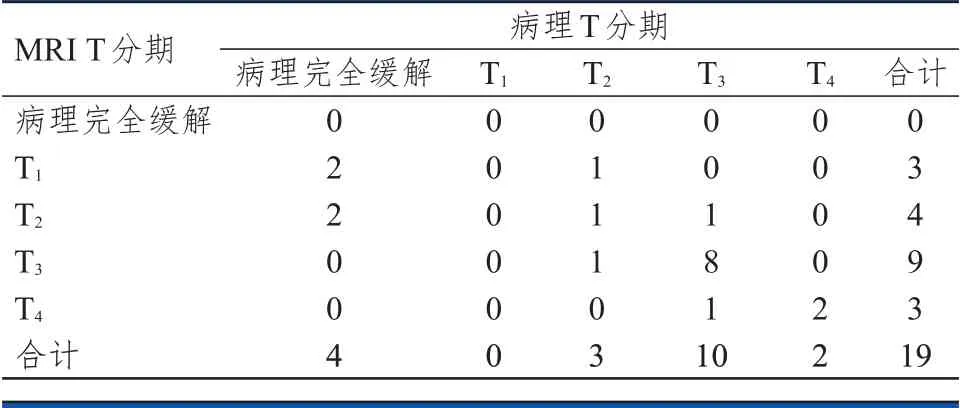
表3 放化疗组MRI T 分期与病理T 分期的对照
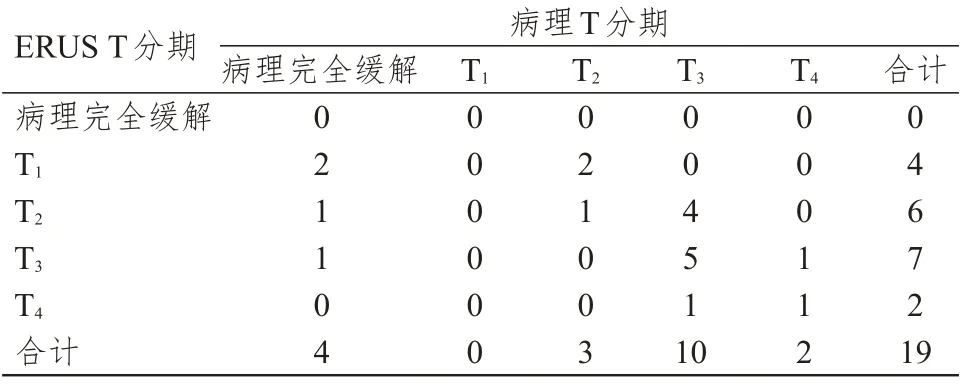
表4 放化疗组ERUS T 分期与病理T 分期的对照
3 讨论
直接手术组中MRI 及ERUS 的术前T 分期准确度均较高(分别为70.8%及75.0%),在与术后病理T 分期的一致性分析中两种检查方式均具有中等 一 致 性(Kappa 系 数 分 别 为0.54 及0.60,P
﹤0.01)。该组中病理分期较早期的病例(T期),MRI 的准确度为64.3%(9/14),与术后病理的一致性分析Kappa 值为0.40(P
=0.16),一致性一般;ERUS 的准确度为85.7%(12/14),与术后病理的一致性分析Kappa 值为0.81(P
﹤0.01),具有较强一致性。说明对于T期的直肠癌,ERUS 较MRI 具有更高的T 分期诊断效能。该组中病理分期为T期的病例,MRI 的准确度为80.0%(8/10),ERUS 的准确度为60.0%(6/10),说明对于T期直肠癌MRI较ERUS 具有更高的T 分期诊断效能。直接手术组中的T期直肠癌分期中较常出现分期错误,国外研究也发现T与T期直肠癌T 分期较容易发生错误,因为部分T期肿瘤的纤维结缔组织反应性增生及小的透壁血管在MRI 下可表现为固有肌层的小锯齿状突起,导致肌层连续性中断,边缘粗糙,从而将T期直肠癌错误分期为T期。本研究中,MRI 对放化疗后直肠癌T 分期的准确度为57.9%,与术后病理的一致性分析Kappa 值为0.40,一致性一般。ERUS 对放化疗后直肠癌T分期的准确度为36.8%,与术后病理的一致性分析Kappa 值为0.15,一致性较差。与直接手术组较高的诊断效能相比,MRI 及ERUS 在直肠癌放化疗后再分期中的诊断效能不佳,因此直肠癌放化疗后如何评估治疗反应仍是目前直肠癌治疗中的难点与热点。由于同步放化疗导致直肠癌病灶局部水肿、纤维化及合并局部炎症,干扰了病灶浸润层次判断,导致分期困难。MRI 在放化疗后再分期较ERUS 有一定优势,这可能得益于MRI 检查时的一些特殊序列如弥散加权成像(diffusion-weighted imaging,DWI),DWI 能够更加突出肿瘤与正常组织间的信号差异,其定量指标表观弥散系数(apparent diffusion coefficient,ADC)测定有助于对放化疗后患者的再分期。
近年来对保留直肠功能的非手术治疗(放化疗后获得临床完全缓解的患者可以采用“等待观察”)成为低位直肠癌综合治疗的热点,对放化疗后准确再分期是其中的关键。准确的临床分期对于低位直肠癌的规范化、个体化治疗具有重要意义。而目前常规检查手段在直肠癌放化疗后再分期中的诊断效能较差,有待进一步开展相关研究提高放化疗后再分期的诊断效能。

