自组装DEAC-PNAG@miR-150纳米体系制备及其血管保护机制研究
李雅珺,许 航,任 珊
脓毒症是重症监护病房高死亡率的主要原因之一。脓毒症可释放大量炎症因子,促进免疫细胞的活化和转运。此外,脓毒症常因内皮功能障碍扰乱微循环,导致器官衰竭。因此,减少脓毒症患者体内相关炎症因子的释放、减轻内皮细胞损伤对于降低脓毒症患者的死亡率大有裨益。微小RNA(mircoRNA,miRNA)能预防和修复脓毒症患者体内细胞压力和炎症引起的内皮细胞损伤。miR-150是内皮细胞中表达的miRNA,对维持血管完整性和血管生成具有重要意义。核酸的一些理化性质限制其细胞摄取和潜在治疗效果。因此,开发一种安全有效的miRNA载体对miRNA的治疗具有重要意义。该研究通自组装技术制备脱乙酰化聚N-乙酰氨基葡萄糖(DEAC-PNAG)-miRNAs纳米聚合物并对其进行表征,检测纳米聚合物对miRNAs保护和靶向作用,并探讨其发挥血管保护作用的相关机制。
1 材料与方法
1.1 材料与试剂
脱乙酰聚N-乙酰氨基葡萄糖(DEAC-PNAG)40 mg/ml(分子量约40 000)和无菌NaSO(50 mmol/L)购自阿拉丁公司(中国);EBM-2基础培养基,胎牛血清(FBS)、细胞培养基、青霉素链霉素溶液购自Sigma Aldrich(美国);miR-150-5p(UCUCCCAACCCUUGUACCAGUG)、miR-150-5p抑制剂从Genechem(中国)获得;标记为hsa-miR-150-5p的Cy3购买自GE Healthcare Dharmacon(美国);含DAPI的ExtendGold防褪色试剂(ThermoFisher Scientific,美国);RT-PCR试剂盒购自Qiagen公司(美国);人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自BioVector公司(中国);NIH3T3胚胎成纤维细胞购自Solarbio公司(美国)。1.2 仪器与设备
5424R离心机(Eppendorf,德国); JEOL-1010透射电子显微镜(美国);滨松C4742-95数码相机(日本);Zetasizer Nano-ZS 90(Malvern,英国);UVP透照仪(Alpha Innotech Corporation,日本);Synergy 4微板阅读器(BioTek,美国);Olympus IX73倒置显微镜(Olympus,日本);CFX96实时PCR检测系统(Bio-Rad,美国)。1.3 纳米颗粒制备
在室温下向100 μl 浓度为50 mmol/L NaSO溶液中加入miR-150-5p(0.5~25.0 μg),以研究封装效率。添加1.1 mg的DEAC-PNAG后高速涡流20 s。随后,添加NaCl,自组装在室温下反应15 min。使用NaOH中和纳米聚合物混悬液,涡流10 s,最终pH值为7。通过15 000 r/min,4 ℃,离心1 h,分离纳米颗粒备用。N/P采用以下公式计算:N/P=(阳离子DEAC-PNAG×150胺基摩尔数)/(miRNA×44磷酸基团摩尔数)。
制备4种不同比例的DEAC-PNAG/miRNA,分别含有24.48、1.80、0.90和0.45 μg miRNA,比例为50 ∶1、700 ∶1、1 400 ∶1和2 700 ∶1。
1.4 DEAC-PNAG@miRNA表征
取DEAC-PNAG@miRNA混悬液离心,弃上清液。将纳米颗粒重悬于TEM网格上。样品在超纯净水中冲洗,干燥,TEM成像,DLS测定DEAC-PNAG纳米聚合物的尺寸和Zeta电位。1.5 电泳迁移率
用4%(W/V)琼脂糖E-gel和iBase系统检测DEAC-PNAG与miR-150的结合,向凝胶中添加20 μl 的纳米聚合物样品,iBase电泳按照制造商说明书实施。使用UVP透照仪分析miR-150条带。1.6 封装效率
为评价DEAC-PNAG对miRNA的包封效率,用游离miRNA绘制标准曲线。不同浓度的miRNA在4%(W/V)琼脂糖E-凝胶中用iBase系统电泳30 min。同时,使用4% SDS溶解凝胶中的纳米聚合物。用Image J分析条带,根据谱带强度生成标准曲线,并根据标准曲线计算被包封的RNA浓度。1.7 DEAC-PNAG@miRNA对miRNA保护作用
为评价DEAC-PNAG@miRNA对miRNA的保护作用。纳米聚合物和游离miR-150在37 ℃下用0.18 μg RNase A处理1 h。15 000 r/min,25 ℃ 离心,弃上清液,用4 μl EDTA(0.25 mol/L)处理10 min。随后将沉淀重新悬浮在2%十二烷基硫酸钠中,在凝胶电泳前静置30 min。处理后的纳米聚合物和游离miRNA用4%(W/V)琼脂糖E-凝胶在iBase系统中电泳30 min。1.8 体外细胞实验
1.8.1
细胞活力检测 使用EBM-2基础培养基,在37 ℃、5% CO孵箱中培养。培养基每48 h更换一次,第3~5代取用。在添加10% FBS的RPMI-1640培养基中培养。研究不同比例DEAC-PNAG@miRNA处理后HUVECs的存活率:miRNA纳米聚合物用MTT法测定,在2.0×10个细胞/孔的96孔板中孵育。补充培养基,用不同N/P摩尔比的纳米聚合物处理细胞。培养24 h后,洗涤细胞并加入MTT溶液。使用Synergy 4微板阅读器在570 nm的吸光度处评估细胞活性。1.8.2
细胞摄取 用Cy3标记的miRNA-150(Cy3-miRNA-150,红色)摄取,细胞核用DAPI(蓝色)复染。25 μl摩尔浓度分别为55.0、27.5和14.0 nmol/L纳米聚合物处理HUVECs 24 h。去除聚合物,用PBS洗涤细胞,用4% PFA固定20 min。去除PFA后,使用含DAPI的ExtendGold防褪色试剂固定。荧光图像通过Olympus IX73倒置显微镜获得。1.8.3
RT-PCR HUVECs细胞和NIH3T3细胞以1.0×10个细胞/孔的密度接种。让细胞孵育过夜,随后用25 μl纳米聚合物处理24 h。用Mirnaesy试剂盒分离miRNA。使用Bio-Tek Gen5 Take 3 s软件阅读分析数据评估RNA完整性。通过miScript Ⅱ RT试剂盒,将1 μg miRNA合成cDNA。使用miScript-SYBR-Green-PCR试剂盒扩增cDNA产物。采用CFX96实时PCR检测系统评估hsa-miR-150-5p的变化,以RNU6B为内参。1.8.4
Western blot 血管紧张素-Ⅱ(Angiotensinogen-Ⅱ,Ang-Ⅱ):将接种在6孔板中的HUVECs(1×10个细胞/孔)与纳米聚合物(50 ∶1)孵育24 h,纳米聚合物每孔含有1.0 μg的阴性对照siRNA或miR-150。用EBM-2基础培养基饥饿培养16 h,然后用LPS处理6 h或24 h。用含蛋白酶/磷酸酶抑制剂和冈田酸的RIPA缓冲液溶解。蛋白质裂解物在4%~12% Bis-Tris中在100~200 V下溶解1.5 h。转置PVDF膜上1 h,用Odyssey封闭液阻断1 h。用磷酸化Ang-Ⅱ(1 ∶1 000)和actin(1 ∶1 000)4 ℃过夜,用Odyssey-Licor成像系统分析印迹。DLK-1:将接种在6孔板中的HUVECs与含有1.0 μg 阴性对照siRNA或miR-150-5p的纳米聚合物以50 ∶1的比例培养48 h。提取细胞蛋白按上述方法裂解产物。印迹法α-微管蛋白(1 ∶1 000)或DLK-1(1 ∶1 000)4 ℃下过夜和IRDye二抗(1 ∶10 000)孵育1 h。

2 结果
2.1 DEAC-PNAG@miRNA的制备及对miRNA保护作用
由于非特异性抗菌特性,本研究选用DEAC-PNAG作为miRNAs的传递系统。通过琼脂糖凝胶电泳迁移率变化分析,确定DEAC-PNAG结合miRNA的有效性。结果表明,N/P在50 ∶1~2 700 ∶1的配比范围内,miRNA可完全与DEAC-PNAG结合(图1A)。不同N/P的DEAC-PNAG@miRNA和游离miRNA分别与RNase A共培养60 min后,N/P为700 ∶1和1 400 ∶1观察到少量的miRNA降解,而在N/P2 700 ∶1的聚合物中观察到miRNA的大量降解(图1B)。在N/P为700 ∶1时,约80%的miRNA被封装,而在1 400 ∶1和2 700 ∶1的比率下,仅有约50%的miRNA被封装(图1C、D)。
图1 DEAC-PNAG对miRNA-150的保护作用及封装效率A:DEAC-PNAG对miRNA-150的凝胶阻滞作用;B:不同N/P纳米聚合物对miRNA的保护作用;C:不同浓度游离miRNA(2、4~8道),不同N/P纳米聚合物显示在9~12道;D:封装效率柱状图
2.2 细胞摄取及细胞活力检测
为证实纳米聚合物促进HUVECs的细胞摄取,本研究制备荧光标记的DEAC-PNAG@Cy3-miRNA-150聚合物。该聚合物处理HUVECs 24 h后,通过荧光显微镜分析聚合物的亚细胞定位(图2)。在N/P为700 ∶1、1 400 ∶1和2 700 ∶1 三组中观察Cy3阳性细胞,而仅用Cy3-miRNA-150孵育的细胞中没有Cy3荧光(图2A)。阳离子聚合物可以影响细胞代谢活性和活力,因此我们使用MTT比色法确定DEAC-PNAG@miR-150的细胞代谢活性。使用N/P为700 ∶1、1 400 ∶1和2 700 ∶1的DEAC-PNAG@miR-150处理HUVECs 24 h,以未添加样品正常培养的细胞为参照。结果表明对照组和实验组间未观察到细胞代谢活性的显著差异(图2E)。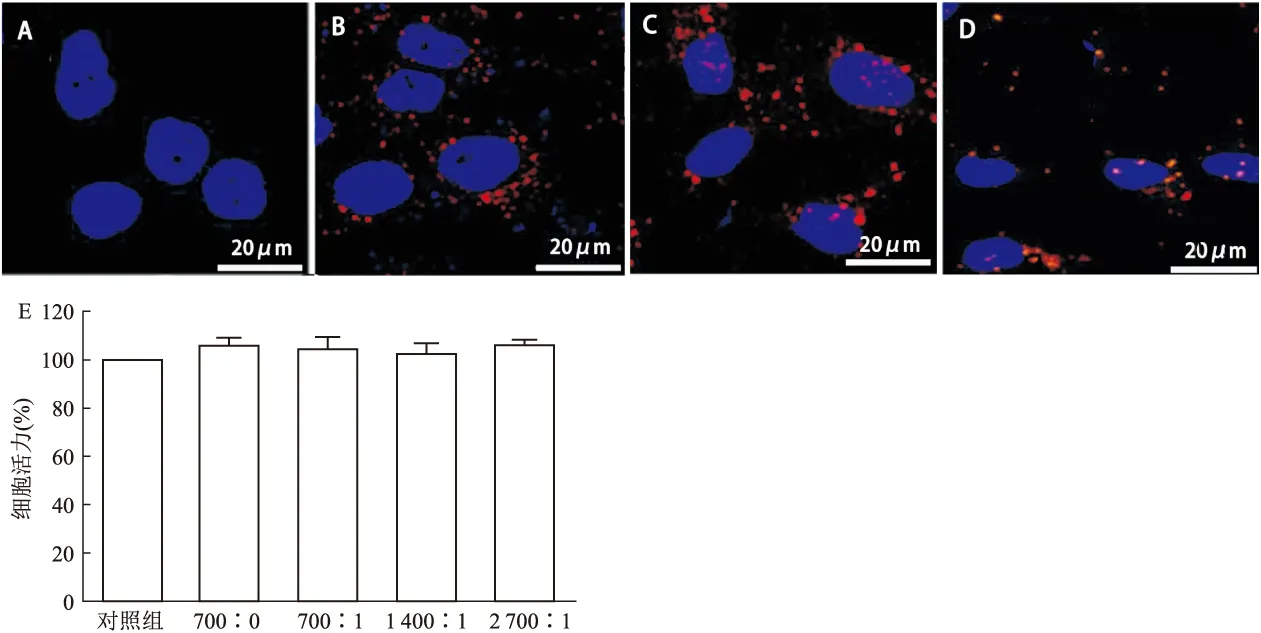
图2 DEAC-PNAG@ miR-150体外细胞细胞摄取及细胞活力A:DEAC-PNAG@Cy3-miRNA-150(0 ∶1);B:DEAC-PNAG@Cy3-miRNA-150 (700 ∶1);C:DEAC-PNAG@Cy3-miRNA-150(1 400 ∶1); D:DEAC-PNAG@Cy3-miRNA-150 (2 700 ∶1); E:HUVECs与DEAC-PNAG单独或与不同比例miRNA复合培养24 h后的细胞代谢活性
2.3 DEAC-PNAG@miRNA表征
TEM成像结果显示N/P 700 ∶1的纳米聚合物呈圆形或椭圆形,且单分散(图3A)。基于DLS分析,N/P 700 ∶1纳米聚合物的平均粒径约为254 nm(图3B)。700 ∶1纳米颗粒的Zeta电位为+16.4 mV,多分散指数(PDI)为0.479,表明纳米颗粒的分散性较高。
图3 TEM和DLS分析纳米颗粒A:N/P 700 ∶1的纳米聚合物TEM结果;B:N/P 700 ∶1的纳米聚合物的粒径分布
2.4 RT-PCR和Western bloting
为进一步量化纳米聚合物处理HUVECs后miRNA的递送,我们进行了RT-PCR试验。与对照组和DEAC-PNAG单独应用比较,DEAC-PNAG@miR-150聚合物增加HUVECs细胞中miR-150的表达(图4A、B)。随后进一步研究miRNA在miR-150表达水平较低的NIH3T3细胞中的递送。结果用DEAC-PNAG@miR-150纳米聚合物培养的NIH3T3细胞miR-150表达量增加3 772倍(图4B)。以上数据表明DEAC-PNAG聚合物可以有效地递送miRNAs以提高其细胞表达量。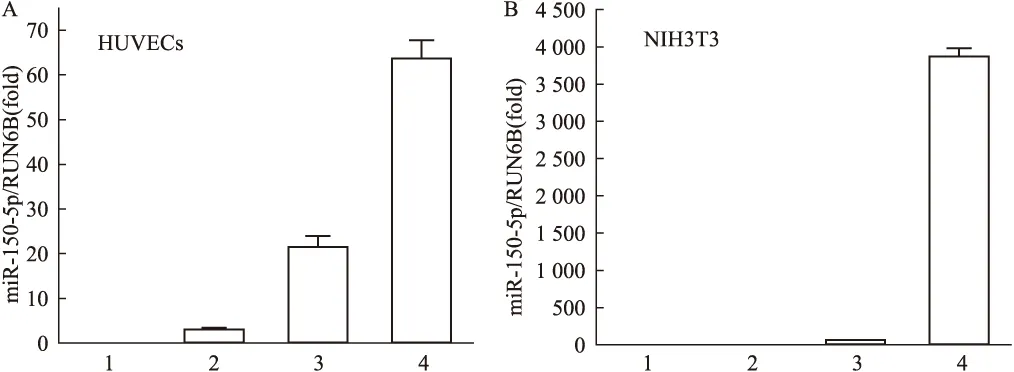
图4 聚合物转染24 h后细胞中miR-150的表达水平A:聚合物转染24 h后HUVECs 中miR-150水平实时PCR分析;B:聚合物转染24 h后NIH3T3中miR-150水平的实时PCR分析;1:对照组; 2:DEAC-PNAG组; 3:miR-150-5p组;4:DEAC-PNAG@miR150-5p组
Western Blot检测结果显示,使用N/P 50 ∶1的纳米聚合物具有体外生物效应(图5A、C),并能有效抑制RNase A降解(图5B)。与DEAC-PNAG@NsiRNA比较,DEAC-PNAG@miR-150纳米聚合物显著抑制了HUVECs细胞内Ang-Ⅱ和DLK-1表达(P
<0.05)(图5A、C)。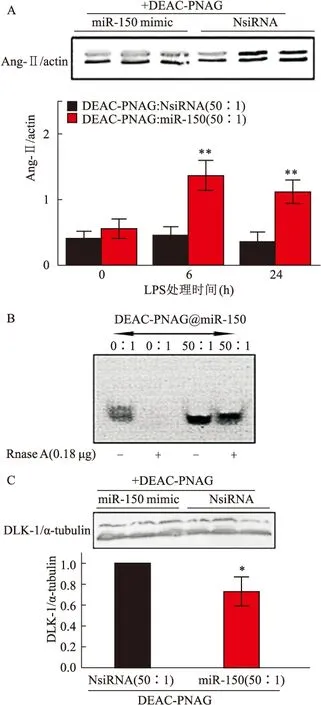
图5 DEAC-PNAG@miRNAs 50 ∶1聚合物对Ang-Ⅱ和DLK-1蛋白表达抑制作用A:HUVECs中Ang-Ⅱ的表达;B:N/P 50 ∶1的DEAC-PNAG@miRNAs对miRNA的保护作用;C:HUVECs中DLK-1的表达;与DEAC-PNAG@NsiRNA(50 ∶1)组比较:*P<0.05, **P<0.01
3 讨论
由于基因的不稳定性,miRNA治疗需引入有效的载体平台将其导入细胞。病毒、脂质体和壳聚糖等载药系统已被应用于miRNA负载。由于制备流程复杂,体内外核酸递送效率低,应用价值有限。为降低上述限制,我们通过自组装技术制备了DEAC-PNAG@miRNA自组装聚合物,该聚合物可有效递送miRNA至HUVECs和NIH3T3细胞中。RT-PCR结果显示,DEAC-PNAG@miRNA-150纳米聚合物可显著提高miR-150细胞内表达水平。
DEAC-PNAG聚合物具有抗菌作用,是递送用于脓毒症治疗miRNA的理想载体。Vournakis et al的研究表明,聚N-乙酰氨基葡萄糖(sNAG)纳米纤维(DEAC-PNAG的类似物),在伤口愈合过程中发挥抗菌作用。他们特别指出,sNAG可增强内皮细胞和角质形成细胞中α-防御素和β-防御素的表达,减少金黄色葡萄球菌的感染概率。此外,本研究证实作为治疗脓毒症miRNA载体,DEAC-PNAG能有效地包埋miRNA并保护其不被RNase降解,这点对于保证miRNA在体内环境中的稳定性至关重要。此外,纳米聚合物直径(约200 nm)允许其在循环过程中避免被肝脏和网状内皮系统吸收,而其阳离子Zeta电位表明其具有良好的稳定性。
DEAC-PNAG@miRNA-150聚合物能有效地将miRNA传递给细胞,导致细胞功能性改变。细胞内传递的miRNA水平与细胞类型有相关性,我们研究结果证实了这一点。HUVECs的miR-150表达水平的增加明显低于3T3成纤维细胞。这可能是细胞特异性给药效率不同,也可能是由于内皮细胞中miR-150的表达水平高于成纤维细胞所致。尽管700 ∶1的纳米聚合物有最佳的miRNA保护作用,但体外数据表明该浓度在细胞内不能产生最佳miRNA活性。可能该浓度会阻碍miRNA从纳米聚合物中释放,导致miRNA功能受损。此外,50 ∶1浓度DEAC-PNAG@miRNA-150可往细胞内递送完整的miRNA,同时允许miRNA从聚合物中分离,继而抑制Ang-Ⅱ和DLK-1的翻译。
众所周知,Ang-Ⅱ可引起血管通透增加,过量的Ang-Ⅱ生成与脓毒症患者死亡率升高关系密切。miR-150能通过沉默包含互补序列的mRNA调节信号网络,抑制Ang-Ⅱ生成,从而减轻血管损伤。DLK1可通过NOTCH1的激活抑制内皮细胞增殖,从而抑制血管生成。DEAC-PNAG@miRNA-150对二者的抑制,将有助于降低血管通透性,促进血管内皮细胞再生,从而促进血管发挥组织屏障作用。上述作用对于提升脓毒症患者的生存率具有重要意义。未来研究中我们将进一步探讨纳米聚合物对脓毒症小鼠存活率、脓毒症内皮功能障碍和血管通透性的影响。重点监测50 ∶1纳米聚合物,由于50 ∶1纳米聚合物含有更多的miRNA,尚需确定是否存在剂量反应。此外,使用αvβ3整合素配体LXW7修饰或RGD肽将有助于提高纳米聚合物靶向作用,miR-150对脓毒症微环境中内皮功能的影响也有待进一步探讨。
DEAC-PNAG聚合物是一种可行的miRNAs载体,DEAC-PNAG@miRNA-150纳米粒子聚合物提高了miRNAs稳定性和细胞摄取,允许miRNA从聚合物中分离并抑制Ang-Ⅱ和DLK-1基因翻译。这些研究表明DEAC-PNAG作为miR-150载体的可行性,为脓毒症小鼠存活率及其血管保护的体内研究奠定基础。

