骨肉瘤外泌体中miRNA促侵袭及血管化机制研究
邢江浩,郝吉庆
骨肉瘤是一种高度恶性的骨肿瘤,较多发生于20岁以下的年轻人或者儿童。骨肉瘤因其低存活率而广为人知,患者的5年生存率仅有20%。与骨肉瘤相关的病死率较高。当前的骨肉瘤治疗策略主要包括化学疗法和外科手术。然而,治疗后患者面临的最大问题仍是肿瘤的持续生长;研究显示,血管生成是骨肉瘤生长和转移的关键环节,肿瘤中血管网络的生成是骨肉瘤增长的关键因素。外泌体是几乎所有细胞均会释放的细胞外囊泡。它们可以将内容物(如microRNA、lncRNA、蛋白质和mRNA)传输到受体细胞,从而参与细胞间的各种通讯。肿瘤来源的外泌体已显示在肿瘤生长的不同时期中发挥作用,但目前对其中的机制研究较少。miR-301a-3p是近年发现的一种致癌miRNA,虽然目前已有文献报道其在多种恶性肿瘤,如胰腺癌、胃癌、肝癌、肺癌、乳腺癌及结直肠癌中高表达,参与肿瘤的发生、发展,并且文献报道其高表达与患者的不良预后密切相关。目前尚未有研究其对于骨肉瘤发生发展的作用,该研究拟阐明在骨肉瘤的生长过程中,其来源的外泌体内包含的miRNA的作用及可能存在的潜在机制。
1 材料与方法
1.1 材料
1.1.1
细胞培养 人骨肉瘤细胞株U2-OS和人血管内皮细胞(human umbilical vein endothelial cells,HUVEC)购自中国科学院上海细胞库,U2-OS细胞用McCoy′5A培养基培养,HUVEC细胞用ECM培养基培养,两种培养基均加入有10%的胎牛血清配置,置于 37 ℃、5% CO培养箱中培养。1.1.2
主要试剂与仪器 McCoy′5A培养基购自上海中乔新舟生物科技公司;胎牛血清购自美国Gibco公司;CD31、α-SMA、PI3K、p-PI3K、Akt、p-Akt、Mek、p-Mek、Erk、p-Erk等抗体均购自美国Abcam公司;miRNA-301a-3p 模拟物及抑制剂均购自通用生物系统有限公司(中国,安徽)。1.2 方法
1.2.1
U2-OS分泌的外泌体(U2-Exos)的分离与鉴定 将U2-OS细胞在不含外泌体的高糖培养基中培养24 h。在细胞达到完全融合之前,吸出上清液备用。通过在300 r/min,15 min;2 000 r/min,20 min;10 000 r/min,30 min这3个不同转速条件下,超速离心去除上清液中的碎片及细胞,并通过0.2 μm注射过滤器(康宁生命科学公司,美国)对其进行过滤。随后,以100 000 r/min转速,超速离心90 min提取外泌体,得到的沉淀物用150 μl PBS溶液重悬。为了鉴定沉淀物是否为外泌体,将提取后的沉淀物在2%戊二醛中浸泡过夜(4 ℃),次日,PBS反复冲洗3次,去除其中的液体。随后用1%锇酸溶液固定1 h,再用乙醇脱水并用环氧树脂包埋。切片机将包埋的材料切成薄片,然后将饱和高碘酸钠和浓度为0.1 mol/L的盐酸滴于薄片表面。10 min后,通过100 kV透射电子显微镜(HITACHI H-7000 FA,日本)观察沉淀物的形态。1.2.2
外泌体吞噬实验 PKH26荧光细胞染色试剂盒(Sigma-Aldrich)用于通过标记外泌体膜,从而标记外泌体。在6孔板上每孔接种1.2×10个HUVEC,培养过夜后将已完成标记的外泌体添加至6孔板中。培养12 h后,吸出6孔板中的培养基,2%甲醛固定15 min后PBS溶液洗涤3次;孔中加入1 ∶1 000比例稀释完成的Actin抗体(碧云天公司,美国),孵育2 h后吸出抗体,PBS溶液冲洗3次;随后以1 ∶800比例稀释荧光二抗,摇床室温孵育1 h后,PBS溶液冲洗3次。最后,Hoechst(Vector Laboratories,Burlingame,美国)染核,染核后同样PBS清洗3次;整个过程注意避光处理。共聚焦显微镜(LSM780,德国蔡司)观察和记录结果。1.2.3
肿瘤细胞侵袭实验 在4 ℃条件下,取出300 μl无血清培养基,并与30 μl基质胶混合。在24孔板的其中3个孔各加入100 μl混合溶液,后置于37 ℃恒温培养箱中培养4 h。从培养箱中取出肿瘤细胞,胰酶消化后,无血清培养基洗涤3遍后计数。用无血清培养基清洗上腔室1次后,向每个孔中加入100 μl细胞悬浮液。500 μl无血清培养基添加到下腔室,并在恒温培养箱中培养24 h。小室用PBS洗涤2次,在4 ℃下用5%戊二醛固定,然后用PBS清洗2次。最后,加入0.1%结晶紫染色并在室温下孵育30 min。再次用PBS清洗2次后,用棉球轻轻擦拭小室上表面细胞,并在显微镜下观察。1.2.4
Western blot 对于蛋白质印迹分析,使用RIPA溶液裂解细胞,并通过BCA测定法测量每组的蛋白浓度。选择浓度为5%的浓缩胶以及10%的分离胶,根据蛋白浓度选择各组蛋白的上样量,待电泳完成后,开始转膜,将蛋白从胶上转移至PVDF膜上;转膜完成后,5%脱脂乳室温封闭1 h,随后孵育一抗,4 ℃冰箱过夜;抗体的稀释比例均为1 ∶1 000;抗CD31、a-SMA、PI3K、p-PI3K、AKT、p-AKT、Mek、p-Mek、Erk、p-Erk。次日吸出一抗,PBS清洗后,二抗室温孵育2 h,使用Tanon 5200(Tanon科学技术有限公司,中国上海)机器对结果进行分析;使用Image J软件检测每个条带的灰度并进行半定量分析。1.2.5
细胞转染 用miR-301a-3p mimic(sense:5′-CAGUGCAAUAGUAUUGUCAAAGC-3′;antisense5′- GCUUUGACAAUACUAUUGCACUG-3′)及miR-301a-3p inhibitor(sense:5′- GCUUUGACAAUACUAUUGCACUG-3′)转染U2-OS细胞。随后,从两个不同组的培养基中按照先前的方法分离出两组的外泌体。RNA试剂盒(Omega Bio-Tek,美国)用于从外泌体中提取总RNA。使用反转录系统(日本Takara)生成cDNA,并在Bio-Rad CFX Connect实时系统(Bio-Rad)上使用SYBR Green PCR预混液(日本Takara)进行qRT-PCR,将基因的表达水平相对于内部对照(U6)标准化,并使用2方法评估相对表达水平。
2 结果
2.1 外泌体鉴定
骨肉瘤细胞产生的外泌体的纯度通过透射电子显微镜(TEM)和Western blot分析进行验证。TEM结果表明,外泌体呈杯状(图1A)。通过Western blot法对CD63、flortillin-1和CD9三种蛋白进行了定性及半定量分析,如图1B显示,上述三种蛋白在肿瘤细胞上的表达微乎其微,而在外泌体中的表达则较高,这与文献报道吻合,提示本实验所提取的沉淀物为外泌体。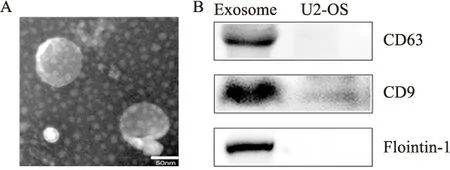
图1 外泌体鉴定A:杯状的外泌体;B:外泌体表面的标志性蛋白CD63(80 ku)、CD9(35 ku)、Flointin-1(48 ku)表达
2.2 外泌体吞噬研究
本实验拟明确提取的外泌体是否于HUVEC内发挥作用,而不是在细胞外。免疫荧光染色处理外泌体、HUVEC骨架、HUVEC细胞核,结果见图2。红色荧光外泌体包绕着蓝色荧光的HUVEC细胞核,而HUVEC的细胞骨架则呈现绿色荧光;此实验结果提示外泌体成功进入HUVEC内发挥作用。
图2 免疫荧光染色外泌体(红色)包绕HUVEC细胞核(蓝色),HUVEC细胞骨架呈现绿色荧光,提示外泌体进入HUVEC细胞质中
2.3 骨肉瘤细胞侵袭研究
肿瘤细胞侵袭实验检测各组细胞的侵袭增殖能力,结果见图3。空白组、miR-301a-3p抑制剂组、单纯骨肉瘤外泌体组、miR-301a-3p模拟物组中骨肉瘤细胞的侵袭能力逐渐增强,差异有统计学意义(t
=20.29,P
=0.002)。提示miR-301a-3p模拟物在一定程度上增强了肿瘤细胞的侵袭增殖能力。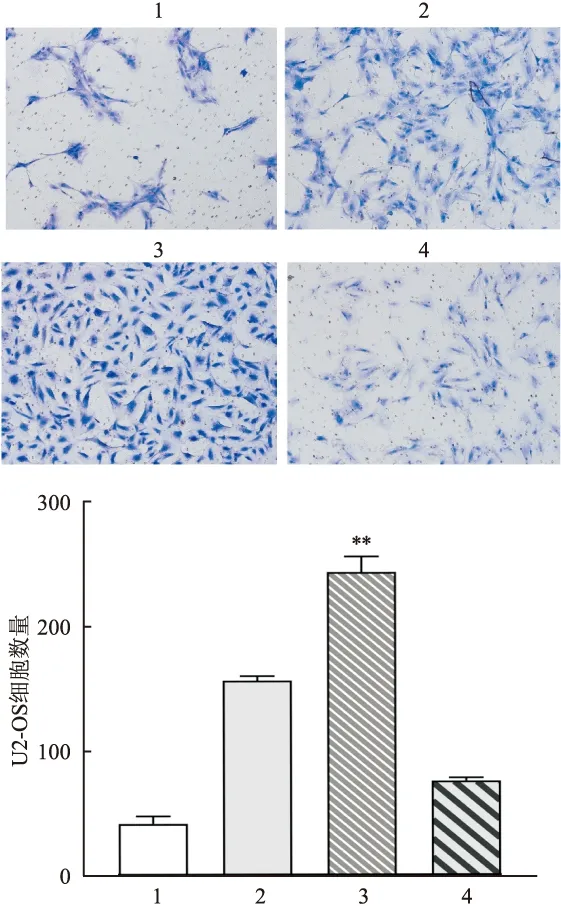
图3 骨肉瘤细胞侵袭实验1:空白组;2:单纯骨肉瘤外泌体组;3:miR-301a-3p模拟物组;4:miR-301a-3p抑制剂组;与空白组比较:**P<0.05
2.4 Western blot法检测
Western blot法结果显示见图4。与空白组、单纯骨肉瘤外泌体组以及miR-301a-3p抑制剂这三组比较,miR-301a-3p 模拟物组中的血管生成指标CD31蛋白表达增高,差异有统计学意义(t
=18.23,P
=0.003);α-SMA表达增高,差异有统计学意义(t
=8.373,P
=0.014)。PI3K/Akt及Mek/Erk信号通路蛋白表达量增高,差异有统计学意义(P
<0.05),提示miR-301a-3p进入细胞后可能通过激活PI3K/Akt及Mek/Erk两条信号通路,引起HUVEC的血管相关蛋白CD31及α-SMA高表达,从而促进成血管化,进一步促进骨肉瘤血管网络形成。
图4 Western blot检测各组血管相关及通路蛋白的表达水平1:空白组;2:单纯骨肉瘤外泌体组;3:miR-301a-3p模拟物组;4:miR-301a-3p抑制剂组;与空白组比较:**P<0.05
3 讨论
研究表明,非编码RNA在许多生物学过程中及疾病治疗中起着重要作用。miRNA作为非编码RNA之一在生物中被广泛发现。近年来,在肿瘤发生进展过程中发现了许多相关的miRNA。不同的miRNA可以调节不同的肿瘤生物过程,包括肿瘤的发生、侵袭和转移。外泌体,携带着包括miRNA在内的生物活性分子,通过旁分泌将其内容物转运到附近的细胞并诱导其表型发生变化。文献报道肿瘤细胞分泌的外泌体在许多肿瘤中异常表达,包括肺肿瘤、肝肿瘤、神经胶质瘤和骨髓瘤。
目前,骨肉瘤的发病机制尚不完全清楚,骨肉瘤致癌机制的研究对于预测患者的预后和制定患者的治疗计划非常重要。本课题通过一系列实验验证了骨肉瘤细胞分泌的外泌体中的miR-301a-3p可能通过PI3K/Akt和Mek/Erk信号通路激活下游分子以参与生物过程,并在肿瘤的增殖、分化、凋亡进程和细胞周期进程中发挥关键作用。先前的研究表明,AKT由于具有促进细胞增殖和血管生成的能力而在人类骨肉瘤中高度表达。原因之一是其上游调节基因PI3K的异常表达。
本研究在体外实验中证明,骨肉瘤分泌的外泌体的水平与AKT/p-AKT的水平呈正相关,表明这其中存在调节U2-OS细胞的增殖并促进肿瘤组织中血管生成的某种机制,并为肿瘤细胞提供更多的营养,从而促进肿瘤的生长。本研究中CD31及α-SMA蛋白表达增加,进一步说明miR-301a-3p是整个血管生成过程中的重要一环。
综上所述,U2-OS细胞分泌外泌体中的miR-301a-3p可能激活PI3K/Akt和Mek/Erk信号通路,发挥促进肿瘤发生发展的作用,这可能是骨肉瘤治疗的潜在靶点。但是相应的体内实验尚未完善,仍有待继续探究是否存在更进一步的增强血管生长的机制。

