黑龙江省黄瓜链格孢叶斑病病原鉴定及生物学特性研究
刘行风 刘 东 陶 磊 潘春清 李雪莲 马 天 潘梦佳 张艳菊
(东北农业大学农学院,黑龙江哈尔滨 150030)
链格孢(Alternaria)在分类上属于半知菌丝孢纲丝孢目暗色菌科,是重要的植物病原真菌,寄主范围和地理分布广,不仅能够侵染农作物、水果和蔬菜,对全球农业生产造成严重威胁,还可引起人类和动物的许多疾病(孙霞,2006)。链格孢在其侵染过程中,可产生70 余种毒素及次生代谢产物,在农作物中常可检测出交链孢酚(AOH)、交链孢酚单甲醚(AME)、细交链孢菌酮酸(TeA)、腾毒素(TEN)等毒素。这些毒素具有致畸性、致死性、致癌性、致突变性、细胞毒性、急性毒性和胚胎毒性,对人类的潜在危害也非常大(郭诗曼和冯启,2020)。
链格孢属真菌种类繁多,寄主广泛。目前已发现的链格孢菌有近500 种,依据寄主的数目,链格孢属位于近2 000 种真菌属中的第10 位(Farr et al.,1990;孙霞,2006)。茄链格孢(A.solani)和芸薹链格孢(A.brassicae)是世界性分布的种(Rotem,1997),引起茄科蔬菜早疫病和十字花科蔬菜黑斑病(云晓敏 等,2015;冯中红和孙广宇,2020;王燕荣 等,2021)。在葫芦科蔬菜上,由链格孢属引起的病害通常称为链格孢叶斑病,又称叶枯病,甜瓜、西葫芦、南瓜、黄瓜等瓜类作物均可感染(王莹莹,2016)。近年来我国葫芦科蔬菜栽培面积不断扩大、品种增多并不断更替,导致葫芦科蔬菜链格孢叶斑病危害加重。贾菊生和李新辉(2002)对新疆瓜类由链格孢侵染所致的两类叶斑病病原进行了研究,结果将新疆瓜类作物上Alternaria引起的叶斑病分为2 个组群,一组是在哈密瓜和西瓜上表现的黑斑病类型,病原为A.cucumerina;另一组是在黄瓜上表现的褐斑病类型,由A.cucurbitae引起。杨克泽等(2009)对甘肃省武威市南瓜叶枯病进行鉴定,认为是由瓜链格孢A.cucumerina侵染引起的;除南瓜外,也有研究表明A.cucumerina可以侵染黄瓜,他们对黄瓜抗病种质资源进行了研究,并应用转录组学分析了黄瓜应答黑斑病菌胁迫的机理及抗病候选基因(李淑菊 等,2012;王惠哲 等,2016;刘东 等,2017;Sa et al.,2020)。王莹莹(2016)对北京、河北、河南、甘肃、辽宁、黑龙江、湖南、湖北等12 个省市9 种葫芦科蔬菜上发生的链格孢叶斑病进行鉴定,鉴定出交链格孢(A.alternata)、西葫芦生链格孢(A.ponicola)和瓜链格孢(A.cucumerina),其中在甘肃省酒泉市和山东省寿光市黄瓜上采集的病菌为A.alternata。由此可见,A.cucurbitae、A.alternata和A.cucumerina均可侵染黄瓜。
2019 年东北农业大学农学院黄瓜课题组在黑龙江省黄瓜病害调查时发现了链格孢侵染疑似病株,为明确黑龙江省黄瓜链格孢叶斑病病原种类,采集了病样进行病原鉴定,并对病原生物学特性进行了研究,以期为黑龙江省黄瓜病害综合防治提供理论依据。
1 材料与方法
1.1 黑龙江省黄瓜链格孢叶斑病病原鉴定
1.1.1 田间症状调查及病样采集 2019 年6 月在黑龙江省齐齐哈尔市大民村采集疑似病样,记录症状并带回实验室进一步分离、鉴定。
1.1.2 病原菌分离、纯化 采用组织分离法对病原菌进行分离、纯化。取病健交界处组织,切成3~4 mm 正方小块,经75%酒精表面消毒及0.1%升汞消毒后,用无菌水清洗3 次,置于马铃薯葡萄糖琼脂(PDA)培养基上,28 ℃黑暗培养。菌落长出后进行单孢分离纯化(张笛 等,2020)。
1.1.3 致病性测定 将纯化的菌株接种到PDB 液体培养基中,28 ℃,130 r·min-1振荡培养7 d 后,用灭菌双层纱布过滤,离心后,用无菌水配制成浓度为1 × 107个·mL-1的孢子悬浮液。
黄瓜自交系D1801 用于病菌致病性测定。黄瓜种子由东北农业大学黄瓜课题组提供。供试黄瓜种子经5%次氯酸钠溶液消毒10 min,用清水冲洗,放入垫有2 层滤纸的培养皿中,于恒温培养箱中28 ℃催芽。待胚根长至0.5 cm 左右时,播种于装有灭菌蛭石的塑料育苗钵内,每钵播1 粒,26 ℃人工气候箱中培养。待黄瓜第1 片真叶展平,采用喷雾接种法苗期接种。接种后保湿24 h,置于26℃/18 ℃人工气候箱中培养。接种后10 d 调查发病情况(刘东 等,2017)。根据柯赫氏法则,对发病叶片进行再分离,显微镜观察确定分离病菌与原接种菌是否一致(张艳菊 等,2014)。
1.1.4 病原菌形态学观察 将分离纯化的菌株接种到PDA 培养基上,28 ℃黑暗培养6 d,观察记录菌落形态、颜色。通过光学显微镜观察分生孢子梗及分生孢子的形态、大小、颜色,测量分生孢子大小。
1.1.5 病原菌分子生物学鉴定 采用SDS 法提取病原菌的基因组DNA(赵春梅和郭晶,2019)。用移菌钩将培养基表面菌丝刮下,放入经液氮预冷的离心管中,加液氮迅速研磨;向离心管中加入400 μL TE 和80 μL SDS,摇晃混匀;65 ℃水浴30 min,每10 min 颠倒1 次;向离心管中加入100 μL KAc(5 mol·L-1),摇晃6 s,上下颠倒几次,冰浴30 min;向离心管中加入500 μL 氯仿-异戊醇(氯仿∶异戊醇为24∶1),13 000 r·min-1离心10 min,抽提2 次;离心后取上清液到1 个新的离心管中,加入等体积预冷的异丙醇,沉降30 min;13 000 r·min-1离心10 min,弃上清液。加入1 000 μL 70%酒精吹洗沉淀,13 000 r·min-1离心5 min,重复此步骤2 次。弃上清液,室温晾置5~10 min,加入50 μL TE 溶解DNA。
采用真菌核糖体基因转录间隔区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和抗原相关蛋白基因引物Alt a 1-F(5′-ATGCAGTTCACC ACCATCGC-3′)、Alt a 1-R(5′-ACGAGGGTGAYG TAGGCGTC-3′)(Miguel et al.,2010),对病原菌基因组DNA 进行PCR 扩增。引物由哈尔滨擎科生物科技有限公司合成。PCR 反应体系(20 μL):2× PCR Master mix 10 μL,ddH2O 8 μL,上、下游引物各0.5 μL,模板1 μL。PCR 反应条件:94 ℃预变性2 min;94 ℃变性30 s,56 ℃退火30 s,72℃延伸1 min,35 个循环;72 ℃延伸10 min。经1%琼脂糖凝胶电泳检测后,将PCR 产物委托哈尔滨擎科生物科技有限公司进行测序。测得的DNA序列同基因组GenBank 中公布序列进行同源性比对。
1.2 黑龙江省黄瓜链格孢叶斑病菌生物学特性研究
供试菌株为采集自齐齐哈尔1.1 中分离鉴定的病菌。
1.2.1 培养基对病菌菌丝生长及产孢量的影响 制备胡萝卜煎汁培养基(CA)、胡萝卜马铃薯煎汁培养基(PCA)、白菜煎汁培养基(CCA)、白菜马铃薯煎汁培养基(PCCA)(张俊华 等,2018)、马铃薯葡萄糖琼脂培养基(PDA)、马铃薯蔗糖琼脂培养基(PSA)、黄瓜煎汁培养基、黄瓜马铃薯煎汁培养基(吴桥,2017)。将菌株活化并打取直径0.75 cm 的菌碟,移至不同培养基平板上,28 ℃恒温黑暗培养6 d,采用十字交叉法测量菌落直径,每个处理5 次重复。待菌落长满培养皿后,用10 mL 无菌水洗下菌落表面孢子,制成孢子悬浮液,采用血球计数法测定孢子浓度,每个处理5 次重复。
1.2.2 营养因子对病菌菌丝生长及产孢量的影响以查氏培养基(Czapek)为基础培养基(王雪 等,2019),将其中的碳源依次等量替换为葡萄糖、蔗糖、果糖、乳糖、可溶性淀粉及甘露醇,并设缺碳对照,研究不同碳源对病菌菌丝生长及产孢量的影响。将氮源依次等量替换为磷酸氢二铵、甘氨酸、酵母浸粉、蛋白胨、硝酸钠,并设缺氮对照,研究不同氮源对病菌菌丝生长及产孢量的影响。将菌株活化并打取直径0.75 cm 的菌碟,移至不同培养基平板上,28 ℃恒温黑暗培养,菌落直径和产孢量的测定方法同1.2.1,每个处理5 次重复。
1.2.3 温度对病菌菌丝生长及产孢量的影响 将直径0.75 cm 的菌碟接种到PDA 平板上,依次在20、25、28、30、35、40 ℃培养箱中恒温黑暗培养,菌落直径和产孢量的测定方法同1.2.1,每个处理5次重复。
1.2.4 光照对病菌菌丝生长及产孢量的影响 将直径0.75 cm 的菌碟接种到PDA 平板上,依次放置在黑暗、光照、12 h 光照/12 h 黑暗培养箱内,28 ℃恒温培养,菌落直径和产孢量的测定方法同1.2.1,每个处理5 次重复。
1.2.5 pH 对病菌菌丝生长及产孢量的影响 将直径0.75 cm 的菌碟接种到不同pH 值(4、5、6、7、8、9、10、11、12)的PDA 平板上,28 ℃恒温黑暗培养,菌落直径和产孢量的测定方法同1.2.1,每个处理5次重复。
1.2.6 病菌致死温度的测定 将直径0.75 cm 的菌碟装入2.0 mL 离心管内,分别放入40、45、50、55、60 ℃恒温水浴锅中分别水浴5、10、15 min。水浴后,依次接种到PDA 平板上,28 ℃恒温黑暗培养6 d,每个处理5 次重复,观察菌株是否生长,确定菌株的致死温度。
1.2.7 数据处理与分析 采用DPS 数据处理系统进行方差分析,采用LSD 法对各组间数据进行差异显著性比较。
2 结果与分析
2.1 黄瓜链格孢叶斑病病原的分离与鉴定
2.1.1 田间症状调查 田间黄瓜链格孢叶斑病疑似病样主要危害黄瓜叶片,叶片正面和背面均可受害,病斑圆形或不规则形,4~5 mm,黄褐色至棕褐色,病斑周围有褪绿晕圈,发病严重时病斑连片,叶肉组织枯死,叶片似火烤状但不脱落(图1)。

图1 黄瓜链格孢叶斑病田间症状
2.1.2 致病性测定 分离得到的菌株于黄瓜第1片真叶展开时喷雾接种,7 d 后叶片出现褪绿斑,之后病斑连片,叶肉组织坏死;叶柄及茎部病斑初期水渍状,后变褐色,发病严重时叶片枯死(图2)。对接种发病的黄瓜组织再次分离,得到相同的病原菌。

图2 人工接种黄瓜链格孢叶斑病菌后植株发病症状
2.1.3 病原菌形态特征 病原菌在PDA 平板上培养,菌落初为白色,质地致密,之后菌落中心颜色逐渐加深呈棕黑色,菌落背面外缘白色,中间为棕黑色至纯黑色(图3-a、3-b)。分生孢子梗多分枝(图3-c)。分生孢子单生或串生,倒梨形、倒棍棒形、卵形或近椭圆形,淡褐色至褐色,有2~8 个横隔,0~4 个纵隔,有的有1~3 个斜隔膜,有的孢子呈网状分隔,孢子长8.0~62.0 μm,宽4.0~19.0 μm,有的孢子有2.0~20.0 μm 假喙,圆柱状,部分孢子的假喙有分枝(图3-d、3-e)。
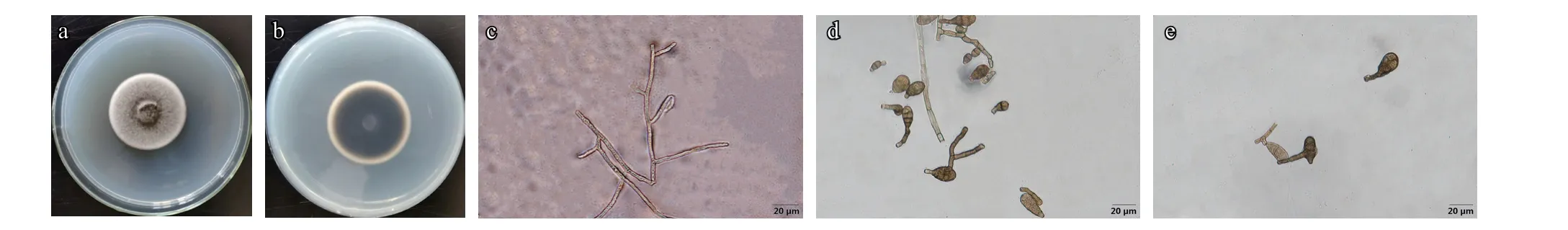
图3 黄瓜链格孢叶斑病菌形态
2.1.4 病原菌分子鉴定 采用rDNA ITS 和抗原相关蛋白Alt a 1 两对引物对病菌基因组DNA 进行PCR 扩增和测序,分别得到523 bp 和486 bp的条带(图4)。将测序所得序列进行BLAST 同源性比对,两序列结果均显示该病原菌与交链格孢Alternaria alternata的同源性达99%以上,结合病原菌的形态学鉴定结果,确定引起黑龙江省黄瓜链格孢叶斑病的病原菌为交链格孢Alternaria alternata。
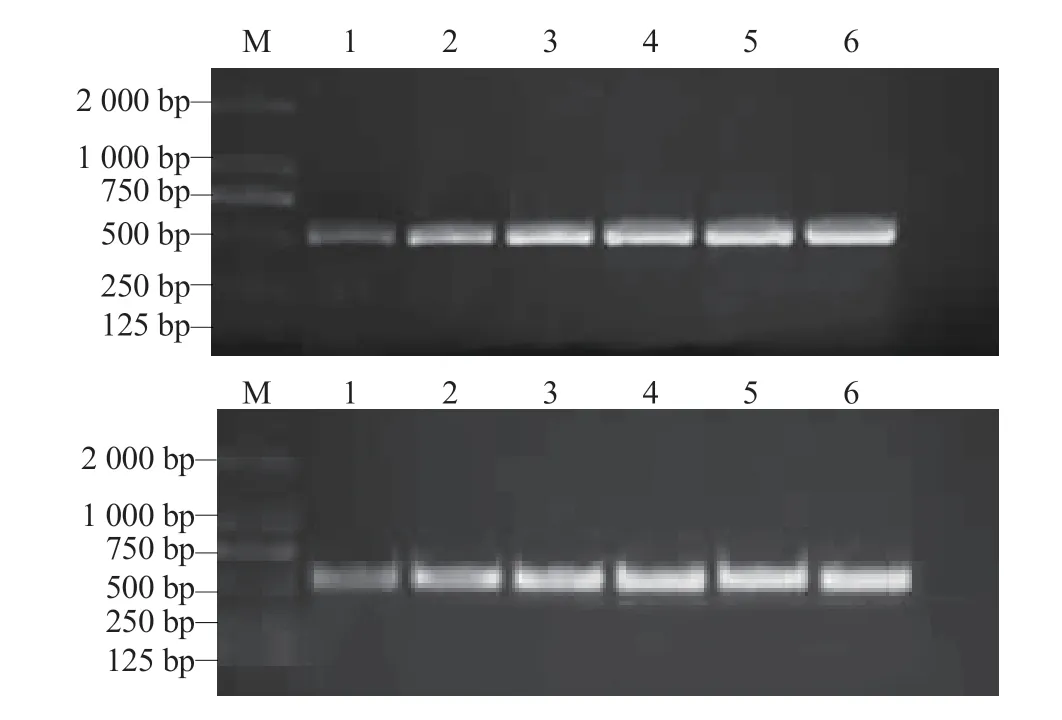
图4 菌株rDNAITS(上)、Alta1 序列(下)的PCR 扩增结果
2.2 黄瓜链格孢叶斑病菌生物学特性
2.2.1 培养基对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 菌株在CA 培养基和黄瓜煎汁培养基上菌丝生长较快,菌丝生长速度显著快于在PCCA、PSA、CCA、PDA 和PCA 培养基上的生长,在PCA 培养基上生长速度最慢(图5)。在PDA 和CA 培养基上病菌产孢量较高,其次为黄瓜煎汁培养基,CCA、PCA、PSA 和黄瓜马铃薯煎汁培养基上产孢较少,在PCCA 上未见产孢(图5)。

图5 培养基对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.2 碳源对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 当碳源为葡萄糖或蔗糖时,菌落直径最大,显著高于其他碳源处理。当碳源为果糖时病菌菌丝生长最慢。从产孢能力来看,葡萄糖最适合病菌产孢,产孢量最高,为1.56 × 106个·mL-1,显著高于其他碳源处理。产孢量的大小依次为:葡萄糖>蔗糖>乳糖>甘露醇>可溶性淀粉>果糖和缺碳对照(图6)。
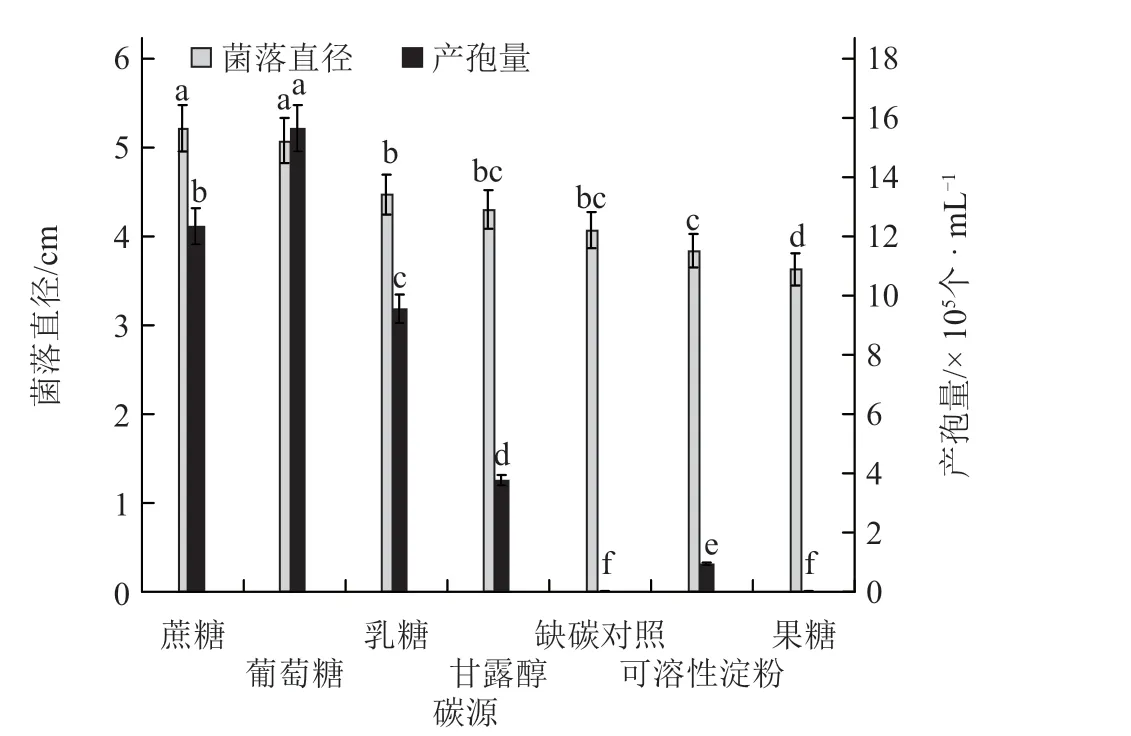
图6 碳源对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.3 氮源对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 相较于其他4 种氮源处理,蛋白胨处理的菌落直径最大,显著高于其他氮源处理。其次是酵母浸粉、甘氨酸和硝酸钠,磷酸氢二铵的效果最差。从产孢量来看,和菌丝生长的变化趋势基本一致,蛋白胨处理的产孢量最高,为7.31 × 105个 ·mL-1,产孢量大小依次为蛋白胨>酵母浸粉>甘氨酸>硝酸钠>磷酸氢二铵>缺氮对照(图7)。
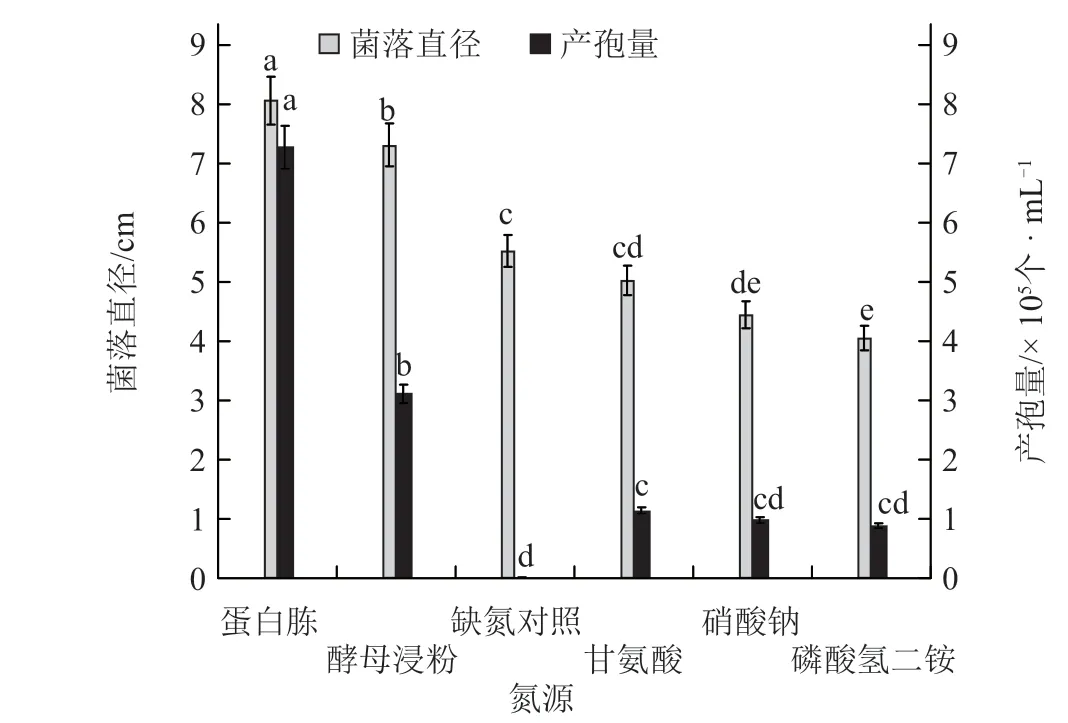
图7 氮源对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.4 温度对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 从图8 中可以看出,28 ℃时菌落直径最大,与其他处理具有显著差异,其次为25、20℃和30 ℃,35 ℃和40 ℃时菌落直径增长极其缓慢,已经非常不适合菌株生长。从产孢量来看,28℃时菌株产孢量最大,显著高于其他处理;25 ℃次之;30 ℃处理虽然比20 ℃处理的菌丝生长速率慢,但产孢量显著高于20 ℃处理;40 ℃时产孢量最低。
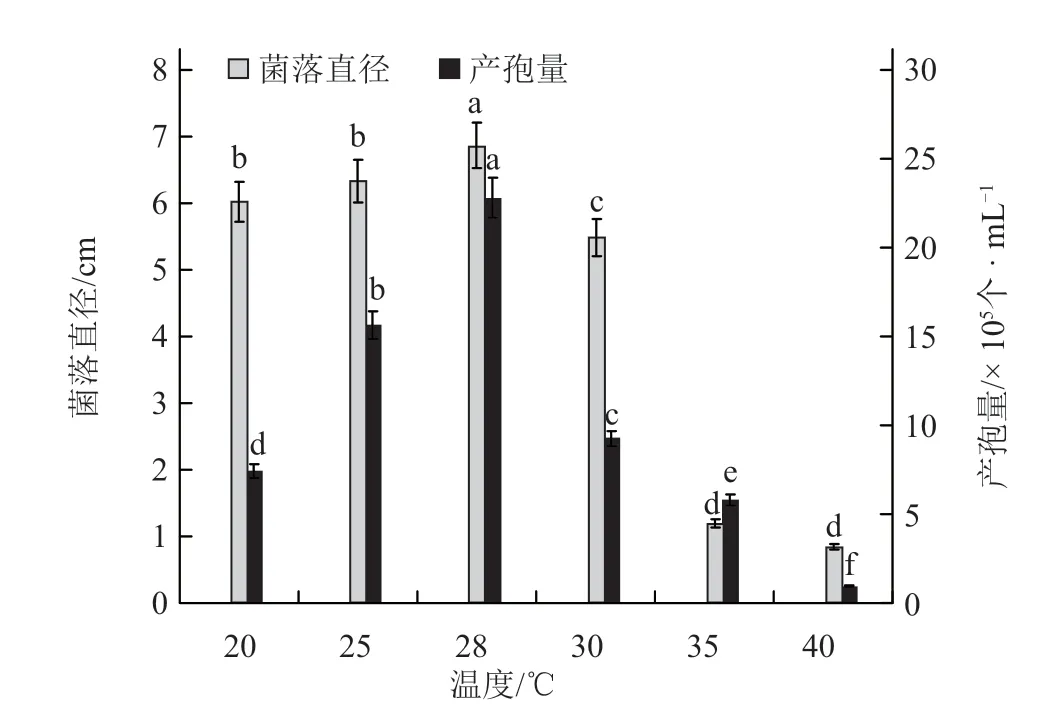
图8 温度对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.5 光照对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 不同光照处理下菌丝生长情况基本一致,各处理间差异不显著。从产孢量来看,光暗交替处理的产孢量最多,为2.08 × 106个·mL-1,显著高于24 h 黑暗处理(图9)。
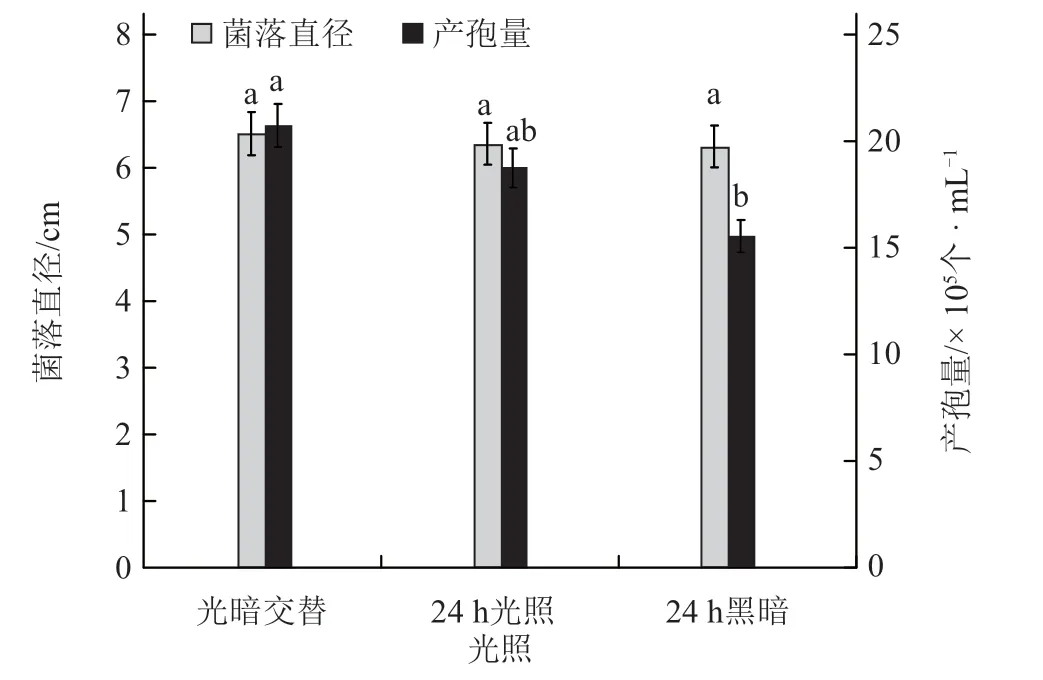
图9 光照对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.6 pH 对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响 菌丝在pH 4~12 时均能生长,但菌丝在pH 为8 和9 时生长速度最快,高于其他pH 处理,pH 为4 和11、12 时生长缓慢;病菌在pH 5~12范围内能够产孢,产孢的最适pH 为8~9,显著高于其他pH 处理(图10)。
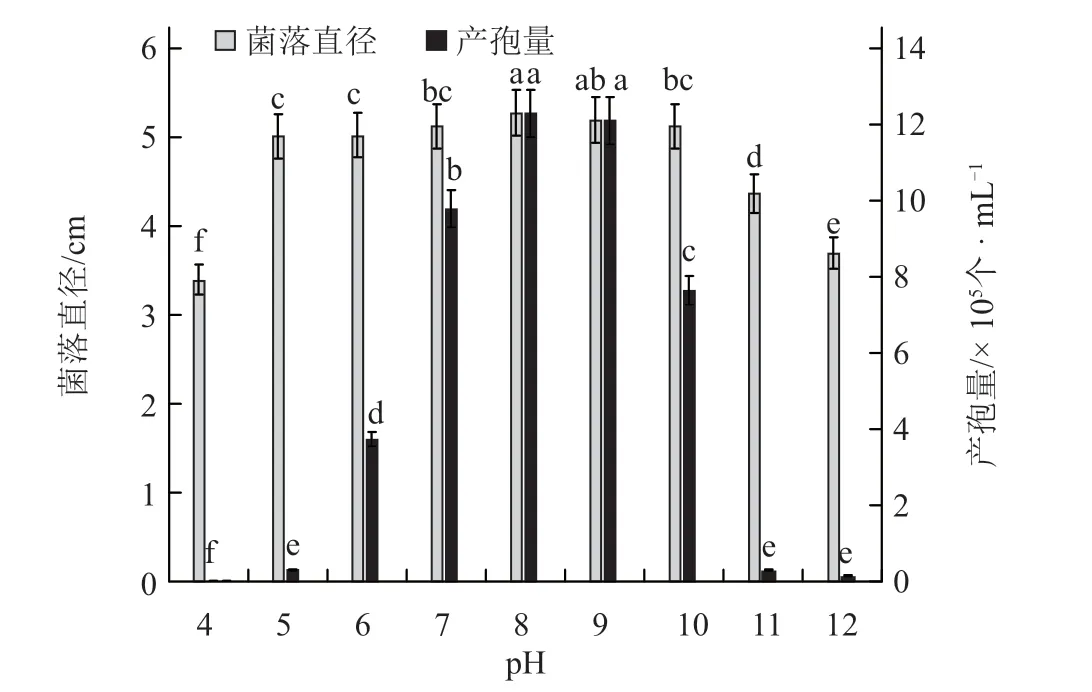
图10 pH 对黄瓜链格孢叶斑病菌菌丝生长及产孢量的影响
2.2.7 病菌致死温度 病菌在40、45、50 ℃恒温水浴锅中加热5、10、15 min,在28 ℃恒温黑暗培养6 d,在PDA 培养基上均可生长;55 ℃ 5 min 加热处理的菌株也可以生长,但55 ℃ 加热10、15 min 和60 ℃加热条件下菌株均不能生长。因此,病菌的致死温度是55 ℃ 10 min。
3 结论与讨论
链格孢属(Alternaria)真菌是一类重要的植物病原菌。一直以来,瓜链格孢A.cucumerina被认为是引起黄瓜叶斑病的主要病原菌(孙玉河 等,2012)。但贾菊生和李新辉(2002)、王莹莹(2016)等研究发现A.alternata、A.cucurbitae也可以侵染黄瓜引起病害。本文通过对黄瓜链格孢疑似病样的病菌进行形态及分子生物学鉴定,将黑龙江省齐齐哈尔黄瓜大棚内发生的叶斑病病原鉴定为A.alternata。
链格孢菌种类繁多,我国记载的链格孢属真菌有123 个种及变种(冯中红和孙广宇,2020),主要根据分生孢子形状、大小、颜色、分隔、喙的特征、成链特性、产孢表型对链格孢种进行划分(Neegaard,1945)。虽然根据形态可以区分大部分链格孢种,但是营养条件、温度、光照、pH 等环境条件极易影响链格孢的形态特性,尤其是对喙短或者无喙的小孢子种,导致种的鉴定更加困难(冯中红和孙广宇,2020)。而分子生物学鉴定为链格孢种的鉴定提供了有力手段,ITS、ATP、gpd、CAL、actin 等序列已用于区分链格孢属及其相近属,尤其Alt a 1 是链格孢属真菌特有序列,在链格孢属真菌尤其是小孢子种中差异性较大,可将77%以上的供试菌株鉴定到种,已逐渐被广泛应用于链格孢种的分类鉴定(Miguel et al.,2010)。因此本文采用菌株ITS 序列和Alt a 1 序列相结合,确定引起黑龙江省黄瓜链格孢叶斑病的病原为Alternaria alternata。
Alternaria alternata寄主广泛,可引起木薯白点病、水稻褐变穗病、紫花苜蓿斑点病等病害。尽管已有A.alternata生物学特性的研究,但在不同作物上已有的研究结果并不一致(聂启军 等,2016;马连杰 等,2018;张俊华 等,2018;郑肖兰 等,2018;蔡吉苗 等,2019;方婷,2019)。本试验对黑龙江省采集的A.alternata生物学特性研究表明,菌丝生长最快的培养基是CA 和黄瓜煎汁培养基;最适碳源为葡萄糖和蔗糖,氮源为蛋白胨;最适培养条件为28 ℃,pH 8~9;致死温度为55 ℃ 10 min;光照对菌丝生长的影响不大。最适合病菌产孢的培养基为PDA 和CA 培养基,最适碳源和氮源分别为葡萄糖和蛋白胨,培养条件为28 ℃、pH 8~9、12 h 光照/12 h 黑暗时产孢量最大。
黄瓜链格孢叶斑病为气传病害,病菌在病残体及种子上越冬成为翌年初侵染源。种子带菌是病害远距离传播的重要途径,也是常发区初侵染源之一。本试验结果表明,Alternaria alternata的致死温度是55 ℃ 10 min,可以利用这一特性,在播种前对黄瓜种子进行温汤处理,对于未发生地区可以从源头上杜绝病害的发生,常发区也可以减轻由种子带菌所造成的损失。在黄瓜的保护地生产中,农民通常会采用高温闷棚的方法来防治黄瓜霜霉病等病害。高温闷棚的最佳温度是45 ℃,低于42 ℃效果不好,高于48 ℃植物生长会受害(杨海燕 等,2019)。而本试验结果显示,黄瓜链格孢叶斑病菌的最适培养条件为28 ℃,35 ℃及40 ℃时虽然病菌生长受到抑制,但尚可存活,只有在55 ℃以上时才完全不能生长。因此在生产中如果采用高温闷棚的方法,虽然可以使病菌生长受到抑制,但不能完全致死,一旦环境条件适合还会继续危害。
Alternaria alternata菌丝生长和产孢最适的pH为8~9,即在弱碱性条件下菌丝生长较快,产孢量大。pH 5~7 时即中性偏酸条件下,菌丝生长较缓慢,尤其是产孢量显著降低。根据这一特性,在有黄瓜链格孢叶斑病发病的田块,可尽量选择弱酸性的叶面肥以及农药,以达到更好的防治效果。
本试验明确了黑龙江省黄瓜链格孢叶斑病菌生长与环境条件的关系,对于病害综合防治具有重要意义。

