原位肝移植供肝动脉变异处理的效果分析
汤睿,李昂,侯昱丞,吴广东,童翾,周虎,徐光勋,宋继勇,于里涵,卢倩
清华大学附属北京清华长庚医院肝胆胰中心 清华大学临床医学院 清华大学精准医学研究院,北京 102218
肝动脉变异常见,分型繁多。肝移植术后肝动脉狭窄(hepatic artery stenosis,HAS)或肝动脉栓塞(hepatic artery thrombosis,HAT)是严重的并发症,可继发胆道并发症、移植物丢失甚至造成受者死亡[1]。供肝动脉变异时可能延长移植物冷缺血时间,增加肝动脉并发症发生风险并影响移植后移植物存活率及受者生存率[2]。目前供肝动脉变异处理方式的种类较多,存在争议,手术技巧要求较高。本文分析原位肝移植供肝动脉变异的处理方式和手术效果。
资料与方法
一、一般资料及纳入和排除标准
回顾性分析2018年7月至2020年6月在清华大学附属北京清华长庚医院接受肝移植手术受者的临床病理资料和供肝动脉资料。纳入标准:(1)因各类终末期肝胆病行同种异体原位肝移植手术;(2)受者年龄18~70岁;(3)供者年龄18~60岁。排除标准:(1)受者肝移植术前增强CT评估肝动脉存在“替代肝(左/右)动脉”变异情况;(2)受者术前影像学提示腹腔干、肝动脉、胃十二指肠动脉(gastroduodenal artery,GDA)、脾动脉曾行介入钢圈栓塞术或存在动脉瘤、动脉夹层等病变;(3)受者非首次肝移植;(4)供肝体外修整中发现必须保留的肝动脉存在夹层、动脉瘤、损伤等病变;(5)受者术后6个月内因非动脉非胆道相关并发症死亡;(6)失访或临床病理资料不全。
二、肝移植术式和动脉重建评判标准
肝移植手术方式为原位肝移植,包括经典肝移植和改良背驮式肝移植。供肝体外修整中发现肝动脉变异,根据动脉情况决定是否需进行体外重建。由1名拥有50例以上供肝修整经验的术者进行初步评判,如认为需重建则由熟练操作动脉吻合的高年资肝脏移植医师进行再次评判和血管吻合。评判标准:(1)替代肝左/右动脉常规重建;(2)变异肝动脉直径≥2 mm常规重建;(3)变异肝动脉直径<1 mm常规不重建;(4)存在副肝左/肝右动脉且直径介于1~2 mm则使用肝素盐水通过肝总动脉(common hepatic artery,CHA)进行加压灌注,若副肝动脉可见灌注液涌出则不予重建;(5)存在变异动脉但血管环路保留完整,可用腹腔干与受者动脉吻合,则不一定重建。所有变异肝动脉重建均在体外供肝修整时完成,无植肝后体内重建。供、受者吻合口两侧的动脉均送病理检测。胆道吻合常规采取5-0或6-0可吸收PDS缝线连续缝合,缝合前确认两侧血供良好。
三、术后处理
常规采取术中+术后第4天巴利昔单抗诱导,激素+他克莫司+霉酚酸酯类联合的抗排斥方案,肿瘤受者在移植术后第3~5周逐步将他克莫司过渡为雷帕霉素。供肝动脉存在变异重建受者术后3 d内采取泵入肝素的方式维持活化部分凝血活酶时间(APTT)目标值40~60 s,后改为预防剂量低分子肝素皮下注射。至术后第10~12天改为口服抗凝/抗血小板药利伐沙班/阿司匹林。若改为阿司匹林则与低分子肝素重叠使用3 d,抗凝/抗血小板至术后第3~6个月。无变异受者术后低分子肝素皮下注射至第7天后改为口服利伐沙班或阿司匹林至术后1个月。受者凝血功能较差或有活动性出血时不进行常规抗凝/抗血小板。所有受者术后均采取前列地尔40 μg/d持续泵入,第5天后改为10 μg/d静脉点滴维持5~7 d后停用。术后第1周每日检查肝动脉超声,第2周改为隔日,出院后每次随访均检查。
四、肝动脉并发症的定义
HAT定义为超声不可见肝内动脉血流,且增强CT证实肝动脉未显影。HAS定义为超声提示肝动脉阻力指数<0.5或>0.8,收缩加速时间>0.08 s,且增强CT证实肝动脉纤细,显示欠清(狭窄超过70%)。术后2周内发生的HAS或HAT定义为早期,2周后定义为晚期。
五、随访
采取电话及门诊方式随诊,了解受者生存情况、肝功能化验指标和影像学检查情况,本研究的随访时间截至手术后6个月。
六、统计学方法
采用SPSS(21.0版)统计学软件进行分析处理。偏态分布的计量资料以中位数(范围)表示。计数资料以绝对数表示。正态分布的连续变量采取t检验。两组间肝动脉和胆道并发症发生率采取χ2检验。P<0.05认为差异有统计学意义。
结 果
一、一般资料
研究期间接受肝移植手术219例,其中无变异组(Michel′s Type Ⅰ)183例(83.6%),变异组36例(16.4%)。变异的肝左动脉(variational left hepatic artery,vLHA)发自胃左动脉(left gastric artery,LGA)(Michel′s Type Ⅱ/Ⅴ)17例(7.8%),变异的肝右动脉(variational right hepatic artery,vRHA)发自肠系膜上动脉(superior mesenteric artery,SMA)(Michel′s Type Ⅲ/Ⅵ)13例(5.9%),vLHA发自LGA同时vRHA发自SMA(Michel′s Type Ⅳ/Ⅶ/Ⅷ)4例(1.8%),CHA发自SMA(Michel′s Type Ⅸ)1例(0.5%),其他1例(0.5%)[3]。
最终入组研究184例,均获得随访。无变异组149例,年龄50岁(28~69岁),女性25例,男性124例。变异组35例,年龄49岁(27~69岁),女性11例,男性24例。无变异组手术时间、移植物冷缺血时间与变异组比较,差异均无统计学意义(表1)。所有受者和供者术前巨细胞病毒感染IgM、DNA均为阴性,IgG均为阳性,均为血型相合移植。
二、肝动脉的处置方式和植入后吻合方式
无变异组采取供肝肝固有动脉(proper hepatic artery,PHA)/CHA-受者PHA/CHA吻合。变异组重建方式包括:vRHA与GDA/脾动脉吻合;vLHA与GDA/胃右动脉(right gastric artery,RGA)/脾动脉/腹腔干吻合;vRHA发自SMA,vLHA发自LGA,vLHA与SMA发出vRHA上的胰十二指肠下动脉分支吻合;变异肝动脉结扎;变异动脉未做特殊处理即可重建(表2)。体外肝动脉重建均在2.5倍放大镜下以8-0 Prolene不可吸收缝线间断缝合。体内供受者动脉吻合均在2.5倍放大镜下以7-0或8-0 Prolene不可吸收缝线连续缝合(图1)。无变异组3例手术中同时结扎脾动脉,变异组1例。

表2 供肝动脉变异肝移植的变异类型、体外重建方式和供受者动脉吻合方式
三、术后并发症
无变异组住院时间18 d(13~27 d),围手术期3~4级并发症 7例,均非肝动脉并发症。肝动脉并发症17例:HAS 16例,其中6例早期;HAT 1例,为晚期,发生时为术后3个月。增强CT提示吻合口狭窄3例,其余均表现为非吻合口的血管段狭窄。经讨论认为其中5例和动脉过长相关,4例和脾动脉窃血相关。变异组住院时间16 d(12~39 d),围手术期3~4级并发症2例,其中1例肝动脉并发症。肝动脉并发症7例:HAS 6例,其中2例早期;HAT 1例,为早期。增强CT提示均为非吻合口的血管段狭窄,未见明确吻合口异常。经讨论认为其中4例和肝动脉过长相关,1例和脾动脉窃血相关。4例结扎脾动脉受者肝动脉均正常。两组HAS考虑脾动脉窃血病人,术后增强CT测量脾动脉/肝总动脉直径比值均>3,且血常规显示白细胞和血小板较低的脾功能亢进表现,其中3例接受介入栓塞术,术后白细胞及血小板指标有所改善,但肝动脉血流改善不明显。动脉变异不增加总体、早期、晚期肝动脉并发症发生风险(P>0.05)(图2)。无变异组HAS和HAT,变异组HAS均采取抗凝或抗血小板保守治疗。变异组HAT受者经抗凝和再次手术后仍发生肝脓肿,最终接受二次肝移植。其二次肝移植时仍存在供肝肝右动脉变异(vRHA发自SMA),采取vRHA-GDA重建方式,术后未再发生并发症。使用雷帕霉素病人均未观察到HAS或HAT发生。
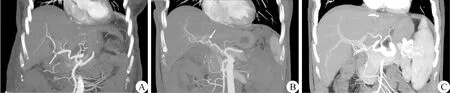
图2 供肝动脉变异肝动脉重建肝移植术后增强CT图像(vRHA.变异的肝右动脉;GDA.胃十二指肠动脉;vLHA.变异的肝左动脉;SA.脾动脉) A.供肝vRHA与GDA吻合(箭头所示)移植术后增强CT;B.供肝vLHA与GDA吻合移植术后增强CT(箭头所示为血管吻合口);C.供肝vLHA和SA吻合同时vRHA和GDA吻合移植术后增强CT
至随访结束,无因肝动脉或胆道并发症发生死亡病例。无变异组胆道并发症发生率为8.1%,其中胆漏5例,胆道狭窄7例。2例胆道狭窄与术后早期肝动脉狭窄相关,经内镜逆行性胰胆管造影术(ERCP)后好转。变异组胆道并发症发生率为8.6%,其中胆漏1例,ERCP后好转,胆道狭窄2例,均无肝动脉并发症。两组病人的胆道并发症发生率相似(P>0.05),供肝动脉变异不增加移植术后胆道并发症发生率(表1)。
讨 论
肝动脉变异率为30%~40%,其中最常见的是发自LGA的vLHA和发自SMA的vRHA[4]。供肝获取和修整的过程中,应特别注意变异肝动脉存在,并尽可能不造成损伤。保留完整的变异肝动脉及其主干,包括vRHA-SMA路径,vLHA-LGA-腹腔干环路。同时保留路径上足够长度的GDA、RGA、脾动脉等属支,以备后续进行重建。随着血管吻合技术的进步,单纯吻合口狭窄造成的肝动脉并发症占比较少,我们的研究提示有12.5%的狭窄发生在吻合口,其余均表现为血管段的异常,因此非吻合口因素引起的肝动脉并发症值得关注。
移植术后应对肝动脉血流进行严格检测,通常在术后1~2周内每天进行血流监测,以利于早期发现动脉并发症,在后续的随访中也应常规进行肝动脉检查。目前尚无统一的术后抗凝意见,但针对肝动脉变异重建受者,多数研究推荐常规进行抗凝,包括使用肝素等抗凝血药物或阿司匹林等抗血小板药物[5]。HAT的诊断基于超声未见动脉血流,增强CT或血管造影无动脉显影,术中探查确认血栓形成[6]。早期HAT的主要危险因素包括供者巨细胞病毒感染阳性而受者阴性,再次移植手术,动脉插管操作病史,手术时间过长,受者体重过低,动脉变异,移植中心手术量小[7]。有研究认为存在肝动脉变异并进行复杂重建之后,增加术后早期肝动脉并发症发生风险和移植物丢失率,但如果尽早发现并进行处理则不影响受者和移植物长期存活。吻合口返修或者取栓并不能很好地改善供肝丢失率,介入治疗的效果也不够理想。发生HAT后大多数病人需要再次肝移植[8]。HAS可以采取抗凝或抗血小板治疗,也可以采取介入治疗,早期诊断并治疗能够降低胆道并发症发生风险。
肝移植2周后随着侧支血管新生,肝脏可从肝十二指肠韧带、膈肌等方向获得新生动脉血供,因此发生晚期肝动脉并发症不一定影响肝功能或造成胆道狭窄[9]。部分受者增强CT检查可见吻合口区域肝动脉狭窄闭塞,但肝内动脉显影良好,超声也可见较为满意的肝内动脉血流,此时仅采用药物保守治疗即可。尤其是针对移植术后6个月以上的迟发性HAS和无症状受者,过度的干预是不必要的[10]。
与体内重建相比,体外重建需要更长的体外供肝处理时间,但会缩短在体重建的动脉热缺血时间。同时体外重建的动脉可以多角度翻转,以便于缝合,且不受呼吸、循环影响,操作相对容易。早期报告vRHA常与脾动脉吻合,但近期的研究逐渐认同使用GDA进行重建,管径匹配度和血管解剖形态上更适宜[11-12]。有研究认为合并vLHA时发生胆道并发症的概率更高,因为很多vLHA不会被重建[13]。但如果确认是副肝左动脉则影响较小,检查方式可以通过CHA灌注,或者供肝植入动脉吻合后检查副肝左动脉返血情况确认[14]。我们的研究中结扎及重建的vLHA共20例,其中9例可以直接结扎,无需重建;结扎及重建的vRHA共16例,其中13例与GDA吻合重建。有研究认为变异动脉容易留的长,而血管保留过长是HAT的危险因素,动脉变异本身不是[15]。虽然很多vLHA-LGA-腹腔干环路得以保留,我们仍然选择离断vLHA而进行短距离的重建,这样可以避免保留一个过长的肝左动脉环路引发血管弯折。vLHA往往直径偏细,但如果尺寸匹配,也可以和供肝的脾动脉或腹腔干进行吻合。同理,针对vRHA也建议截取靠近肝脏的短距离动脉,而非使用过长的vRHA-SMA整段进行重建。过长的血管路径发生弯折后易继发HAT。血管间置架桥也是重建方式之一,可以利用髂动脉的Y型管路对变异肝动脉和PHA进行重建,研究认为这种方式可以获得较为理想的血管直径,并且不会发生明显的扭曲[16]。
在我们的研究中发现部分HAS的受者,尤其是术前脾大脾亢较为明显者,脾动脉直径明显增粗。虽然术后超声仍可证实肝动脉尚有满意的峰值流速,但是阻力指数较大,增强CT检查显示肝动脉纤细。这些受者HAS和动脉变异无关,而是脾动脉窃血,肝动脉血流不足造成的。有研究推荐术中一期结扎脾动脉,指征为受者脾动脉/CHA直径>1.5或脾动脉直径>5 mm。脾动脉转位替代CHA与供肝血管吻合或术后脾动脉栓塞也是可选治疗方式[17-18]。本研究中几例术后认为脾动脉窃血引起肝动脉并发症的病人,因术中判断肝动脉直径尚可,血流量充足,故没有在术中一期进行结扎。但吻合后动脉可能发生痉挛,进而促进窃血加重导致狭窄。术后窃血导致肝动脉并发症再进行栓塞效果并不显著,病人栓塞前肝功能没有明显异常,栓塞可能带来感染风险,并且手术2周后肝周动脉血流逐渐重构,所以我们没有对所有病人进行介入栓塞。考虑术后介入治疗挽救效果有限,我们推荐术中一期积极进行脾动脉结扎以降低并发症发生风险。肝移植术前的经肝动脉介入治疗可能损伤血管内膜,边缘供肝或高龄肥胖受者肝动脉可能存在硬化斑块,影响移植后动脉血流,因此我们常规留取供受者肝动脉吻合部位标本进行病理检测[19]。在我们的研究中动脉标本均未见明显病变,因此认为动脉条件本身不会影响本研究结果。有研究认为雷帕霉素的应用会增加肝动脉血栓形成的风险,我们的研究尚未发现服用雷帕霉素后变异肝动脉发生并发症的情况,但应注意对此类病人的动脉血流进行严密监测。
体外重建可以很好地重构具有肝动脉变异的供肝动脉路径。vRHA常需要重建,与GDA吻合是主要方式;vLHA常无需重建。供肝动脉变异不增加肝移植术后动脉、胆道并发症发生风险。动脉重建过程中应避免残留过长的血管路径造成弯折。供肝动脉变异重建后建议抗凝治疗。

