血清ACA、TIMP-1水平与急性脑梗死患者病情程度的关联性
李寒冰
(濮阳市人民医院 检验科,河南 濮阳 457000)
急性脑梗死(acute cerebral infarct,ACI)是缺血性脑血管疾病,占脑血管疾病的70%,致残、致死率高,存活患者中50%以上会伴有肢体功能障碍,给家庭带来沉重负担[1]。分析影响ACI疾病转归的血清学指标是目前临床研究的重点。动脉粥样硬化是诱发ACI的重要因素,抗心磷脂抗体(anticardiolipin antibody,ACA)具有自身免疫病理作用,有助于促进动脉粥样硬化进程[2]。基质金属蛋白酶可降解细胞外基质,促使神经元凋亡,造成神经元损伤,在ACI发病过程中有重要作用[3]。金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)是基质金属蛋白酶抑制剂,可明显降低基质金属蛋白酶活性,发生ACI后呈高水平表达。本研究选取2018年4月至2020年10月濮阳市人民医院收治的85例ACI患者作为研究对象,分析血清ACA、TIMP-1与ACI转归的关系。
1 资料与方法
1.1 一般资料选取2018年4月至2020年10月濮阳市人民医院收治的85例ACI患者作为研究对象,其中男47例,女38例;年龄54~71岁,平均(62.75±3.97)岁;体质量指数18.9~23.8 kg·m-2,平均(21.38±1.08)kg·m-2;单发病灶51例,多发病灶34例;腔隙性脑梗死27例,大动脉粥样硬化性脑梗死28例,心源性脑梗死30例。另选取同期50例健康体检者为对照,其中男29例,女21例;年龄52~75岁,平均(63.18±4.06)岁;体质量指数18.2~24.1 kg·m-2,平均(21.50±1.15)kg·m-2。ACI患者与健康体检者性别、年龄、体质量指数比较,差异无统计学意义(P>0.05)。入组对象自愿参与本研究并签署知情同意书。本研究经濮阳市人民医院医学伦理委员会审批通过。
1.2 选取标准(1)纳入标准:①ACI患者经MRI、CT检查确诊,且为首次发病;②无脑血管疾病病史;③脑梗死发作24 h内入院;④合并神经功能损伤;⑤临床资料完善;⑥近1个月未服用激素、肾上腺素、免疫抑制剂等相关药物。(2)排除标准:①合并糖尿病;②严重肝、肾功能异常;③溶栓治疗;④合并感染性疾病。
1.3 检测方法健康体检者于体检时、ACI患者于入院次日及第1、2、3、4周抽取空腹静脉血,离心处理(离心3 min,离心半径8 cm,转速4 000 r·min-1),取上层清液置于-80 ℃保存,以酶联免疫吸附试验检测ACA、TIMP-1水平,试剂盒购自威海威高生物科技有限公司。
1.4 观察指标(1)健康体检者与入院次日ACI患者ACA阳性率,以均数±2.58×标准差计算的健康体检者ACA指数作为正常值上限,超出正常值即为阳性。(2)入院次日不同美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分ACI患者ACA阳性率。NIHSS评分范围0~42分,根据病情严重程度分为3级,<5分为轻度,5~20分为中度,>20分为重度。(3)入院次日不同数量梗死病灶ACI患者ACA阳性率。(4)ACA阳性ACI患者连续4周ACA阳性率。(5)入院后不同时间ACI患者TIMP-1水平及健康体检者TIMP-1水平。(6)入院次日不同NIHSS评分ACI患者TIMP-1水平。

2 结果
2.1 ACA阳性率85例ACI患者共检出ACA阳性52例,50例健康体检者中共检出ACA阳性8例。入院次日ACI患者ACA阳性率[61.18%(52/85)]较健康体检者[16.00%(8/50)]高(P<0.05)。
2.2 入院次日不同NIHSS评分ACI患者ACA阳性率入院次日不同NIHSS评分ACI患者ACA阳性率比较,差异有统计学意义,随NIHSS评分提高,ACA阳性率升高(P<0.05)。见表1。
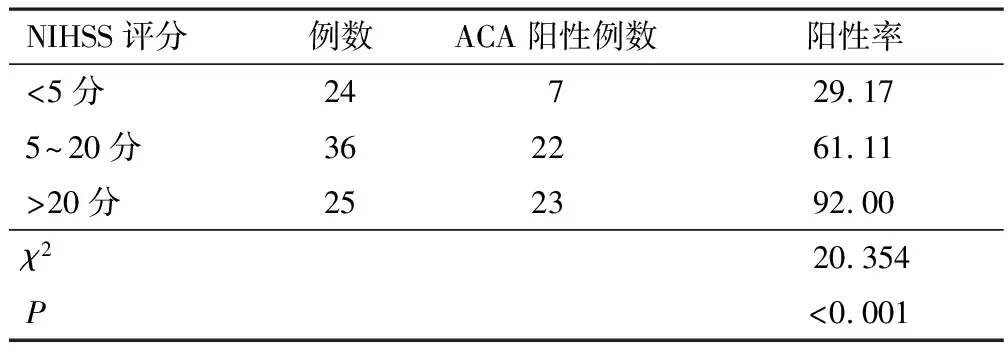
表1 不同NIHSS评分ACI患者ACA阳性率比较(n,%)
2.3 入院次日不同数量梗死病灶ACI患者ACA阳性率入院次日多发病灶ACI患者ACA阳性率高于单发病灶患者(P<0.05)。见表2。

表2 不同数量梗死病灶ACI患者ACA阳性率比较(n,%)
2.4 ACA阳性ACI患者连续4周ACA阳性率ACA阳性ACI患者连续4周ACA阳性率比较,差异有统计学意义,且呈下降趋势(P<0.05)。见表3。
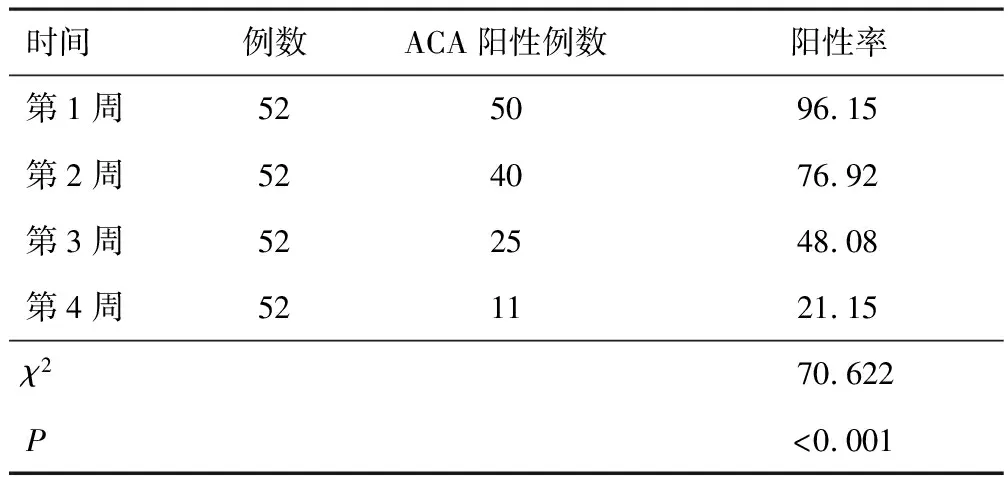
表3 ACA阳性ACI患者连续4周ACA阳性率比较(n,%)
2.5 TIMP-1水平健康体检者TIMP-1水平为(3.08±0.62)μg·L-1,ACI患者入院次日及第1、2、3、4周TIMP-1水平分别为(7.90±1.74)、(7.05±0.92)、(5.86±1.10)、(4.58±0.87)、(3.87±0.71)μg·L-1。ACI患者入院次日及第1、2、3、4周TIMP-1水平均高于健康体检者(t1=18.871、t2=27.088、t3=16.389、t4=10.692、t5=6.536,P<0.001)。ACI患者TIMP-1水平随入院时间延长呈下降趋势(P<0.05)。
2.6 入院次日不同NIHSS评分ACI患者TIMP-1水平入院次日不同NIHSS评分ACI患者TIMP-1水平比较,差异有统计学意义,随NIHSS评分提高,TIMP-1水平升高(P<0.05)。见表4。

表4 不同NIHSS评分ACI患者TIMP-1水平 比较
3 讨论
ACI是严重脑血管疾病,预后较差,寻找可评估ACI患者病情程度及预后的血清标志物有重要意义。相关研究认为,凝血及纤溶功能是确保血液流动的基础,其功能紊乱与ACI发病密切相关[4]。ACA抗磷脂活性高,是以内皮细胞及血小板带负电荷的心磷脂为靶抗原的抗体,主要作用于神经元及血小板、血管内皮细胞膜表面的磷脂抗原,通过改变细胞结构影响其功能,对促进血栓形成有积极作用。血清ACA可直接诱发血液高凝状态,相关研究表明,ACA是缺血性脑血管疾病的独立危险因素,有助于促进动脉粥样硬化发生、进展[5]。本研究结果显示,入院次日ACI患者ACA阳性率高于健康体检者,说明将血清ACA应用于ACI临床诊疗有积极作用。ACA通过结合血管内皮细胞膜磷脂而损伤内皮细胞,减少花生四烯酸的释放,不利于前列环素及前列腺素合成,激活血小板,促使血栓形成。ACA对凝血系统有一定影响,蛋白C缺失可促使静脉血栓形成,而ACA与磷脂结合后会降低蛋白C活性;胎盘抗凝蛋白对磷脂介导的凝血酶原激活有积极作用,而ACA与胎盘抗凝蛋白具有竞争性结合磷脂的作用,干扰胎盘抗凝蛋白的抗凝效果。进一步分析显示,NIHSS评分越高、梗死病灶数量多,ACA阳性率越高,且随入院时间延长,ACA阳性率有所降低,均表明血清ACA阳性率越高,ACI患者病情越严重。
TIMP-1是基质金属蛋白酶特异性抑制剂,可与基质金属蛋白酶以共价键形式结合成1∶1复合体,从而降低基质金属蛋白酶活性。有研究指出,TIMP-1可在脑缺血缺氧时特异性拮抗基质金属蛋白酶,以达到保护脑神经、缓解脑水肿的作用[6]。另有研究认为,TIMP-1是脑梗死后认知障碍的保护因素,ACI发生后其水平迅速上升以减轻脑组织损伤[7]。本研究结果显示,ACI患者入院次日及第1、2、3、4周TIMP-1水平均高于健康体检者,说明通过检测血清TIMP-1水平有助于判断ACI患者的病情程度。随入院时间延长,血清TIMP-1水平呈下降趋势,是由于入院治疗后病情有所缓解。血清TIMP-1水平上升是ACI发生后机体内源性保护机制,可在一定程度上减轻基质金属蛋白酶造成的神经功能损伤。本研究结果显示,不同NIHSS评分ACI患者TIMP-1水平比较差异有统计学意义,且随NIHSS评分提高,TIMP-1水平升高,进一步证实TIMP-1可反映ACI患者病情程度,对临床诊疗有积极作用。
综上,血清ACA、TIMP-1水平检测对评估ACI病情程度有积极作用,ACA阳性率高、TIMP-1水平高提示患者病情程度较重,可作为判断病情程度及短期预后的标志物。

