聚乳酸/羟基乙酸可降解药物释放支架的探索>
刘琳琳,秦娟,曾楚慧,杜瑞杰,陆骊工,陈磊,滕皋军,朱海东,何仕诚>
消化道良性狭窄多见于食道反流、食道腐蚀、克罗恩病、胆道吻合术后及食管、胃吻合术后[1]。吞咽困难及消化液潴留是该类疾病最常见的症状,并最终导致患者营养不良、体重减轻和生活质量下降等[2- 3]。良性食管狭窄是食管良性疾病中最常见的类型,内镜下食管扩张是目前临床上主要治疗方法[4- 6],但相当一部分患者需要反复扩张,致其生活质量下降、且增加医疗成本[7]。暂时性植入支架可有效延长通畅时间,但传统金属支架植入后须二次手术取出,且支架植入部位的组织增生常导致支架嵌入食管腔内,增加取出的难度及患者的痛苦[4,8- 9]。为了解决这些问题,生物可降解支架被认为是一种很有前途的替代材料,在临床上有广泛的应用前景[10- 12]。临床研究表明,对于难治性的良性食管狭窄,扩张后放置可吸收支架可有效延长扩张后食管通畅的时间以及降低再狭窄发生率[10]。鉴于此,本实验将生物可降解的聚乳酸/羟基乙酸(polylactic acid- co- glycolic acid, PLGA)与抗增殖药物紫杉醇(paclitaxel,PTX)相结合,探索PLGA作为制备载药生物可降解支架材料的生物相容性和可行性,为后期研发可应用于治疗良性消化道(食管、胆道等)狭窄的生物可降解载药支架作准备。
1 材料和方法
1.1 材料
1.1.1 膜片制备 将PLGA(0.85 dl·g-1,LA/GA 50/50,山东省医疗器械研究所)与PTX(C47H51NO14,≥98%,南京格鲁科生物科技有限公司)按照质量比10∶0、9∶1和8∶2比例混合,溶解在二氯甲烷中得到药物含量分别为0、10%和20% 3种混合溶液。然后将混合溶液浇筑在玻璃培养皿中,待二氯甲烷充分挥发干燥后得到含有不同药物浓度的PTX- PLGA膜,将制备好的PTX- PLGA膜片通过扫描电镜观察其表面特征及药物分布情况。
1.1.2 细胞提取 新西兰白兔由东南大学医学院实验动物中心提供,所有方案均已获得本机构动物研究委员会的批准,并按照国际动物保护理事会的指导进行。取10~11周龄、2.3~3.8 kg的健康兔,雌雄不限,用1.5 ml 4% NaOH腐蚀兔食管,注射时间持续30 s,造成食管的良性狭窄,随后立即用生理盐水反复冲洗3次,避免残留腐蚀剂继续对食管造成损伤。操作结束后对所有动物不禁食、不禁饮,每天观察动物的进食量及活动度等状态,每周测量动物体重。食管造影检查每两周进行1次,当腐蚀处食管最狭窄处达到正常食管最大处直径的1/2时即为造模成功。造模成功后处死并取狭窄段的食管,采用干贴壁法提取食管成纤维细胞。培养至第3~5代细胞进行后续实验。
1.2 方法
1.2.1 体外降解实验 通过在pH值为7.4和4.0两种磷酸盐缓冲生理盐水(PBS)中孵育测定PTX- PLGA膜在质量损失方面的降解行为。将制备好的载药PLGA膜片裁剪成1 cm×1 cm大小的正方形膜片,将预称重的标本随机分为两组,分别放入两种pH的PBS 3 ml,于37 ℃、110 r·min-1的恒温振荡器中降解,在每个实验时间点回收3个重复的样品。质量损失是通过计算某一特定时间点剩余的干重量与初始重量来确定。
1.2.2 体外药物释放 将1 cm2膜片置于3 ml PBS中(pH=7.4, pH=4.0),按照指定时间定期取出释放介质作为样品,并换上新鲜3 ml PBS继续进行药物释放。将取出的样品加入1 ml二氯甲烷萃取过滤后进行HPLC检测。
1.2.3 细胞毒性检测 用不载药的1 cm2膜片与培养基共同孵育24 h后制备成浸提液,用无菌微孔滤膜过滤后备用。将浸提液设置为4个不同的梯度(100%、75%、50%、25%),与提取的成纤维细胞分别共培养,24、48 h后用细胞毒性检测试剂盒检测并与空白对照组比较。
1.2.4 细胞凋亡检测 含有PTX的膜片会随着PLGA的降解缓慢释放,用不同药物含量(0、10%、20%)的膜片浸提液培养提取的成纤维细胞48 h,用流式细胞仪检测3组浸提液对细胞凋亡的影响。
1.3 统计学处理
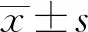
2 结 果
2.1 PTX- PLGA表面特征评价
载药PLGA膜片中PLGA能够很好地溶解,不含未溶解的杂质,PTX能很好地与PLGA混溶并在PLGA膜中均匀分布。在适度拉伸和弯折后PLGA膜片未出现明显的裂痕,前期膜片能够均匀降解。见图1。
a、b.不同放大倍数的电镜图像显示;c.PTX结晶体均匀地溶解到PLGA膜片中;d、e.降解21 d后的电镜图显示膜片均匀降解。图中白色箭头所指为膜片表面的灰尘等杂质
2.2 PTX- PLGA体外降解
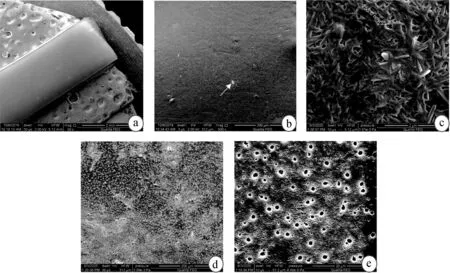
PLGA降解时间可以通过调整分子量及LA/GA之值进行调控。PTX- PLGA在pH值分别是7.4和4.0的缓冲液中前两周降解均较缓慢,从第3周开始降解速度逐渐增快。在第1、2、4周的质量损失分别为pH=4.0时的(3.13±0.43)%、(3.73±0.11)%、(23.76±1.62)%),pH=7.4的(2.09±0.26)%、(2.91±0.60)%、(17.35±0.55)%,到第10周时,在pH=4.0的降解液中材料基本降解完全。膜片在酸性降解液(pH=4.0)中的降解速度快于中性降解介质(pH=7.4),差异具有统计学意义(P<0.05)。见图2。

图2 PTX- PLGA膜片在两种pH的PBS中的降解曲线
2.3 药物释放
图3为体外28 d药物释放曲线。在第13天时药物释放逐渐加快,载药量10%的PTX- PLGA膜片连续28 d药物释放总量分别为(137.26±11.35) μg·ml-1(pH=4.0)、(102.73±6.94) μg·ml-1(pH=7.4);载药量20%的为(296.33±9.57) μg·ml-1(pH=4.0)、(245.64±16.24)μg·ml-1(pH=7.4)。
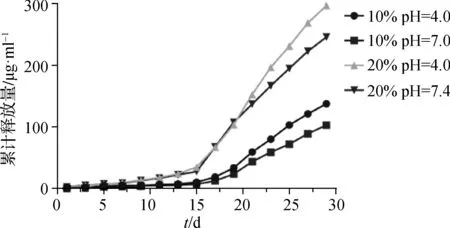
图3 不同载药量的PTX- PLGA膜片在两种pH值的PBS中的药物释放曲线
2.4 膜片毒性与细胞凋亡评估
将不同浓度梯度的浸提液与细胞共培养24、48 h后,细胞的吸光度与不含浸提液的空白对照组差异无统计学意义(F=2.62/2.86,P>0.05,图4)。培养48 h 的流式细胞仪结果显示:相较空白对照组,10%和20%的载药量组能促进细胞凋亡(P<0.05),并且随着载药量的增加凋亡逐渐增多,载药量为20%时晚期凋亡率超过10%,10%组与20%组的细胞凋亡率差异有统计学意义(P<0.05),见图5。
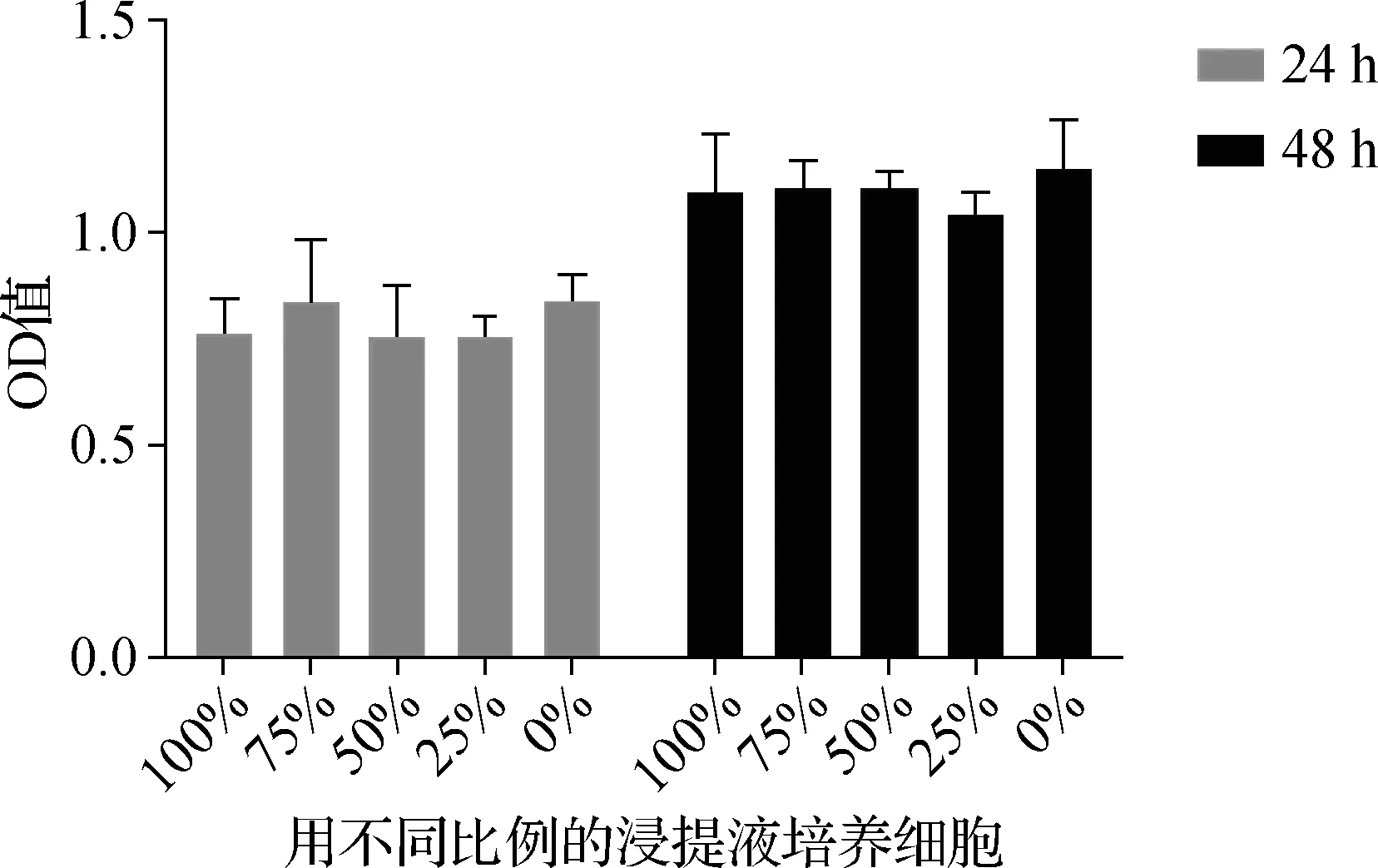
图4 细胞毒性检测
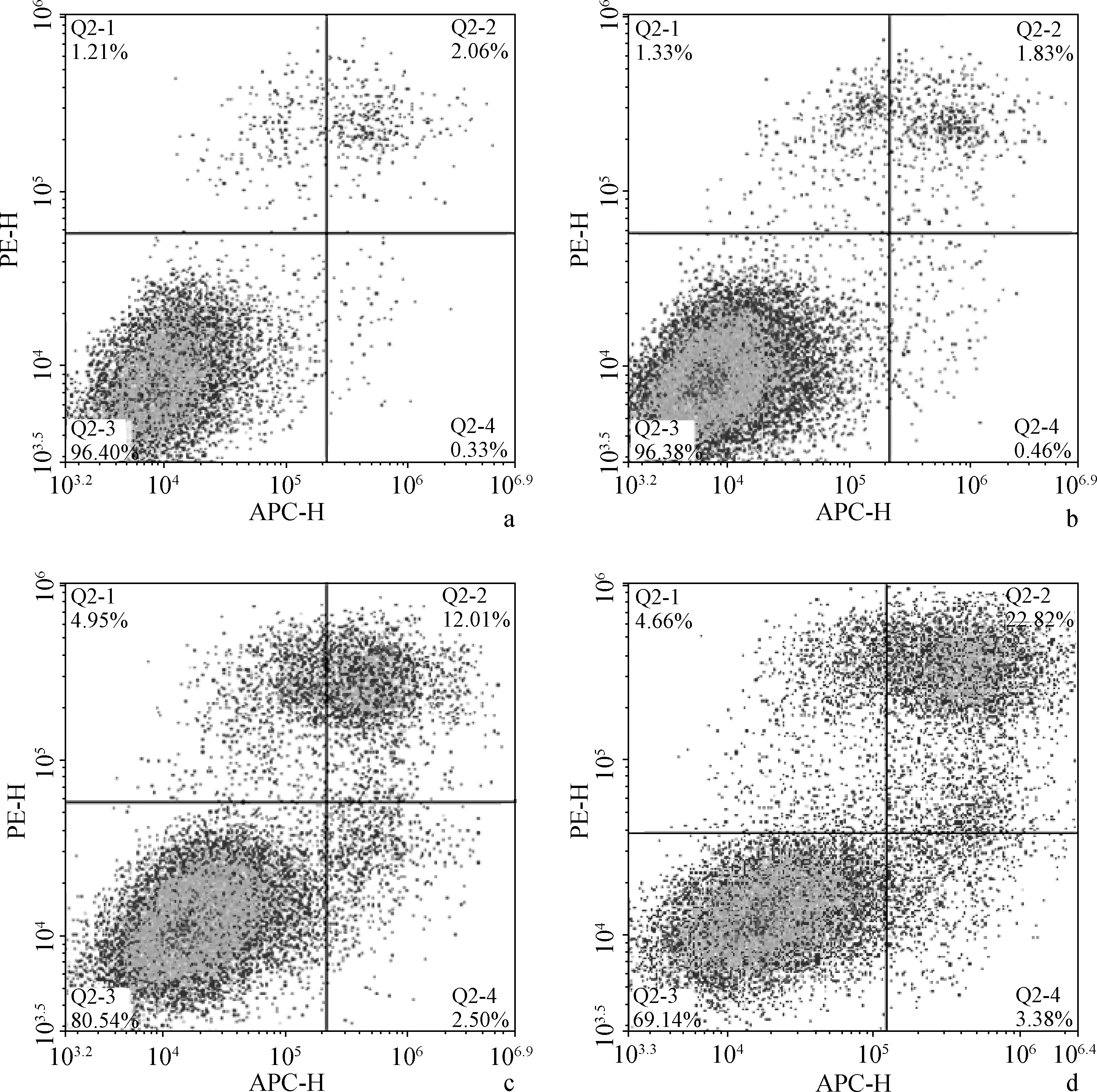
a、b、c、d.分别为空白对照、载药量为0、载药量为10%、载药量为20%组
3 讨 论
聚乳酸(polylactic acid)、左旋聚乳酸(poly-L- lactic acid, PLLA)、PLGA等[13- 14]诸多聚合物材料,因其良好的生物相容性、相对稳定的机械和降解性能被广泛应用于生物可降解支架的研究设计[15- 16]。PLLA作为生物可降解支架材料的缺点之一是其在体内大约6个月便失去机械强度,但质量损失的时间要长得多,完全吸收需要2~5年[17]。目前对于以PLLA为基材的生物可降解支架的设计并未达到临床上理想的应用效果,因此本研究设计选材为PLGA,其较PLLA最大的优点之一是降解速率明显加快。此外,本课题组在前期研究中发现,不同分子量以及不同LA/GA值的PLGA显示出不同的降解性能和柔顺性:分子量越大、LA比例越高,降解速度则越慢,并且随着LA比例增高,其刚性也相应增加。因此,对以PLGA作为支架的基材,可以根据不同需求,通过调节分子量以及LA/GA值,调节PLGA支架的性能。此外,本实验得到的PTX- PLGA膜片的降解速度略快于以往的报道[18],分析原因可能为:首先,换液时降解液的冲刷会在一定程度上加速降解,而这更符合实际情况,因为制备成的支架放入食管后动物的进食会对支架产生一定的冲刷作用;其次,不同的制备方式以及材料的厚度也可能会影响PLGA的降解速率。
PTX作为一种传统的抗组织增生药物可搭载或直接涂覆于支架表面[19],以抑制周围环境中组织细胞分裂、增殖和迁移,从而抑制支架再狭窄[20]。近几年,诸多研究者致力于探索载PTX的非血管生物可降解支架在治疗良性狭窄方面的应用。但是,对于治疗良性食管狭窄的PTX药物洗脱支架的载药量以及药物释放剂量仍没有一致性的研究意见。本实验通过对制备的PTX- PLGA材料行体外药物释放实验测得了不同时间点的药物释放量,并且用流式细胞仪检测细胞的凋亡率,结果发现当其初始载药量达到20%时,细胞晚期凋亡率大于10%。这为将PLGA作为药物释放平台的药物释放量以及对细胞凋亡的影响提供了实验基础,为后续进一步实验研究提供了一定的参考。
可降解聚合物材料相比传统的聚合物材料,其力学性能相对较弱,在相同的结构下可降解聚合物支架径向支撑力比金属支架的径向强度小很多,并且其自膨性相对较差,甚至不能满足临床的要求[21]。本实验中我们尝试将其裁剪成长条状并卷到模具上,干燥定型后制备成PLGA支架,但是由于高分子材料本身机械性能很差,无法达到局部支撑狭窄食管的要求。我们也尝试以下几种方法来解决其材料本身的不足:(1) 改变支架结构,如增大PLGA密度或者厚度;(2) 改变材料性质,混入添加剂来增加材料强度,本实验尝试通过增加一些添加剂或者在PLGA材料上添加一些基团以增强PLGA强度。虽然这些手段在一定程度上能有效增加支架的径向支撑力,但这是以降低柔顺行为为代价的,并且会对材料本身的降解性能以及支架轴向短缩率等造成较大的影响。此外,我们还尝试将PLGA联合可降解金属,利用PLGA较好的生物兼容性的特点将其作为覆膜材料制备可降解复合支架。可降解金属的韧性和强度较高[22],能弥补高分子支架径向强度不足的缺点,将载有抗增殖药物的PLGA覆在裸金属支架的表面,PLGA不仅作为药物的载体,而且其良好的生物兼容性可以减少对局部组织的刺激,从而降低不良反应发生率。同时,高分子聚合物覆在可降解金属表面可以有效延缓镁合金的降解,延长支架有效支撑时间。
总之,PLGA具有良好的生物兼容性,可有效减少因植入物的刺激而导致的局部组织增生,从而降低再狭窄率,并可以作为药物释放的载体在降解的过程中缓慢稳定地释放药物,是制备生物可降解药物洗脱支架的可选材料。

