Prospero相关同源异形盒蛋白1在宫颈癌组织中的表达及其临床意义>
李冰,马起鹏,林林,刘畅>
(1.铁岭市中心医院 妇产科,辽宁 铁岭 112000; 2.中国医科大学附属盛京医院滑翔院区 妇科,辽宁 沈阳 110022)
宫颈癌是妇科常见恶性肿瘤之一,其发病率占女性恶性肿瘤的第4位。近年来,我国宫颈癌的发病率和死亡率呈逐渐上升之势[1]。寻找宫颈癌潜在的分子生物学指标对改善患者生存预后有重要意义。Prospero相关同源异形盒蛋白1(Prospero- related homeobox 1,PROX1)是一种转录调节因子,在淋巴管的形成和发育中发挥重要作用[2]。PROX1在胶质瘤、肝细胞癌、乳腺癌和甲状腺癌等肿瘤组织中高表达,可能发挥促癌基因作用,其表达与肿瘤细胞的增殖、分化、侵袭、凋亡及迁移等生物学行为密切相关[3- 6]。本研究用免疫组化染色方法检测宫颈癌组织中PROX1的表达水平,探讨PROX1与宫颈癌患者临床病理特征及预后的关系,以期寻找潜在的宫颈癌生物学指标。
1 材料与方法
1.1 标本来源
选取2011年6月至2014年6月铁岭市中心医院81例宫颈癌患者的宫颈癌组织进行研究。纳入标准:(1) 年龄≥18岁;(2) 组织病理学检查证实为宫颈癌;(3) 术前未接受放疗、化疗或免疫治疗等。排除标准:(1) 严重的心肝肾功能障碍;(2) 随访资料不全。患者年龄44~68岁,平均(54.01±11.80)岁;腺癌25例,鳞癌56例;低分化癌44例,中分化癌21例,高分化癌16例;肿瘤直径(3.89±1.34)cm;深浸润42例;有淋巴结转移38例;FIGO分期为Ⅰa期18例,Ⅰb期23例,Ⅱa期40例;术后辅助化疗59例,放疗或放化疗联合治疗13例。治疗后对患者进行门诊和电话随访,患者随访截止2019年6月,记录患者总体生存时间。
1.2 免疫组化染色法检测组织中PROX1的表达
宫颈癌组织和癌旁组织(距离癌组织>4 cm[7])的石蜡切片由铁岭市中心医院病理科制作,厚度为4 μm。在70 ℃下烤片30 min,随后进行脱蜡处理。用Tris/EDTA抗原修复缓冲液(北京酷来搏科技有限公司)进行抗原修复,羊血清封闭30 min。加入鼠抗人PROX1单克隆抗体(1∶1 000稀释,美国Sigma公司),4 ℃过夜,随后加入生物素标记的鼠抗兔IgG(1∶500稀释,美国Sigma公司),37 ℃孵育30 min。用辣根标记的链霉素卵白素工作液和DAB显色液处理,苏木紫复染。经过脱水、透明、封片处理后在显微镜下观察。
由两位病理科医师进行独立阅片,两人结果一致则记录结果,如有争议则请第3名医师看片,以两个相同结果为准。每张切片随机选择10个视野,每个视野计数100个细胞,根据细胞的染色强度及阳性细胞比例判断PROX1表达情况。染色为阴性记0分、浅黄色1分、棕黄色2分、棕褐色3分;阳性细胞数为0~10%记1分、11%~50%记2分、51%~80%记3分、81%~100%记4分,将二者评分相乘得出最终结果:0分为阴性,1~3分为弱阳性,4~8分为中等阳性,9~12分为强阳性[8]。0~3分为低表达组,4~12分为高表达组。
1.3 统计学处理
应用SPSS 21.0统计软件进行统计学分析。两组间计数资料比较用McNemar检验。生存分析用Kaplan- Meier法,多因素分析用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 PROX1在宫颈癌组织中的表达
如图1所示,PROX1阳性染色主要出现在细胞核中,细胞浆中也有少量染色。癌组织中PROX1高表达率为69.14%(56/81),明显高于癌旁组织的11.11%(9/81),差异有统计学意义(χ2=35.905,P<0.001)。

A.PROX1在癌旁组织中弱阳性表达; B.PROX1在癌组织中强阳性表达
2.2 PROX1表达与宫颈癌临床病理特征的关系
高表达组组织低分化、深浸润和淋巴结转移率均高于低表达组(均P<0.05),其余资料的组间比较差异无统计学意义(P>0.05),见表1。多因素分析结果显示,分化程度、浸润深度和淋巴结转移是PROX1表达的独立影响因素(P<0.05),见表2。

表1 PROX1表达与宫颈癌临床病理特征的关系
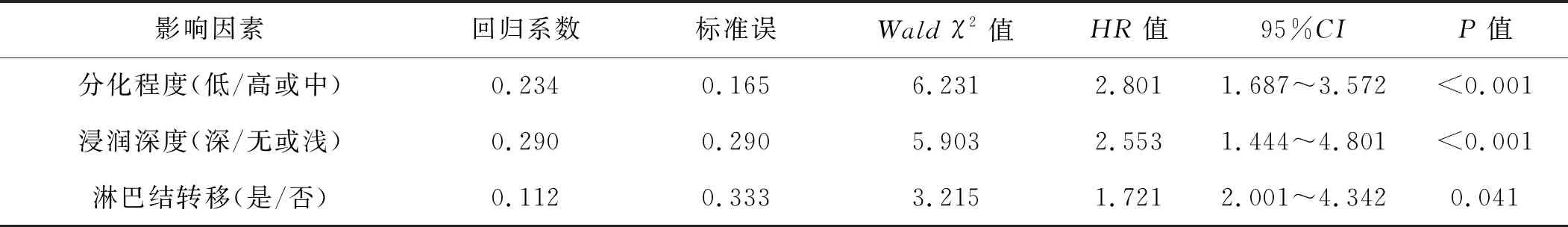
表2 影响PROX1表达的多因素分析
2.3 宫颈癌总体生存时间的影响因素分析
Cox多因素分析结果显示,组织低分化、浸润较深、淋巴结转移、未辅助化疗、PROX1高表达是宫颈癌患者总体生存时间短的独立影响因素(均P<0.05),见表3。
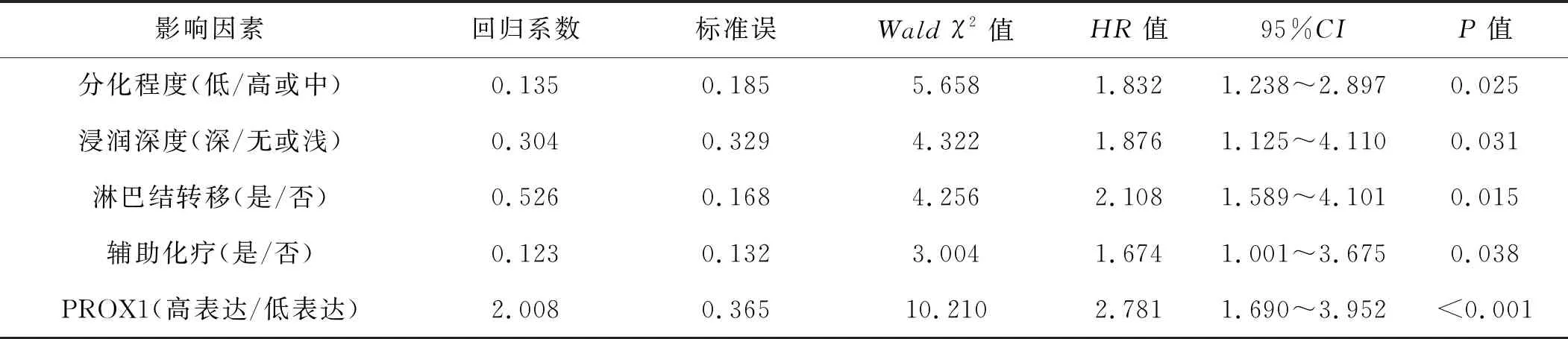
表3 宫颈癌患者总体生存时间的多因素分析
2.4 PROX1表达与宫颈癌患者生存预后的关系
高表达组5年生存率为40.74%,明显低于低表达组的71.73%,差异有统计学意义(P=0.031,Log- rank检验),见图2。
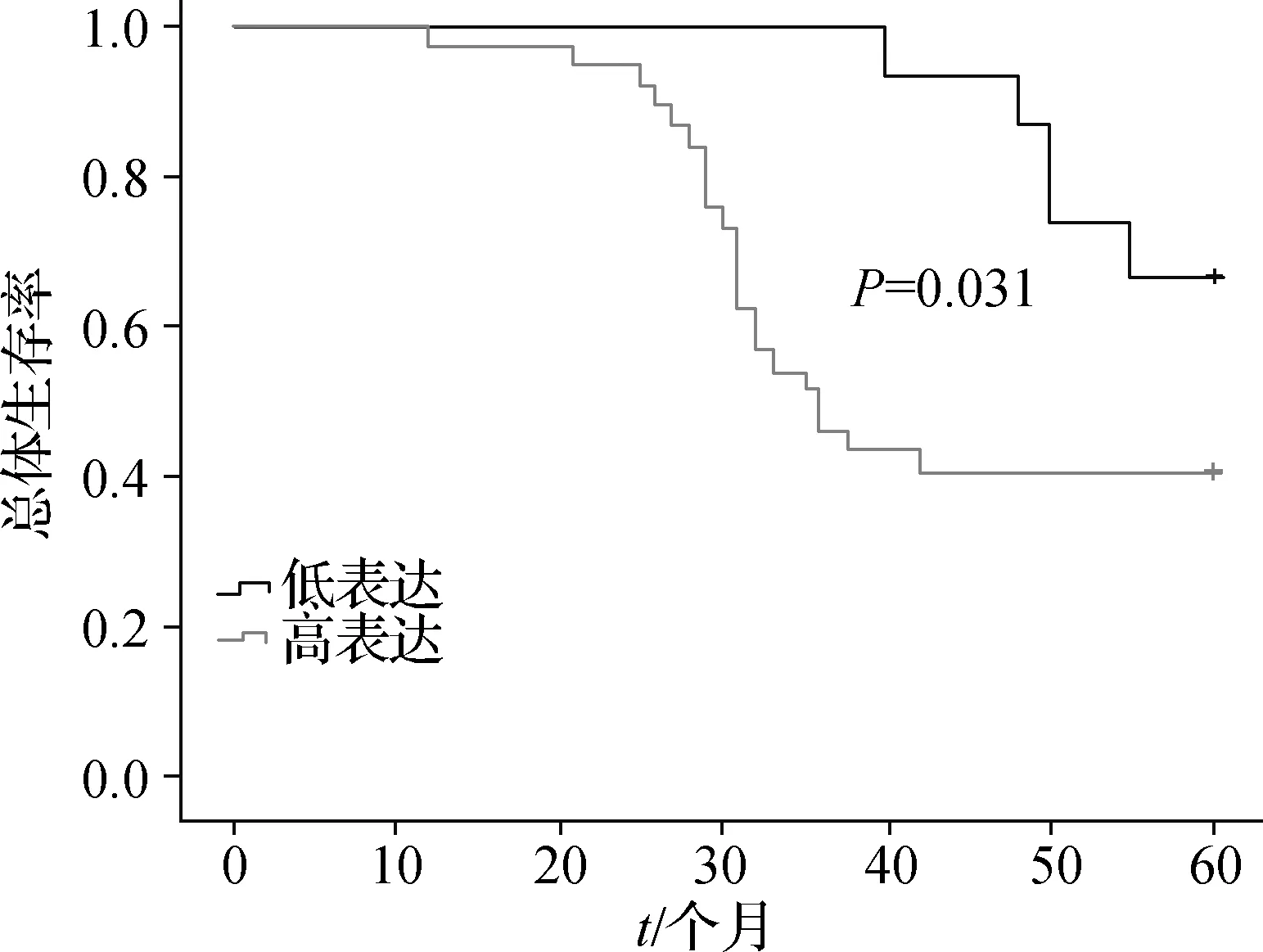
图2 宫颈癌患者生存曲线
3 讨 论
宫颈癌的发病机制目前尚未完全明确[9]。PROX1于1996年首次被Zinovieva等人发现,是prospero在哺乳动物中的同源框基因转录因子[10]。既往研究[3- 6]发现,PROX1与胶质瘤、肝细胞癌、乳腺癌和甲状腺癌等多种肿瘤的发生和发展密切相关。PROX1在宫颈癌中的表达及意义既往未见报道,本研究用免疫组化染色法检测了81例宫颈癌组织和配对的癌旁组织,结果显示癌组织中PROX1表达率为69.14%(56/81),明显高于癌旁组织的11.11%(9/81),差异有统计学意义。结果说明PROX1可能作为促癌基因在宫颈癌中发挥作用。
本研究发现,PROX1高表达组低分化、深浸润、淋巴结转移率均高于低表达组,提示PROX1与宫颈癌的进展密切相关。PROX1在肿瘤中的作用机制既往报道较少。Gramolelli等[11]发现,PROX1结合并抑制基质金属蛋白酶- 14表达,进而参与肿瘤血管生成和肿瘤侵袭。也有学者[12]发现,PROX1通过核小体重塑和去乙酰化酶复合物抑制Notch信号通路,进而抑制肿瘤细胞增殖。PROX1也与免疫炎症损伤有关,它能够通过上调转录因子κB促进瘤细胞增殖和侵袭[3]。PROX1也表达于淋巴管内皮细胞,能够参与肿瘤淋巴管新生和肿瘤淋巴道转移[2]。
影响宫颈癌预后的因素有很多,本研究发现肿瘤低分化、浸润较深、淋巴结转移、未辅助化疗是宫颈癌患者不良生存预后的独立影响因素,这与既往报道[13- 15]一致。本研究结果显示,高表达组5年生存率为40.74%,明显低于低表达组的71.73%,提示PROX1可能会成为预测宫颈癌患者预后的生物学指标。
综上所述,PROX1表达水平与宫颈癌分化程度、浸润深度、淋巴结转移及FIGO分期有关,PROX1高表达可能预示患者的不良生存预后。本研究也存在一些局限性,例如未检测血清中PROX1表达水平,其对宫颈癌早期诊断及鉴别诊断的价值还有待研究;未分析PROX1下游分子的变化,未来需要深入探讨其在宫颈癌中的作用机制。

