极低体重儿氧暴露后血清外泌体miR- 30a、miR- 34a变化与支气管肺发育不良的相关性>
牟佳,孙巨勇,牟娜,徐燕>
(1.衡水市妇幼保健院 检验科,河北 衡水 053000; 2.衡水市人民医院 检验科,河北 衡水 053000)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是一种与早产相关的慢性肺部疾病,对患儿的不良影响可延续至成年[1]。近年来,吸氧治疗在新生儿科的使用越来越普遍,虽然大大提高了早产儿的存活率,但是长期暴露在高氧环境中会干扰肺的发育,导致不可逆的发育异常[2]。微小RNA(miRNAs)在其中发挥着重要作用,例如miR- 30a、miR- 34a等都通过调控HIF- 1α/SIRT1信号通路参与高氧诱导的肺泡上皮细胞凋亡过程[3- 4]。外泌体作为一种丰富而稳定的循环生物标志物来源,携带并保护着不同的分子信息(包括miRNAs、mRNA等)不被降解,在疾病诊断和预后评估方面具有不可忽视的优势[5]。本研究拟选取接受吸氧治疗的极低体重早产儿作为研究对象,分析外泌体miR- 30a、miR- 34a与BPD发生以及患儿短期预后的相关性,为BPD的诊断和治疗提供新的潜在靶点。
1 对象和方法
1.1 研究对象
本研究属于一项回顾性队列研究。选取2018年1月至2020年1月在衡水市妇幼保健院新生儿重症监护室(neonatal intensive care unit,NICU)住院>28 d的极低体重早产儿作为研究对象,胎龄<320/7周、出生体重<1 500 g,接受有创或无创通气的呼吸支持。根据《实用新生儿学》[6]关于BPD的诊断标准,结合肺部影像学特征,且出生后吸氧体积分数(fraction of inspiration oxygen,FiO2)>21%、氧依赖超过28 d,则确诊为BPD。最终56例BPD患儿(BPD组)和50例非BPD早产儿(非BPD组)纳入研究。排除存活时间<28 d、先天性心肺发育异常、染色体异常、重大先天性畸形、肺炎、败血症(采集血清样本时)新生儿。另外,根据《新生儿学》诊断标准,如果新生儿出生28 d需要氧疗,但纠正胎龄36周后不需要氧疗则判断为轻度BPD;而对于纠正胎龄36周后仍然需要氧疗的新生儿,则为中重度BPD(FiO2<30%则为中度BPD,FiO2≥30%或需机械通气则为重度BPD)。
1.2 方法
1.2.1 新生儿资料调取 从新生儿出生档案中调取相关产科记录,包括新生儿性别、出生体重、分娩方式、1 min和5 min Aapgar评分、产前使用激素比例、完全肠道喂养、机械通气时间、合并症[包括动脉导管未闭(patent ductus arteriosus,PDA)、脑室内出血(intraventricular hemorrhage,IVH)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、呼吸窘迫综合征(respiratory distress syndrome,RDS)、早产儿视网膜病变(retinopathy of prematurity,ROP)]和NICU住院时间。
1.2.2 血液样本收集 收集早产儿出生后1、7、14、28 d时常规临床化验后废弃的静脉血液标本,3 000 r·min-1离心10 min,收集上清样本,用于分离血清外泌体。未鉴定的样品保存在-80 ℃,直至分析。
1.2.3 分离血清外泌体并鉴定 用超速离心法分离外泌体,将血清在4 ℃下3 200 r·min-1离心15 min去除血清中的细胞和死亡细胞,5 000 r·min-1离心30 min去除细胞碎片,然后100 000 r·min-1超速离心2 h得到沉淀。将外泌体用铀酰- 草酸盐水溶液(pH 7.0)染色5 min,并用JEM- 1200型透射电子显微镜在185 kV电压下进行观察。应用Nanosight NS300纳米粒径跟踪分析仪采用纳米粒径跟踪分析(nanoparticle tracking analysis,NTA)技术测定外泌体粒径大小。另外,采用蛋白质免疫印迹法将等量外泌体通过SDS- PAGE电泳分离并转移到聚偏氟乙烯膜上。用含0.1%Tween- 20的5%脱脂牛奶缓冲生理盐水封闭细胞膜1 h,用CD63、TSG101、GM130的鼠抗人初级抗体在4 ℃条件下培养4 h,然后与HRP结合的次级抗体在室温下孵育1 h。免疫反应条带用电化学印迹检测试剂显示,并显影固定在X射线片上。
1.2.4 实时荧光定量PCR法检测miR- 30a、miR- 34a水平 用Qiagen miRNeasy试剂从血清外泌体中提取总RNA。用 NanoDrop ND- 1000分光光度计对分离RNA的浓度和纯度进行了评价。利用TaqManTMMicroRNA反转录试剂盒对1 μg RNA样本进行反转录反应,获得cDNA模板。使用TaqMan miRNA assay试剂盒在7900HT快速实时PCR系统上进行基因扩增反应。首先,1.5 μl cDNA模板与TaqMan Universal PCR master mix及0.5 μl探针混合。PCR反应体系总体积为10 μl,将反应体系在95 ℃下预变性10 min,然后94 ℃ 15 s,60 ℃ 1 min,重复进行36个热循环。用RQ manager 软件对结果进行分析,以cel- miR- 39作为内部对照,将miR- 30a、miR- 34a的表达值归一化为cel- miR- 39,用2-ΔΔCT方法计算。
1.3 统计学处理
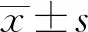
2 结 果
2.1 临床基本资料统计结果
比较BPD组和非BPD组早产儿临床基本资料,两组性别构成、剖宫产、产前激素使用、胎膜早破发生率、完全肠道喂养时长、肺表面活性剂使用以及合并PDA、IVH、NEC发生率比较,差异均无统计学意义(均P>0.05);但是与非BPD组早产儿比较,BPD组早产儿胎龄、出生体重、1 min和5 min Apgar评分较低,同时机械通气时长以及RDS、ROP合并症比例较高,差异有统计学意义(P<0.05)。见表1。
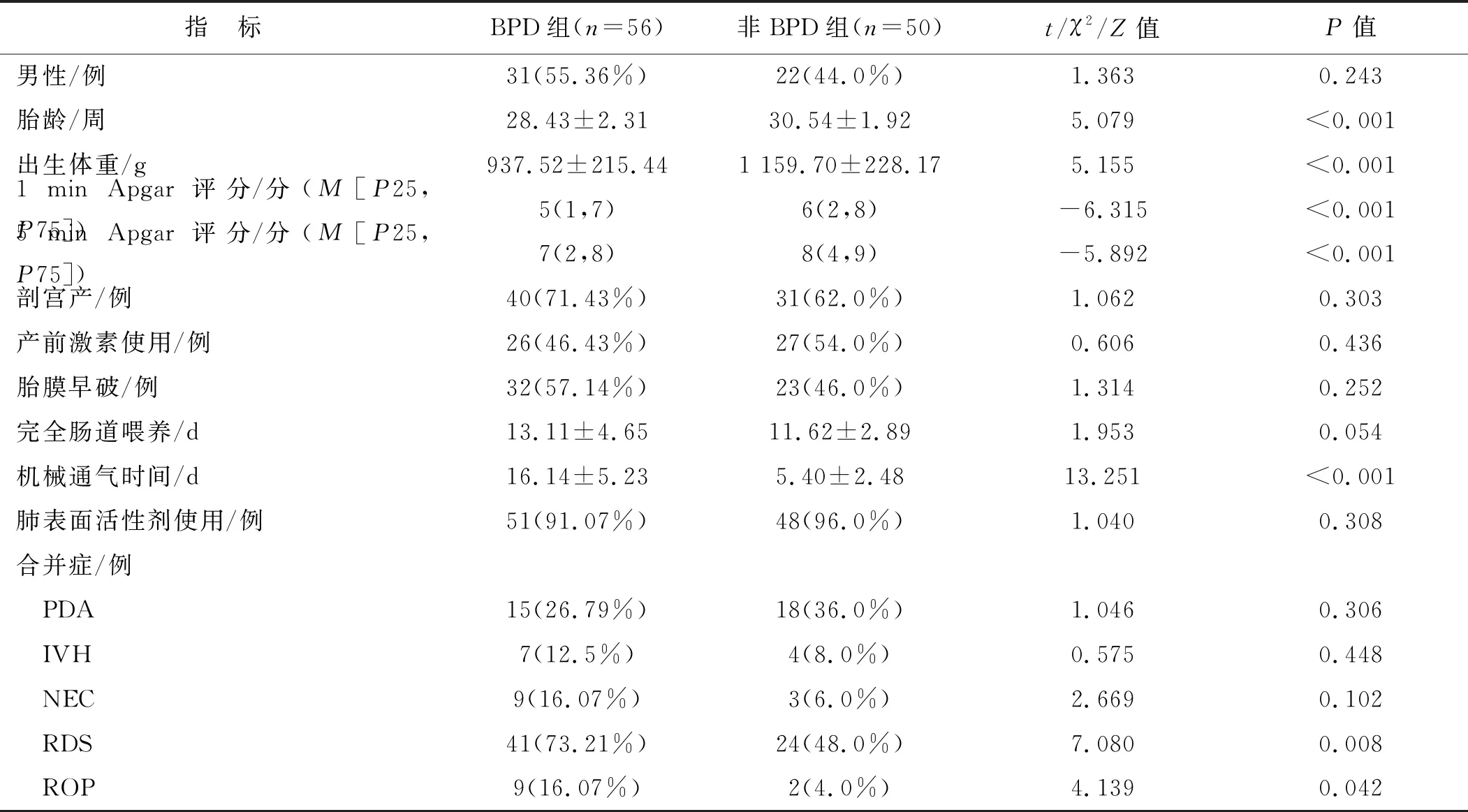
表1 BPD组和非BPD组早产儿临床资料比较
2.2 血清外泌体提取和鉴定
采用透射电镜、 NTA技术和蛋白质免疫印迹法对用超速离心法从早产儿外周循环血血清中分离得到的外泌体进行了表征,在透射电镜视野下外泌体呈典型的圆形或椭圆形、双层膜结构的囊状小泡。经NTA分析,新生儿静脉血血清外泌体平均粒径约为(153.0±3.2)nm,粒子浓度约为(9.45±1.23)×108ml-1。此外,外泌体蛋白标志分子CD63和TSG101呈阳性表达,而GM130则呈阴性表达。这些结果均证实了超速离心法分离的囊泡是外泌体。见图1。
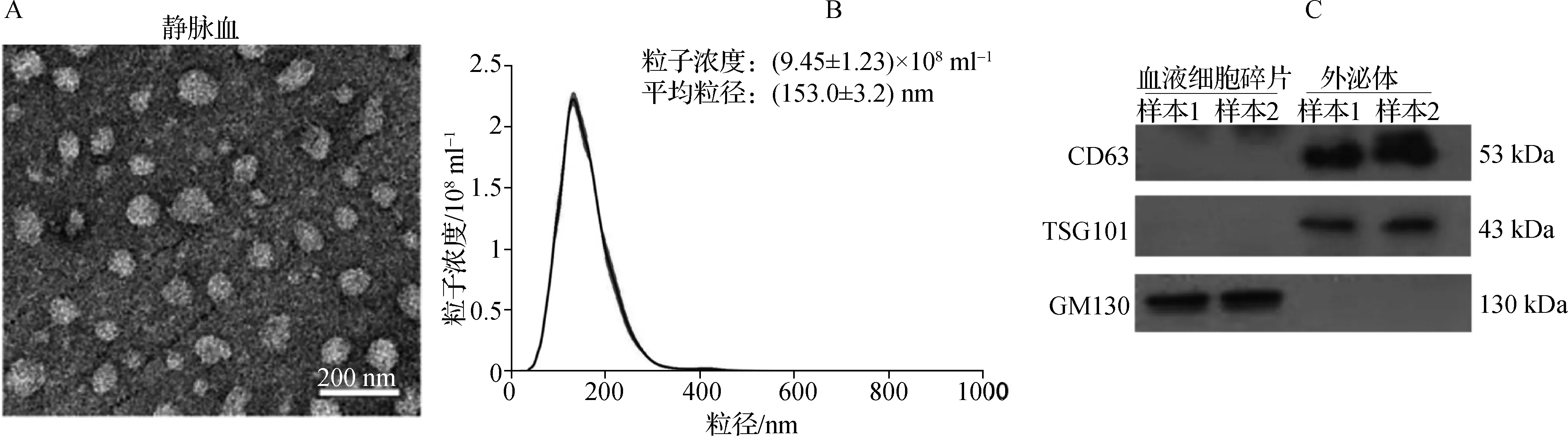
A.外泌体在透射电镜下的形态;B.外泌体粒径分布曲线;C.蛋白质免疫印迹法检测CD63、TSG101、GM130蛋白表达
2.3 BPD组和非BPD组早产儿外泌体miR- 30a、miR- 34a水平变化
经重复测量设计的方差分析,外泌体miR- 30a、miR- 34a水平随时间不断波动变化,在各个时间存在水平差异,且这种波动变化可能对BPD的发生存在一定影响:(1) 时间效应:对于BPD组和非BPD组患儿,组内时间因素对外泌体miR- 30a、miR- 34a水平变化具有一定的影响(F时间值分别为133.968、212.605,均P<0.001);(2) 组间效应:BPD组患儿外泌体miR- 30a、miR- 34a波动范围较非BPD组患儿更大(F组别值分别为10.088、23.208,均P<0.05);在产后14、21、28 d时,BPD组外泌体miR- 30a水平均低于非BPD组(P<0.05),同时外泌体miR- 34a水平均高于非BPD组(P<0.05);(3) 两组外泌体miR- 30a、miR- 34a水平变化存在时间和组间交互效应(F时间×组别值分别为13.001、73.826,均P<0.001),即组间与组内因素检测时间点的交互作用对外泌体miR- 30a、miR- 34a水平的影响也有统计学意义,说明时间因素对外泌体miR- 30a、miR- 34a水平的影响会因BPD的发生而不同,应分析各组的单独效应。见表2。
表2 BPD组和非BPD组早产儿外泌体miR- 30a、miR- 34a水平变化
2.4 轻度和中重度BPD早产儿外泌体miR- 30a、miR- 34a水平变化
根据诊断标准,BPD组早产儿中有34例为轻度BPD,22例为中重度BPD。经重复测量设计的方差分析,外泌体miR- 30a、miR- 34a水平随时间不断波动变化,且这种波动变化可能对BPD的严重程度存在一定影响:(1) 时间效应:对于轻度亚组和中重度亚组患儿,组内时间因素对外泌体miR- 30a、miR- 34a水平变化具有一定的影响(F时间=8.768,P=0.002;F时间=6.594,P=0.014);(2) 组间效应:重度亚组患儿外泌体miR- 30a、miR- 34a波动范围较轻度亚组患儿更大(F组别值分别为36.718、19.350,均P<0.001);在产后21、28 d时中重度BPD亚组外泌体miR- 30a水平低于轻度BPD亚组(P<0.05),同时外泌体miR- 34a水平高于轻度BPD亚组(P<0.05);(3) 两个亚组外泌体miR- 30a、miR- 34a水平变化存在时间和组间交互作用(F时间×组别值分别为67.902、33.189,均P<0.001),即组间与组内因素检测时间的交互作用对外泌体miR- 30a、miR- 34a水平的影响也有统计学意义,说明时间因素对外泌体miR- 30a、miR- 34a水平的影响会随着BPD严重程度而不同,应分析各亚组的单独效应。见表3。
表3 轻度和中重度BPD早产儿外泌体miR- 30a、miR- 34a水平变化
2.5 根据性别分层分析外泌体miR- 30a、miR- 34a水平变化
轻度BPD亚组和中重度BPD亚组性别构成无差别(c2=1.005,P=0.316)。对两个亚组进行性别分层分析,经重复测量设计的方差分析,外泌体miR- 30a水平随时间不断波动变化,且这种波动变化可能对不同性别的新生儿BPD的发生风险存在一定影响:(1) 时间效应:对于男性和女性患儿,组内时间因素对外泌体miR- 30a水平变化具有一定的影响(轻度:F时间=6.985,P=0.017;中重度:F时间=9.872,P=0.001);而不同时间点外泌体miR- 34a水平差异则无统计学意义(轻度:F时间=2.831,P=0.274;中重度:F时间=3.159,P=0.133);(2)组间效应:对于轻度亚组和中重度亚组患儿,男性患儿外泌体miR- 30a水平波动范围较女性患儿更大(轻度:F组别=7.135,P=0.022;中重度:F组别=9.847,P=0.013);在产后21、28 d时,轻度BPD亚组女性早产儿外泌体miR- 30a水平高于男性(P<0.05),同样在产后14、21、28 d时,中重度BPD亚组女性早产儿外泌体miR- 30a水平高于男性(P<0.05);而两个亚组分层分析外泌体miR- 34a水平差异则无统计学意义(轻度:F组别=1.261,P=0.736;中重度:F组别=1.587,P=0.477);(3) 对于轻度亚组和中重度亚组患儿,不同性别分层的患儿外泌体miR- 30a水平变化存在时间和组间交互作用(轻度:F时间×组别=9.305,P=0.017;中重度:F时间×组别=11.855,P=0.010);而外泌体miR- 34a水平变化则不存在时间和组间交互作用(轻度:F时间×组别=3.496,P=0.473;中重度:F时间×组别=4.182,P=0.410)。见表4。
表4 轻度和中重度BPD亚组男性、女性患儿外泌体miR- 30a、miR- 34a水平变化
2.6 产后28 d外泌体miR- 30a、miR- 34a对BPD的诊断价值
绘制ROC曲线,产后28 d血清外泌体miR- 30a、miR- 34a诊断BPD的AUC分别为0.868(95%CI:0.795~0.915)和0.798(95%CI:0.703~0.854),阈值为2.14和1.94,在该阈值下灵敏度为72.3%和72.3%,特异度为94.4%和87.8%。见图2。
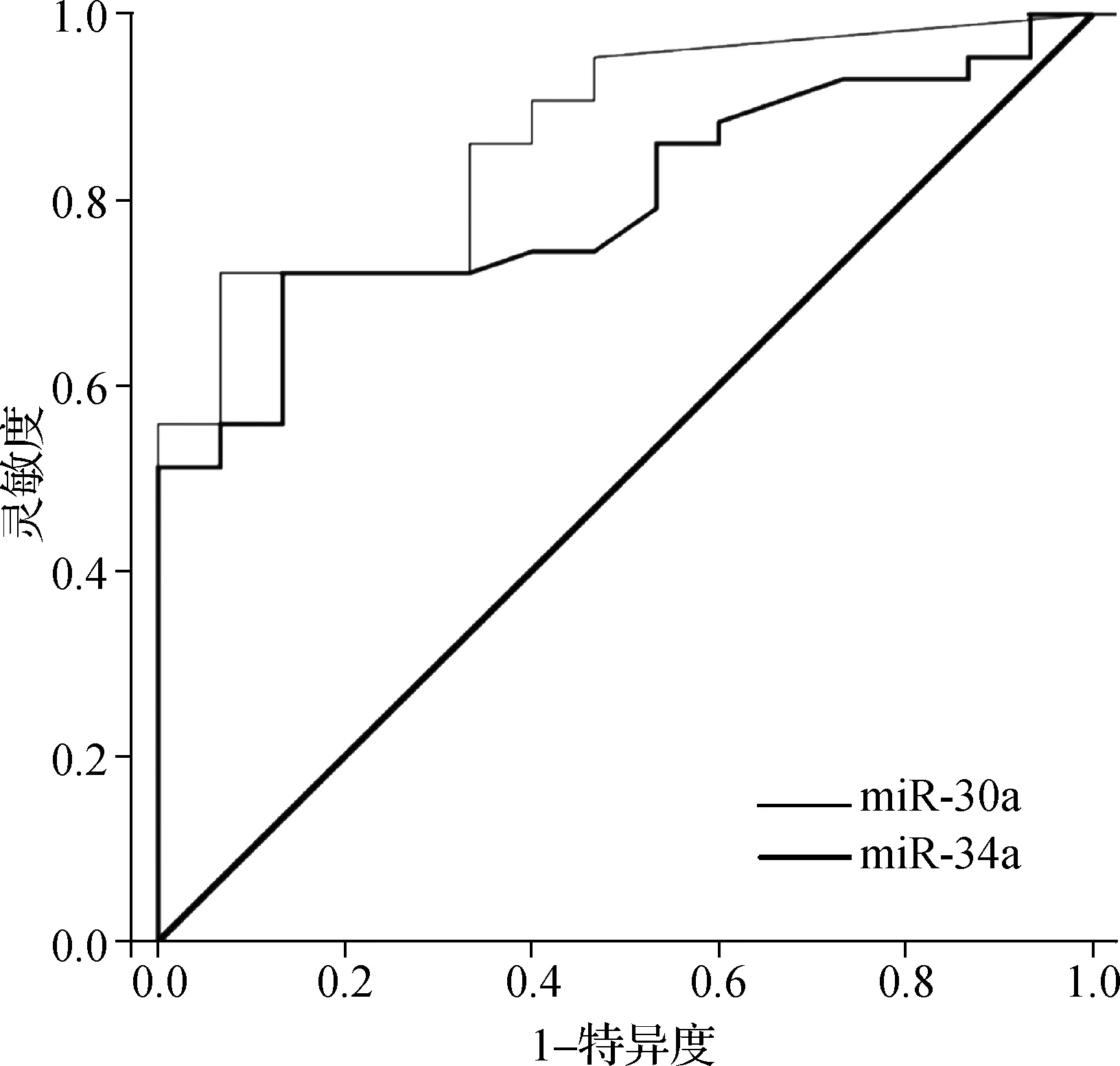
图2 产后28 d外泌体miR- 30a、miR- 34a诊断BPD的ROC曲线
3 讨 论
3.1 miR- 30a、miR- 34a与BPD发生的关系
BPD是一种慢性肺部疾病,严重影响早产儿的预后,特别是极低出生体重儿。杨蛟等[7]通过多因素Logistic回归分析证实,用氧时间、最高吸入氧浓度超过40%等是早产儿BPD的独立危险因素。因此高氧致急性肺损伤是新生儿BPD发病的重要原因,目前尚无特异性的预防和治疗方法。
近年来很多研究发现,miRNAs在高氧暴露致BPD发生过程中发挥着关键作用。例如Zhang等[3]通过动物研究发现,miR- 30a与新生小鼠肺血管生成密切相关,将新生C57BL/6小鼠暴露于高氧环境中,miR- 30a在正常肺发育过程中处于高表达状态,而在高氧诱导的BPD小鼠模型肺组织中的水平则显著下调,并且其调控机制与HIF- 1α/Snail1轴有关。此外,Das等[8]也发现,在高氧致急性肺损伤的新生小鼠模型肺组织中miR- 34a水平显著增加,而miR- 34a表达缺失或抑制可改善BPD小鼠模型的肺表型和BPD相关性肺动脉高压,反之,miR- 34a过度表达则会加重肺动脉高压,其可能的作用机制与miR- 34a抑制下游促血管生成素- 1的合成和分泌有关。上述基础研究均证实miR- 30a、miR- 34a均与BPD的发生过程有关,两者有可能成为诊断或防治新生儿BPD的治疗选择。
在本研究中,我们通过对比BPD组和非BPD组早产儿血清外泌体中miR- 30a、miR- 34a的水平变化发现,随着氧疗的进行,两组早产儿外泌体miR- 30a、miR- 34a水平均出现波动,且BPD组患儿外泌体miR- 30a、miR- 34a水平波动范围较非BPD组患儿更大;在产后14、21、28 d时BPD组外泌体miR- 30a水平均低于非BPD组,同时外泌体miR- 34a水平均高于非BPD组(P<0.05)。推测外泌体miR- 30a水平下降过快或者miR- 34a水平升高过快可能是影响肺发育成熟的重要机制之一。随着吸氧时间的延长,肺组织持续处于高氧状态下,NAPDH氧化酶合成增加和活性增强导致大量超氧化物和过氧化氢的产生,但早产儿的抗氧化酶系统尚未成熟,使肺组织极易发生氧化应激损伤。而miR- 30a具有促血管生成和抗氧化、抗纤维化作用,miR- 30a表达下调则意味着肺组织更易发生氧化应激损伤和纤维化进展。同样,miR- 34a也是BPD发病机制的主要调节因子。Syed等[9]利用基因功能增强和功能丧失策略证实miR- 34a表达增强不利于肺组织发育,相反,沉默miR- 34a表达则对BPD肺组织相关表型具有保护作用,这主要因为miR- 34a下游主要的调控靶点是Ang1和Tie2,miR- 34a可抑制Ang1和Tie2表达,进而导致细胞增殖和血管生成水平显著降低,而细胞凋亡显著增加。因此本研究对BPD患者进行亚组分析时也发现,轻度亚组和中重度亚组患儿外泌体miR- 30a、miR- 34a水平变化存在时间和组间交互作用,说明组内时间因素对外泌体miR- 30a、miR- 34a水平的影响会随着BPD严重程度而不同,尤其是在产后21、28 d时,中重度BPD亚组外泌体miR- 30a水平低于轻度BPD亚组,同时外泌体miR- 34a水平高于轻度BPD亚组,说明在临床确诊前,BPD新生儿体内与氧化应激损伤有关的一些因子已经出现表达异常,这有望成为预防或延缓BPD进展的重要靶标。
3.2 miR- 30a作为早产儿BPD性别差异的候选因子
在本研究我们通过对BPD患儿进一步进行分层分析发现,外泌体miR- 30a水平随时间不断波动变化,且这种波动变化可能对不同性别的新生儿BPD的发生风险存在一定影响;在产后21、28 d时,轻度BPD亚组女性早产儿外泌体miR- 30a水平高于男性(P<0.05),同样在产后14、21、28 d时,中重度BPD亚组女性早产儿外泌体miR- 30a水平高于男性(P<0.05)。O′Connor等[10]通过流行病学调查研究证实,男性早产儿是发生BPD的独立危险因素,这种性别差异可能与氧化应激、性激素作用、肺血管发育、炎症反应等有关。这种性别差异的分子机制尚不清楚。最近Zhang等[11]通过动物实验发现,与雄性相比,高氧暴露的雌性新生小鼠肺泡化和肺血管生成得更好,这可能与miR- 30a的作用有关。HIF- 1α是诱导miR- 30a表达的重要因子,HIF- 1α在高氧暴露新生小鼠中的过度表达可减轻肺损伤。而相较于雄性,雌性小鼠肺微血管内皮细胞中HIF- 1α表达量更高,且经高氧暴露后肺部HIF- 1α与其靶基因的结合率也更高,进而导致miR- 30a水平高于雄性。上述结果表明,miR- 30a性别特异性差异表达可以调节暴露于高氧环境下的新生儿的肺血管发育,这在一定程度上也解释了男性早产儿中BPD的发生风险相较于女性早产儿更高。
3.3 外泌体miR- 30a、miR- 34a对BPD的诊断价值
外泌体是由多种活细胞(包括各种免疫和非免疫细胞)分泌的膜结合磷脂小泡,存在于各种体液中,包括血液、尿液、支气管肺泡灌洗液、腹水和脑脊液等。外泌体携带并保护着不同的分子信息不被降解,可以从储存和冷冻的生物样品中进行分析[12],因此不同细胞释放的外泌体可能存在特异性表型。外泌体脂质双层膜将外泌体miRNAs包裹在其中,并保护它们免受酶降解的影响,从而产生一种适合生物标志物的长而稳定的表达时间。在本研究中我们证实,早产儿血清外泌体中含有miR- 30a、miR- 34a,并且对于BPD具有较高的诊断价值。除了具有生物标志物的潜能外,外泌体miRNAs还可以通过调节受体细胞中的生物途径参与疾病的发生,因此Willis等[13]提出间充质干细胞外泌体通过巨噬细胞免疫调节改善实验性BPD,恢复肺功能,有望成为BPD治疗的新手段。
综上所述,本研究发现随着氧暴露时间的延长,极低出生体重早产儿血清外泌体miR- 30a水平逐渐降低,同时外泌体miR- 34a水平逐渐升高,尤其是BPD患儿变化更明显。检测血清外泌体miR- 30a、miR- 34a表达有助于BPD的诊断以及对病情发展的评估。此外在氧暴露过程中,女性早产儿血清外泌体miR- 30a水平高于男性早产儿,这可能是女婴BPD发生风险略低于男婴的原因之一。

