KIFC1通过调节PI3K/AKT信号通路促进胆管癌恶性生物学行为的实验研究>
恽骁,王高超,周含煜,朱春富,秦锡虎>
(1.南京医科大学附属常州市第二人民医院 普外科,江苏 常州 213003; 2. 南京医科大学附属常州市第二人民医院 肿瘤科,江苏 常州 213003)
胆管癌是一种来源于胆管上皮的恶性肿瘤,可分为肝内胆管癌、肝门部胆管癌和中下段胆管癌[1]。胆管癌侵袭性强,预后差[2]。胆管癌的早期诊断十分困难,大多数患者在疾病早期没有症状,确诊时已进入进展期[3- 4]。手术是胆管癌的首选治疗方法,但仅少数(约35%)患者拥有早期手术机会[2]。对于晚期或不能切除的胆管癌患者可用的系统治疗效果有限,目前标准治疗方案(吉西他滨和顺铂)的中位总存活期<1年[5]。
激肽家族成员C1(kinesin family member C1,KIFC1)属于激肽14家族,在有丝分裂过程中参与中心体聚集、微管运输和纺锤体的形成[6- 7]。KIFC1在包括乳腺癌、胃癌和卵巢腺癌在内的多种癌症中过表达,并被证明能促进肿瘤细胞增殖或耐药[8- 10]。它也是肺癌或卵巢腺癌患者转移的推定标志物[8- 11]。然而KIFC1在胆管癌中的作用和潜在机制尚不清楚。
本研究旨在检测胆管癌组织和细胞中KIFC1的表达,观察干扰KIFC1 对胆管癌细胞活力、迁移、侵袭和凋亡能力的影响。此外,我们认为KIFC1可能通过影响PI3K/AKT通路促进胆管癌的恶性进展,因此KIFC1研究可能为胆管癌的预后判断和治疗提供新的见解。
1 材料与方法
1.1 材料
1.1.1 胆管癌组织与细胞系 6对胆管癌组织(4对肝内胆管癌组织、2对肝外胆管癌组织);人胆管癌HUCCT1细胞株,购自上海复祥生物科技公司。RBE、9810细胞株,购自广州华拓生物有限公司。Transwell小室,购自Corning公司(货号为3422)。PVDF膜,购自Millipore公司(货号为IPVH00010)
1.1.2 试剂 细胞计数试剂盒(CCK)- 8,购自碧云天生物技术公司(货号为C0038);AnnexinV- FITC/PI细胞凋亡双染试剂盒和 Matrigel基质胶,美国BD公司(货号为556547、356234);兔抗人AKT、P- AKT、PI3K、P- PI3K单克隆抗体购自Cell Signaling Technology公司(货号为4691T、4060T、4257T、17366S),HRP山羊抗兔IgG(H+L)抗体购自Abclonal公司(货号为AS014);siRNA、PCR引物,广州瑞博生物科技有限公司合成;RiboFECT CP转染试剂盒,购自广州瑞博生物科技有限公司(货号为C10511- 1);总RNA TriPure分离试剂盒,购自BioTeke公司(货号为RP1002);PrimeScript RT反转录试剂盒,购自TaKaRa公司(货号为RR047A);AceQ qPCR SYBR Green Master混合试剂盒,购自Vazyme公司(货号为Q131- 02);RIPA缓冲液(中)、BCA蛋白浓度测定试剂盒、PMSF、SDS- PAGE凝胶快速配制试剂盒、QuickBlockTM封闭缓冲液、QuickBlockTMWestern一抗稀释液、QuickBlockTMWestern二抗稀释液、TBSTw (10X)、特超敏ECL化学发光试剂盒,购自碧云天生物科技公司(货号为P0013C、P0012、ST506、P0012AC、P0231、P00256、P00258、ST677、P0018AS)。
1.2 方法
1.2.1 细胞系培养 人胆管癌HUCCT1、RBE、9810细胞株用含10%胎牛血清、1%双抗的RPMI 1640培养基在37 ℃、5%CO2的培养箱中培养,待其贴壁生长至约80%融合时用胰酶消化传代。
1.2.2 实时荧光定量PCR(qPCR) 使用Total RNA TriPure分离试剂盒从组织或细胞中提取总RNA。使用PrimeScript RT反转录试剂盒反转录cDNA,并使用AceQ qPCR SYBR Green Master混合试剂盒在ABI 7500 RT- PCR仪器中进行qPCR实验。以GAPDH作为内参,PCR序列如下:GAPDH前引物为5- TGTGGGCATCAATGGATTTGG- 3,后引物为5- ACACCATGTATTCCGGGTCAAT- 3;KIFC1前引物为5- GCCAACAGGAGCTGAAGAAC- 3,后引物为5- CTTCCTGCAATTCCACCTGT- 3。
1.2.3 细胞转染 siNC和siKIFC1由广州瑞博生物科技有限公司合成。将细胞按30%密度接种于6孔板上,用RiboFECT CP转染试剂盒将siNC与siKIFC1分别转染于RBE与9810细胞,48 h后收集转染细胞进行后续实验。
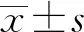
1.2.5 Transwell法检测体外细胞迁移和侵袭能力 RBE与9810细胞转染48 h后用胰酶消化,使用Opti- MEM无血清培养基重悬,然后每孔40 000个细胞接种于Transwell小室上室,下室加入RPMI 1640+10%胎牛血清,孵育24 h后用棉签将残留在上室的细胞擦除,迁移到下室的细胞用4%多聚甲醛固定30 min,0.1%结晶紫染色15 min,应用显微镜观察。用类似方法进行Transwell侵袭分析,Transwell小室上室覆盖 Matrigel基质胶。
1.2.6 流式细胞术检测细胞凋亡 取转染后细胞制成细胞悬液,PBS洗涤两次,重悬于1×100 μl结合缓冲液。按AnnexinV- FITC/PI细胞凋亡双染试剂盒说明书加入AnnexinV- FITC 10 μl和碘化丙锭(PI)5 μl,混匀,避光反应15 min,加入400 μl结合缓冲液后上 FACSCanto TM Ⅱ 流式细胞仪检测,使用Flowjo软件作图。
1.2.7 蛋白质印迹实验检查细胞蛋白变化 在4 ℃下用RIPA缓冲液提取细胞总蛋白约30 min,用PMSF抑制蛋白质降解。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,蛋白含量为15~20 μg的样品按分子量不同在8%~12%SDS- PAGE凝胶上分离,然后在250 nA下用Mini Trans- Blot(BIORAD)将蛋白转移至PVDF膜上2 h。在室温下用QuickBlockTM封闭缓冲液封闭约30 min后将膜与相应的一抗在4 ℃下孵育过夜,一抗用QuickBlockTM蛋白印迹一抗稀释缓冲液稀释。膜经TBST洗涤3次后与二抗在室温中孵育45 min,二抗用QuickBlockTM蛋白印迹二抗稀释缓冲液稀释,用特超敏ECL化学发光试剂盒检测蛋白条带。
1.3 统计学处理
所有实验独立重复3次,采用Graphpad Prism软件8.00进行数据分析。数据均采用SW法行正态性检测,F检验统计两组数据是否方差相同。采用配对t检验、独立t检验、双因素方差分析、单因素方差分析对数据进行统计学处理。P<0.05为差异有统计学意义。
2 结 果
2.1 胆管癌组织和细胞系KIFC1表达量增加
根据GEPIA数据库(Gene Expression Profile Interactive Analysis)的数据,我们发现KIFC1在胆管癌组织中的表达量明显高于正常组织(图1)(P<0.05)。如图2所示,高表达KIFC1的胆管癌患者的预后要差于低表达者,但差异无统计学意义。为了确定KIFC1在胆管癌中的表达水平,我们首先对6对胆管癌及其癌旁组织进行了qRT- PCR实验,结果显示KIFC1在肿瘤组织中的表达明显高于癌旁组织。胆管癌组和癌旁组的差值经检测符合正态分布,P=0.249 5。胆管癌组和癌旁组经检验,t=2.711 ,P=0.0422(图3)。因此,我们推测KIFC1可能在胆管癌的发生发展中起重要作用。
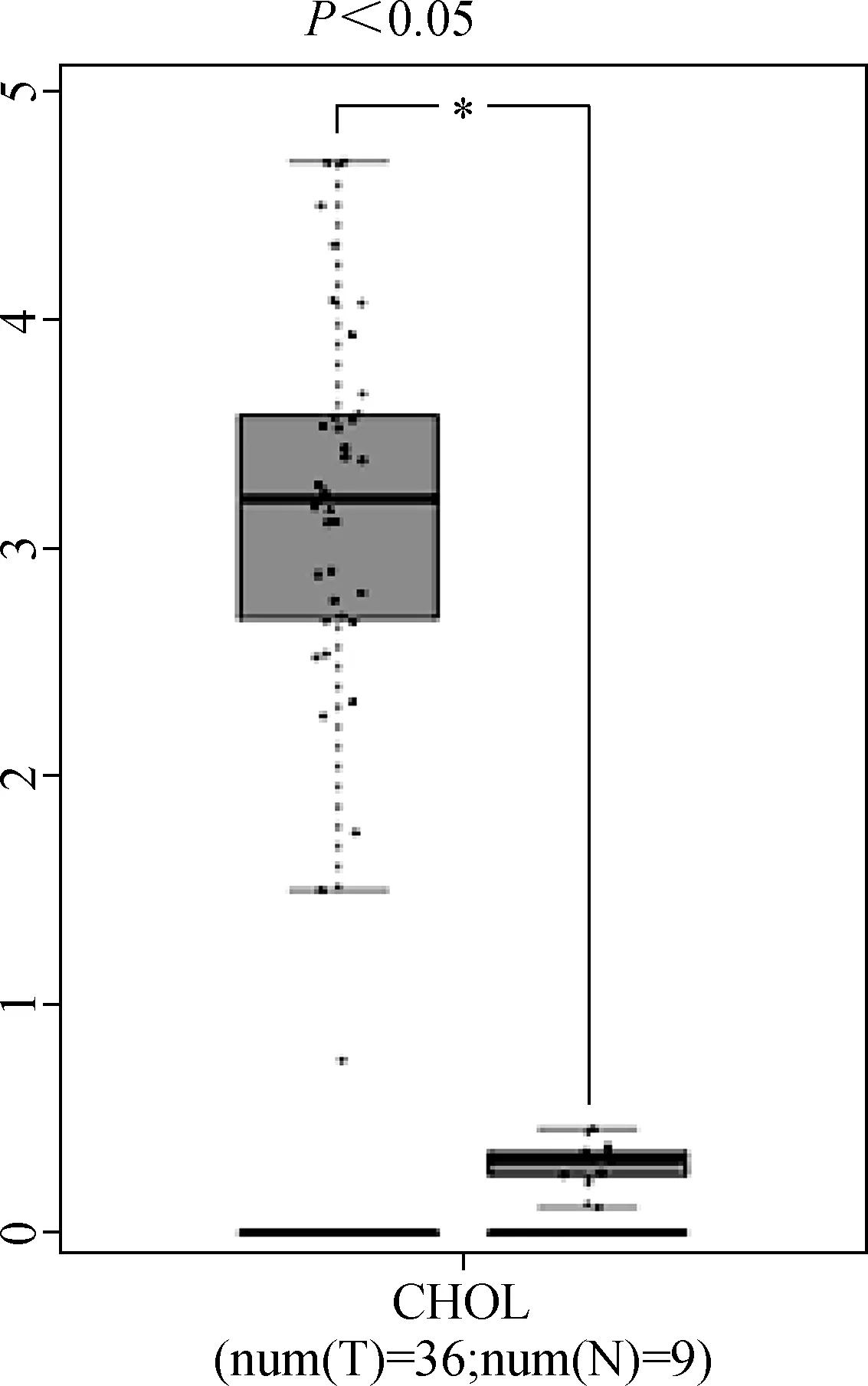
图1 GEPIA数据库中KIFC1在胆管癌中的表达
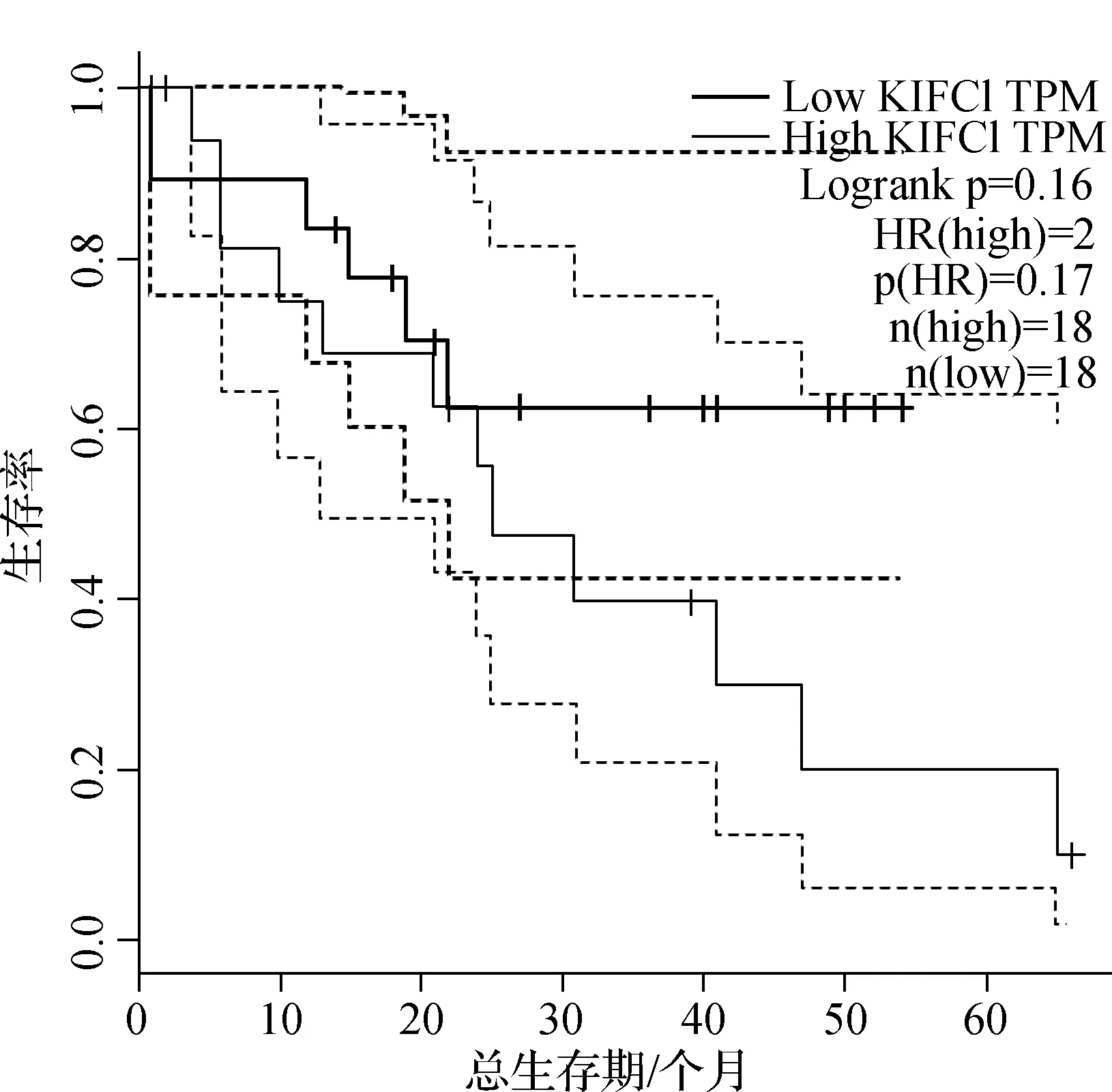
图2 KIFC1与胆管癌预后的关系
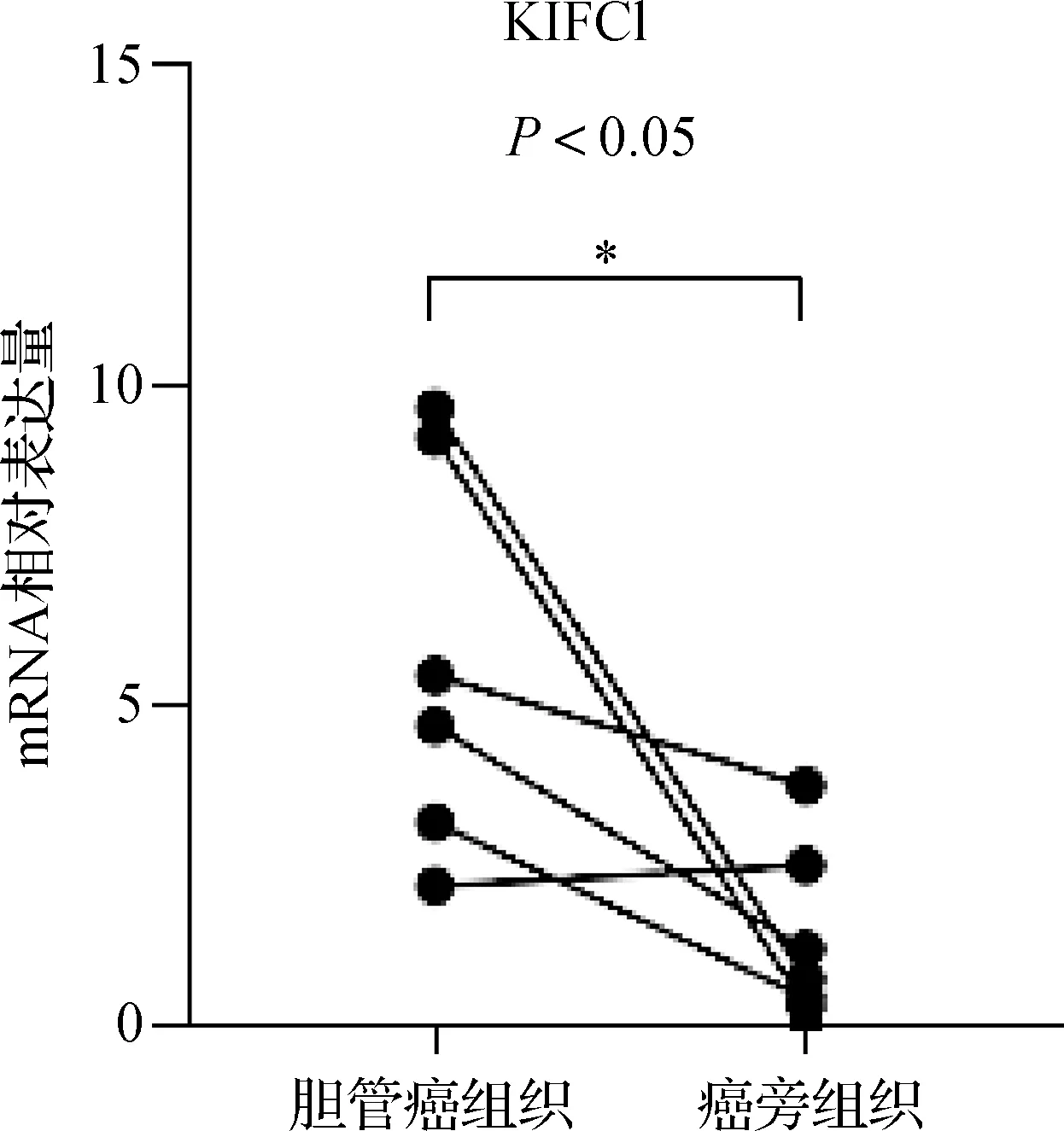
图3 qPCR检测6对胆管癌与癌旁组织中KIFC1的表达量
2.2 KIFC1敲减降低胆管癌细胞增殖能力
通过qRT- PCR检测KIFC1在RBE、HUCCT1、9810 3种胆管癌细胞系中的表达,选择KIFC1表达水平较高的RBE与9810细胞进行后续研究。为了验证KIFC1对胆管癌细胞的影响,我们用siRNAs转染RBE与9810细胞,并检测了siKIFC1对胆管癌细胞的敲除效率(图4、5)。根据转染效率,RBE采用siKIFC1- 2,9810采用siKIFC1- 1分别进行转染。为了研究KIFC1在胆管癌细胞增殖中的作用,我们首先将siRNA转入RBE与9810细胞,然后进行CCK- 8实验。图6显示当KIFC1敲减后,细胞增殖能力受到抑制。采用双因素方差分析比较,9810细胞中siNC组和siKIFC1组P=0.001,DAY2P=0.018 0,DAY3P=0.033 8,DAY4P=0.019 5;RBE细胞中siNC组和siKIFC1组P=0.003 2,DAY2P=0.0147,DAY3P=0.045 3,DAY4P=0.018 9。
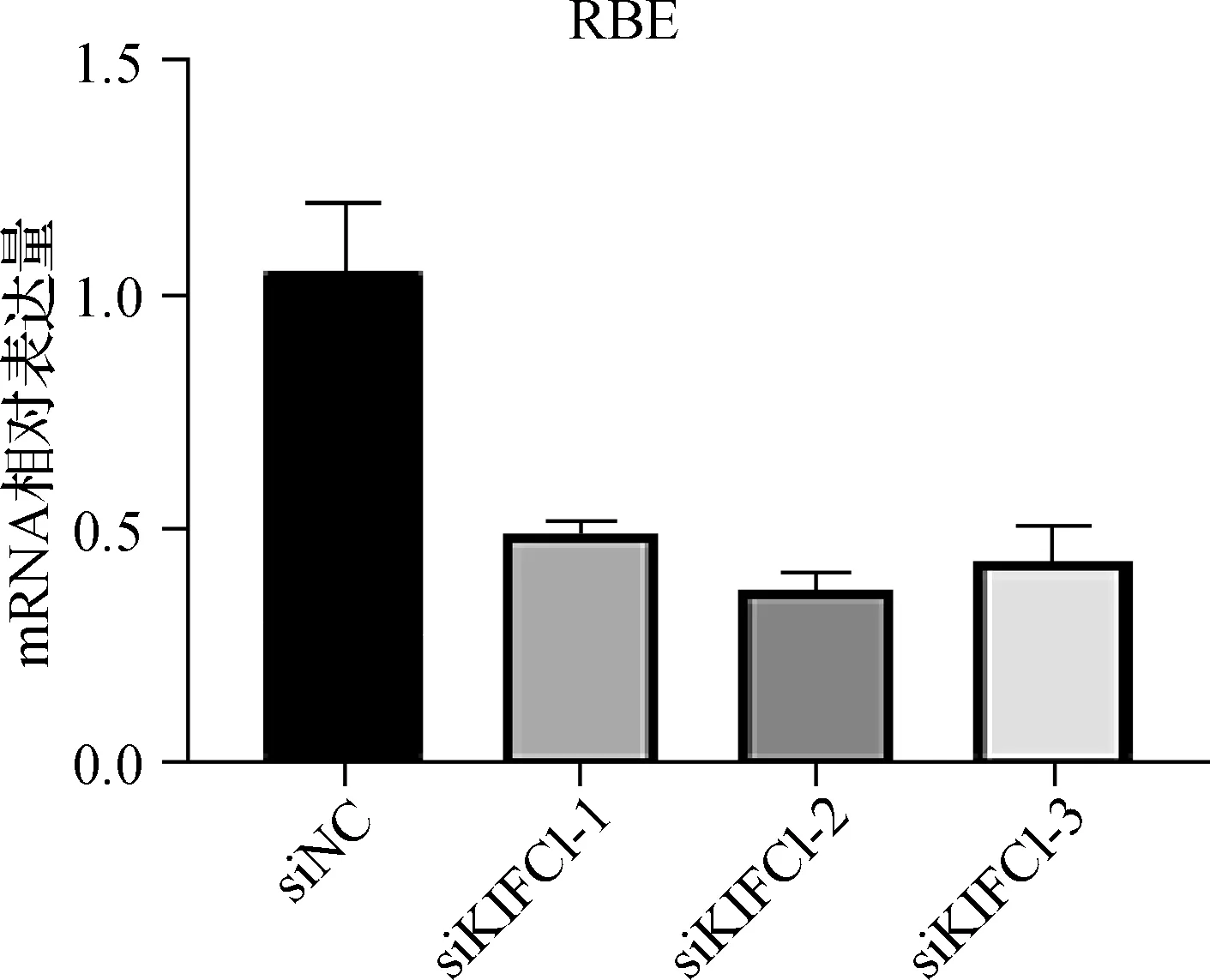
图4 siKIFC1在RBE细胞中的转染效率
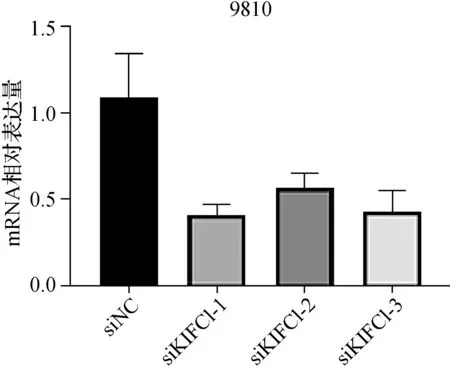
图5 siKIFC1在9810细胞中的转染效率
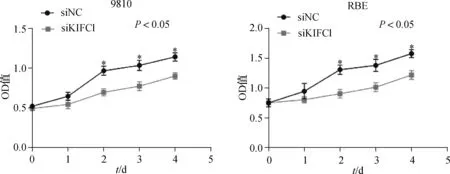
图6 KIFC1抑制后9810与RBE细胞的CCK- 8值
2.3 KIFC1促进RBE和9810细胞的迁移与侵袭
用Transwell法检测KIFC1抑制是否影响胆管癌细胞的迁移和侵袭能力。RBE与9810细胞转染48 h后进行Transwell实验,如图7~10所示,抑制KIFC1可显著抑制胆管癌细胞的迁移和侵袭能力。两种胆管癌细胞siNC组和siKIFC1组经检测,均P>0.1,均符合正态分布。经F检验均P>0.1,认为两组数据方差相同。在迁移实验中,RBE细胞siNC组和siKIFC1组t=5.438,P=0.005 6;9810细胞siNC组和siKIFC1组t=5.025,P=0.007 4。在侵袭实验中,RBE细胞siNC组和siKIFC1组t=15.81,P<0.000 1;9810细胞siNC组和siKIFC1组t=5.212,P=0.006 5。
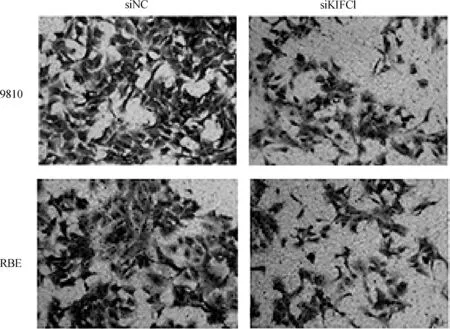
图7 KIFC1抑制后9810与RBE细胞的Transwell迁移图
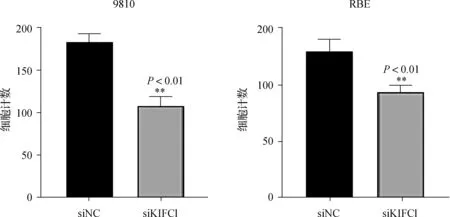
图8 9810与RBE细胞的迁移统计条形图
2.4 KIFC1抑制 RBE与9810细胞的凋亡
为了揭示KIFC1是否影响细胞凋亡,我们对两组RBE与9810细胞(siNC/siKIFC1)进行了Annexin V/PI流式细胞术分析,结果显示,抑制KIFC1可显著增加凋亡细胞和死亡细胞的数量(图11),这表明KIFC1的下调影响了胆管癌细胞的凋亡。两种胆管癌细胞siNC组经检验,均P>0.1,均符合正态分布。F检验均P>0.1,认为两组数据方差相同。RBE细胞siNC组和siKIFC1组t=6.004,P=0.003 9;9810细胞siNC组和siKIFC1组t=10.69P=0.000 4。
2.5 KIFC1敲减后磷酸化的PI3K/AKT降低,而PI3K/AKT不改变
据报道,PI3K/AKT通路磷酸化的激活在多种肿瘤中起重要作用。为了确定PI3K/AKT信号通路是否与KIFC1诱导的细胞凋亡有关,我们采用蛋白质印迹法检测了PI3K/AKT的表达和p- PI3K/p- AKT的蛋白水平。如图12所示,我们发现当KIFC1被抑制时p- PI3K和p- AKT的表达水平明显下降。两种胆管癌细胞siNC组和siKIFC1组经检验,均P>0.1,均符合正态分布。采用单因素方差分析,RBE细胞中siNC组和siKIFC1组比较,p- PI3K的P=0.001 1,p- AKT的P=0.022 5,PI3K与AKTP值显示差异均无统计学意义。9810细胞中,siNC组和siKIFC1组比较,p- PI3K的P=0.001 9,p- AKT的P=0.002 7,PI3K与AKTP值显示差异均无统计学意义。
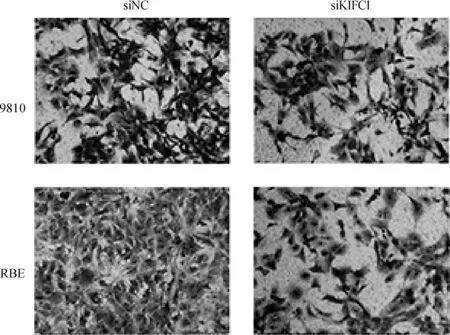
图9 KIFC1抑制后9810与RBE细胞的Transwell侵袭图
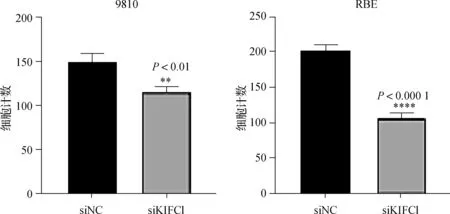
图10 9810与RBE细胞的侵袭统计条形图
3 讨 论
我们将KIFC1作为研究对象,KIFC1是激肽蛋白14家族中一种末端导向的蛋白。激肽是一种分子马达蛋白,在细胞内转运和细胞分裂中发挥重要作用。研究[8- 10]表明,KIFC1参与多种肿瘤,包括乳腺癌、卵巢癌、前列腺癌、非小细胞肺癌和食管鳞癌的发生和发展。在我们设计这项研究时,尚未有研究关注KIFC1在胆管癌中的表达以及其影响机制。虽然KIFC1是一种非必需的驱动蛋白,但在具有额外中心体的癌细胞中起着重要作用,它在含有多个中心体的癌细胞中聚集中心体,以避免多极细胞分裂。因此,癌细胞可以存活并继续生长[12]。我们检索了GEPIA数据库,发现与正常组织相比,KIFC1在胆管癌组织中高表达(P<0.05)。高表达KIFC1的胆管癌患者的预后要差于低表达组,但是差异无统计学意义。此外,我们还通过qRT- PCR分析结果证实KIFC1在胆管癌中高表达。于是,我们推测KIFC1对胆管癌的进展起关键作用。
胆管癌是一种侵袭性强的肿瘤,进展快、预后差[13]。增殖和转移能力是恶性肿瘤最具破坏性的方面。CCK- 8实验是检测细胞活力的重要手段,通过CCK- 8实验我们观察到,KIFC1敲减之后OD值明显降低,提示细胞活性增殖能力下降。本研究中我们发现,抑制KIFC1可以减少胆管癌的迁移和侵袭。
细胞凋亡也称为程序性细胞死亡,是一种进化保守的细胞死亡途径[14]。在癌症中,抑制凋亡信号对于阻止癌症的进展至关重要[15]。Parvin等[16]研究发现,抑制KIFC1可以诱导前列腺癌细胞凋亡增加。Zhang等[17]发现,KIFC1基因敲除可抑制胃癌细胞增殖并促进其凋亡。Fu等[18]发现KIFC1抑制对肝癌细胞凋亡有促进作用,KIFC1与癌细胞凋亡抑制有关[18]。我们的结果进一步验证了在KIFC1缺乏的胆管癌细胞中,凋亡细胞的比例明显高于对照组。根据Zhou等[19]的研究,KIFC1通过调节PI3K/AKT信号通路促进子宫内膜癌细胞增殖和侵袭。Han等[20]的研究显示,KIFC1通过Gankyrin/AKT信号促进肝癌上皮向间充质转化和转移。我们推测KIFC1促进胆管癌细胞恶性生物学行为与PI3K/AKT信号通路有关。PI3K/AKT通路是一个经典的信号通路,具有调节肿瘤的发展,包括增殖、凋亡、代谢、EMT和自噬的作用[21- 22]。本研究中我们发现,当胆管癌细胞中KIFC1被抑制时p- PI3K和p- AKT的表达水平明显下降,而PI3K和AKT的表达水平没有太大的改变,这表明在胆管癌中KIFC1可以通过PI3K/AKT信号通路发挥作用。
本研究中我们确定了KIFC1和PI3K/AKT信号通路在胆管癌发生发展中的相互作用,然而,还有一些问题尚未解决。限于实验条件,我们没有通过体内实验研究验证KIFC1对胆管癌的作用。此外,虽然数据库表明KIFC1与胆管癌的预后有关,但由于病例数量有限,差异无统计学意义,我们也未收集患者的临床资料与KIFC1进行研究。最后,KIFC1与PI3K/AKT信号通路相互作用的具体机制尚不明确。以上几点是我们未来研究的方向。
综上所述,我们的研究提示KIFC1与胆管癌恶性生物学行为有关。此外,抑制KIFC1可通过调控PI3K/AKT信号通路有效地抑制胆管癌细胞的增殖和转移,促进细胞凋亡。KIFC1可能是延缓胆管癌进展的一种新的治疗靶点,其有可能作为一种新的肿瘤诊断标志物和相关治疗手段应用于胆管癌。

