过表达miR-21对脂多糖诱导人牙髓干细胞炎症、凋亡和自噬的影响
林玉祥,林慧,车立纯,田河
1 厦门医学院附属口腔医院牙体牙髓病二科,福建厦门361000;2 厦门市口腔疾病诊疗重点实验室;3 青岛市中心医院口腔科
人牙髓干细胞(hDPSCs)具有自我更新能力、高增殖能力及多向分化能力[1],具有众多潜在的临床治疗作用,但炎症微环境会限制其各种自我更新及分化能力,从而影响其应用[2]。微小RNA(miRNA)是一类内生的、长度为20~24 个核苷酸的小RNA,其在细胞内具有多种重要的调节作用。miRNA 表达与hDPSCs 的增殖、多向分化、衰老和其他生命过程均密切相关[3]。研究显示,miR-21 广泛参与机体炎症、凋亡、自噬等多种病理生理过程[4-6]。NARA等[7]研究发现,miR-21 可减轻脂多糖(LPS)诱导的hDPSCs 炎症反应。但是,miR-21 对hDPSCs 炎症反应、凋亡和自噬的影响鲜见报道。为此,我们于2020 年6 月—2021 年2 月进行了如下研究。
1 材料与方法
1.1 材料 细胞:hDPSCs 购自上海赛百慷生物技术股份有限公司。质粒:miR-21 mimics、miR-NC mimics均购自广州锐博生物技术有限公司。主要试剂:白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)ELISA 试剂盒均购自上海碧云天生物技术有限公司,DMEM 培养基、10%胎牛血清、青—链霉素、LPS均购自美国Sigma公司;胰蛋白酶购自美国Gibco 公司,Hoechst 染色试剂盒购自上海碧云天生物技术有限公司,Annexin V-FITC/PI 双染色细胞凋亡检测试剂盒购自北京索莱宝科技有限公司,BCA 试剂盒购自北京百奥莱博科技公司;CD34、CD45、CD90、CD105 抗体均购自美国Thermo Fisher Scientific 公司,裂解的半胱氨酸蛋白酶3(Cleaved Caspase-3)、死骨片1(p62)、自噬微管相关蛋白轻链3 抗体(LC3B)、内参GAPDH 一抗及辣根过氧化酶标记的IgG均购自英国Abcam公司。
1.2 hDPSCs 细胞培养及鉴定 将hDPSCs 置于含10% 胎牛血清和青—链霉素双抗的DMEM 培养基中,置于37 ℃、5% CO2培养箱中。每隔3 d 传代1次,取第3~4 代、生长状态良好的细胞,胰酶消化,收集细胞,离心半径8 cm,1 000 r/min 离心5 min,PBS 洗涤,重悬细胞。向相应流式管中加入CD34、CD45、CD90、CD105抗体,通过流式细胞仪检测细胞表面标志物表达情况。结果显示,hDPSCs细胞表面高表达CD90、CD105,低表达CD34、CD45,证实该细胞为hDPSCs。见OSID码图1。
1.3 LPS 浓度筛选 取生长良好的第3~4 代hDPSCs,胰蛋白酶消化,收集细胞并制成细胞悬液,以2×103/孔接种于96 孔板中。培养过夜后,分别加入不同浓度LPS(0、0.1、1、5、10 μg/mL),作用48 h。收取细胞上清液,使用ELISA 试剂盒检测细胞上清液中IL-1β、IL-6、TNF-α 水平,严格按照试剂盒说明书进行操作。结果显示,与0 μg/mL LPS 作用后比较,hDPSCs 经0.1、1、5、10 μg/mL LPS 作用后细胞上清液IL-1β、IL-6、TNF-α 水平均升高,且不同浓度间比较P均<0.05。见表1。结合文献报道,10 μg/mL LPS可显著降低hDPSCs的细胞存活率[8]。因此,选定5 μg/mL LPS进行后续实验。
表1 hDPSCs经不同浓度LPS作用后细胞上清液IL-1β、IL-6、TNF-α水平比较(pg/mL,± s )
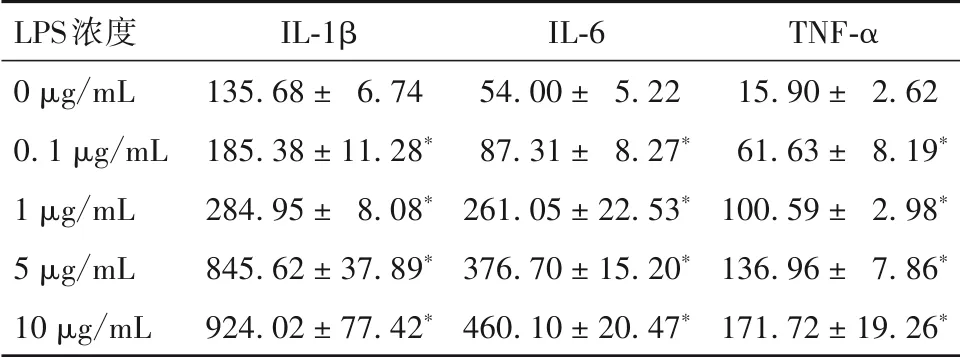
表1 hDPSCs经不同浓度LPS作用后细胞上清液IL-1β、IL-6、TNF-α水平比较(pg/mL,± s )
注:与0 μg/mL LPS作用后比较,*P<0.05。
LPS浓度0 μg/mL 0.1 μg/mL 1 μg/mL 5 μg/mL 10 μg/mL IL-1β 135.68 ± 6.74 185.38 ± 11.28*284.95 ± 8.08*845.62 ± 37.89*924.02 ± 77.42*IL-6 54.00 ± 5.22 87.31 ± 8.27*261.05 ± 22.53*376.70 ± 15.20*460.10 ± 20.47*TNF-α 15.90 ± 2.62 61.63 ± 8.19*100.59 ± 2.98*136.96 ± 7.86*171.72 ± 19.26*
1.4 细胞分组处理 取生长良好的第3~4代hDPSCs,胰蛋白酶消化,收集细胞并制成细胞悬液,以1×104/孔接种于96 孔板中。待细胞生长至70% 左右,随机分为对照组、LPS 组、LPS+miR-NC mimics组、LPS+miR-21 mimics 组,LPS+miR-NC mimics 组、LPS+miR-21 mimics 组分别使用Lipofectamine 2000转染试剂转染miR-NC mimics、miR-21 mimics。各组作用4 h,更换为含10% 胎牛血清的DMEM 培养基,LPS 组、LPS+miR-NC mimics 组、LPS+miR-21 mimics 组均加入5 μg/mL LPS,置于培养箱中继续培养48 h。
1.5 细胞上清液IL-1β、IL-6、TNF-α 水平检测 采用ELISA 法。收集各组细胞上清液,使用ELISA 试剂盒检测IL-1β、IL-6、TNF-α 水平,严格按照试剂盒说明书进行操作。
1.6 细胞凋亡率检测 采用流式细胞术。取生长良好的第3~4 代hDPSCs,胰蛋白酶消化,收集细胞并制成细胞悬液,以1.5×104/孔接种于24 孔板中,按照1.4进行分组处理。胰酶消化后收集细胞,PBS洗涤,加入Binding buffer 缓冲液100 μL,重悬细胞。向细胞混悬液中加入Annexin V-FTIC 溶液5 μL,混合均匀,避光孵育10 min。向细胞中加入PI 5 μL,轻轻混匀,室温避光孵育15 min。置于冰浴中,使用流式细胞仪检测细胞凋亡率。
1.7 细胞凋亡及自噬相关蛋白表达检测 采用Western blotting 法。取生长良好的第3~4 代hDPSCs,胰蛋白酶消化,收集细胞并制成细胞悬液,以7×105/孔接种于24孔板中,按照1.4进行分组处理。胰酶消化后收集细胞,加入RIPA 裂解液,37 ℃水浴30 min,离心后取上清,使用BCA 蛋白质定量试剂盒检测蛋白浓度。将30 μg 蛋白上样进行SDS-PAGE电泳分离,并转移到PVDF 膜上。5% 脱脂牛奶封闭1 h,TBST 洗涤3 次。加入Cleaved Caspase-3、p62、LC3B、GAPDH(稀释比例分别为1∶500、1∶200、1∶3 000、1∶5 000)一抗,4 ℃孵育过夜;TBST 洗涤3 次,加入二抗孵育1 h,TBST洗涤3次。ECL发光,凝胶成像系统成像分析条带灰度值。以GAPDH为内参,计算目的蛋白相对表达量。
1.8 统计学方法 采用SPSS21.0统计软件。计量资料以±s表示,多组间比较采用方差分析,两组间比较采用Student-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞上清液IL-1β、IL-6、TNF-α 水平比较 见表2。
表2 各组细胞上清液IL-1β、IL-6、TNF-α水平比较(pg/mL,± s )

表2 各组细胞上清液IL-1β、IL-6、TNF-α水平比较(pg/mL,± s )
注:与对照组比较,*P<0.05;与LPS组及LPS+miR-NC mimics组比较,#P<0.05。
组别对照组LPS组LPS+miR-NC mimics组LPS+miR-21 mimics组IL-1β 138.73 ± 3.86 780.05 ± 14.45*782.61 ± 20.20*404.87 ± 22.18*#IL-6 60.06 ± 8.82 426.36 ± 48.72*425.42 ± 85.83*194.35 ± 24.39*#TNF-α 9.50 ± 1.06 163.29 ± 30.77*193.05 ± 17.39*29.18 ± 6.02*#
2.2 各组细胞凋亡率比较 对照组、LPS 组、LPS+miR-NC mimics 组、LPS+miR-21 mimics 组细胞凋亡率分别为1.4% ± 0.2%、30.8% ± 1.3%、31.5% ±0.8%、10.4% ± 0.9%;与对照组比较,LPS 组、LPS+miR-NC mimics 组、LPS+miR-21 mimics 组细胞凋亡率均升高,且LPS 组、LPS+miR-NC mimics 组升高更明显(P均<0.05)。
2.3 各组细胞凋亡和自噬相关蛋白表达比较 见表3。
表3 各组细胞Cleaved Caspase-3、p62、LC3B蛋白相对表达量比较(± s )
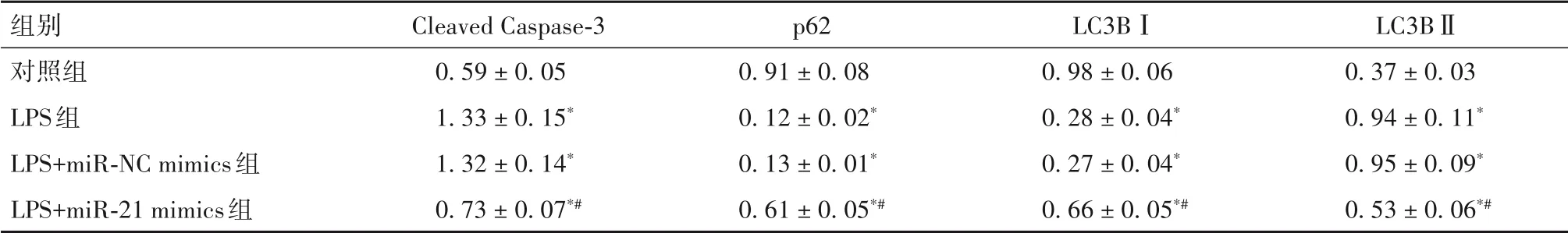
表3 各组细胞Cleaved Caspase-3、p62、LC3B蛋白相对表达量比较(± s )
注:与对照组比较,*P<0.05;与LPS组及LPS+miR-NC mimics组比较,#P<0.05。
组别对照组LPS组LPS+miR-NC mimics组LPS+miR-21 mimics组Cleaved Caspase-3 0.59 ± 0.05 1.33 ± 0.15*1.32 ± 0.14*0.73 ± 0.07*#p62 0.91 ± 0.08 0.12 ± 0.02*0.13 ± 0.01*0.61 ± 0.05*#LC3BⅠ0.98 ± 0.06 0.28 ± 0.04*0.27 ± 0.04*0.66 ± 0.05*#LC3BⅡ0.37 ± 0.03 0.94 ± 0.11*0.95 ± 0.09*0.53 ± 0.06*#
3 讨论
hDPSCs具有多向分化的潜力,能够分化成牙本质细胞、脂肪细胞和神经细胞。近年来,干细胞治疗和再生医学取得了巨大进展。临床研究结果表明,hDPSCs 对于牙髓和牙周组织再生以及颌面部骨组织缺损修复是安全有效的[1]。LPS 是革兰阴性细菌细胞壁的组成成分,是牙髓炎的重要致病因子。研究证实,LPS 可以使hDPSCs 产生大量炎症因子,诱导发生细胞炎症反应[9]。本研究结果显示,LPS可刺激hDPSCs 生成IL-1β、IL-6 和TNF-α,并呈剂量依赖性。因既往文献报道,10 μg/mL LPS 可显著降低hDPSCs 的细胞存活率[8]。因此,本研究选定5 μg/mL LPS 进行后续实验。研究显示,多种miRNA 参与了牙髓组织炎症反应的调节过程[10]。在牙髓炎的发生过程中,牙髓组织中多种miRNA 表达改变均可影响hDPSCs 的活性和分化潜能[11]。SONG 等[12]研究显示,miR-21 介导了LPS 刺激人牙髓成纤维细胞的炎症过程[13]。本研究结果显示,与对照组比较,LPS 组、LPS+miR-NC mimics 组、LPS+miR-21 mimics组细胞上清液IL-1β、IL-6、TNF-α 水平均升高,且LPS 组、LPS+miR-NC mimics 组升 高更明显;表明LPS 可诱导hDPSCs 分泌IL-1β、IL-6 和TNF-α,而过表达miR-21可以显著抑制LPS诱导的炎症反应。
细胞凋亡在生物体进化、内环境稳定及多个系统发育中均具有重要作用[14]。有研究表明,细胞凋亡参与调控牙胚组织和牙源性细胞的发育[15]。Caspase-3 是细胞凋亡过程中最重要的末端剪切酶,在正常组织中以非活性方式存在,但在凋亡途径中会被激活[16]。本研究结果显示,与对照组比较,LPS组、LPS+miR-NC mimics 组、LPS+miR-21 mimics 组细胞凋亡率及Cleaved Caspase-3表达均升高,且LPS组、LPS+miR-NC mimics 组升高更明显;表明LPS 可诱导hDPSCs 细胞凋亡,而过表达miR-21 可以显著抑制LPS 诱导的细胞凋亡。既往研究显示,miR-21可以通过降低Bax/Bcl-2 和Caspase-3 活性来抑制LPS诱导的肾细胞凋亡,与本研究结果一致[17]。
细胞炎症反应将刺激各种自噬相关蛋白的表达变化,从而参与炎症发病机制的调控。LC3Ⅱ和LC3Ⅱ/LC3Ⅰ在临床多用于评估自噬水平。p62作为自噬的选择性底物,可进入自噬体并在自噬后期被降解,因此其表达水平通常与自噬水平呈负相关关系。研究显示,LPS 和成骨诱导液可通过上调hDPSCs中LC3B、p62和Beclin1等自噬相关蛋白表达,而促进hDPSCs 的分化和基质矿化[18]。本研究结果显示,与对照组比较,LPS 组、LPS+miR-NC mimics 组、LPS+miR-21 mimics 组细胞LC3B Ⅱ表达均升高,p62、LC3BⅠ表达均降低,且LPS 组、LPS+miR-NC mimics 组变化更明显;提示LPS 通过上调LC3BⅡ、下调p62 和LC3BⅠ蛋白表达来诱导hDPSCs 发生自噬,而过表达miR-21 可以通过抑制细胞自噬而保护hDPSCs免受LPS的损害。
综上所述,LPS 可诱导hDPSCs 发生炎症反应,并促进其凋亡和自噬,而过表达miR-21 可以抑制LPS 的上述作用。本研究不仅为研究牙髓炎反应的病理损伤提供了理论依据,也为预防和治疗牙髓病提供了实验依据。

