植物硝态氮吸收和转运的调控研究进展
刘海光 罗振 董合忠
(1. 山东师范大学生命科学学院,济南 250014;2. 山东棉花研究中心,济南 250100)
氮素是植物生长发育必不可少的营养元素,维持着植物体内正常物质循环和能量代谢[1]。在农业生产中,合理控制氮肥用量是作物获得高产的重要措施。氮肥供应不足,不能发挥品种和灌溉等其他农艺措施的增产效果。因此,近几十年来,增施氮肥已成为我国追求作物高产的重要手段。自1961年以来,氮肥施用量增加了8倍多,2017年我国的氮肥用量为2.311×107t[2-3]。氮肥施用量持续增加,但作物产量并未成比例增加,盲目大量的增施氮肥导致植物氮素利用效率(nitrogen use efficiency,NUE)大幅下降[4]。氮肥过量施用,不仅增加了能源损耗,提高了农作物的生产成本,给农业生产可持续性造成了巨大的阻碍,而且使土壤质量下降、水体富营养化和温室气体排放等一系列环境污染问题也日益突出[5]。
植物氮素利用主要包括吸收和转运两个过程,要提高作物氮素利用效率,就必须深入了解氮素吸收和转运关键组分的功能和调控机制[6]。近年来,随着分子生物技术的不断发展,关于植物氮素利用相关酶和基因的功能与调控机制得到深入揭示。本文综述了近年来国内外关于植物氮素吸收和转运生理过程和分子调控机制等方面的最新研究成果,并对今后的研究进行了展望,以期为科学施用氮肥和提高氮肥利用效率提供依据和指导。
1 植物氮素吸收机制
植物可以吸收无机氮,也可以利用一些含氮的有机物,相较于有机氮,无机氮则更容易被植物吸收。土壤中的无机氮包括NO3-和NH4+,对于大部分植物尤其是旱生植物来说,NO3-是主要氮源[7]。土壤中的NO3-浓度波动很大,为了适应土壤中NO3-的浓度变化,植物进化出两种NO3-吸收系统,分别是高亲和力转运系统(high-affinity transporter system,HATS)和低亲和力转运系统(low-affinity transporter system,LATS)[8]。两个转运系统吸收硝态氮都是主动耗能的过程,通过质子梯度提供能量,相互依存,协同合作使植物能够有效吸收土壤中的NO3-[9]。
植物从土壤获取NO3-主要是由硝态氮转运蛋白(nitrate transporter,NRTs)介导的,包括2个NRT1转运蛋白(NRT1.1和NRT1.2)和4个NRT2(NRT2.1、NRT2.2、NRT2.4和NRT2.5)转运蛋白(图1)。在拟南芥中,AtNRT1.1是一种双亲和NO3-转运体,这取决于Thr101位点残基的磷酸化状态,当介质中NO3
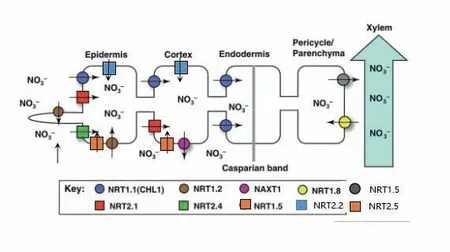
图1 根中硝态氮吸收运动模式图(改自文献[5])Fig. 1 Model diagram of NO3- uptake and transport in root (Modified from reference[ 5])
-含量较低时,AtNRT1.1的Thr101位点残基磷酸化,使其转变为高亲和转运体,参与低浓度硝态氮的吸收;当介质中硝态氮浓度较高时,AtNRT1.1去磷酸化,转变为低亲和转运体,参与高浓度状态下的NO3-吸收[10]。这种磷酸化由蛋白激酶CIPK23调节[11]。双亲和性并非NRT1.1所独有,钾转运蛋白KUP和硝酸盐转运蛋白MtNRT1.3也显示出双亲和转运蛋白的活性[12]。NRT1.1在根、幼叶以及花蕾中表达,除了吸收土壤中的NO3-,还可以作为NO3-的信号感受器参与调控植物的侧根发育、基因表达和种子萌发等[13],这说明NRT1.1在植物生长发育过程的调控中具有多效性。在谷类作物中已鉴定出NRT1.1的同源基因。例如,小麦中的同源基因TaNPF6.1、TaNPF6.2、TaNPF6.3和TaNPF6.4以及水稻中的OsNPF6.3、OsNPF6.5(OsNRT1.1b)和OsNPF6.4,由于作物种类的不同,它们都具有各自独特的表达模式[14-16]。
除了NRT1.1,NRT1.2编码的蛋白质也在低亲和性的NO3-转运系统中发挥作用[8,17]。相关研究结果表明,AtNRT1.2不仅可以在外界NO3-浓度较高的情况下吸收NO3-,还可以转运脱落酸(abscisicacid,ABA)[18]。在拟南芥中AtNRT1.2表达不受NO3-的诱导,呈现组成型表达模式[19]。而在烟草(Nicotiana tabacum)分离和鉴定得到的NpNRT1.2表达严格依赖高浓度NO3-[20]。从甘蓝型油菜(Spinacia oleracea)中克隆到了拟南芥低亲和性NO3-转运蛋白的同源基因BnNRT1.2,受NO3-诱导表达,并且BnNRT1.2不仅可转运NO3-,也可以转运氨基酸(L-组氨酸)和肽[21]。这些研究表明,同一个基因由于物种不同可能衍生不同的功能。在NRT2家族中NRT2.1、NRT2.2、NRT2.4和NRT2.5参与低浓度硝态氮的吸收。在拟南芥中AtNRT2.1在根系NO3-吸收中起主导作用,Cerezo等[22]在atnrt2.1的突变体中发现HATs的活性降低了63%-75%。另外,OsNRT2.1在水稻中的过表达只是略微促进了水稻幼苗的生长,但并没有影响NO3-的吸收,这可能是由于缺乏与高亲和力NO3-运输的重要辅助因子OsNAR2.1的共同调节[23]。进一步研究发现,在OSNAR2.1基因的NO3-诱导启动子的驱动下,OsNRT2.1转基因植株的生物量显著增加,产量提高了38%,农业氮素利用效率提高到野生型植株的128%[24]。这些研究表明NRT2.1在低浓度NO3-的有效吸收和生物量增加中的重要作用。而AtNRT2.2发挥的作用较小,是对AtNRT2.1功能的补充;反向遗传学的研究表明,只有在NRT2.1缺失的情况下,NRT2.2才显著性表达[22]。AtNRT2.4也在根中表达,但其根系吸收NO3-的能力较弱,主要参与NO3-由韧皮部向叶片的运输,其亲和性比AtNRT2.1和AtNRT2.2更高[25]。AtNRT2.5主要位于根表皮和皮层,并且其转录受到N饥饿的强烈诱导,为植物有效利用氮素、正常生长提供保障[26]。
2 植物氮素转运机制
氮素供应充足时,植物的氮素利用效率主要取决于氮素吸收效率;而在氮素缺乏的条件下,植物的氮素利用效率则取决于体内氮素的运转效率[27]。有时作物产量的提高并不是因为提高了对NO3-的吸收能力,而是由于氮素高效转运提高了体内氮素的利用效率。研究发现,在作物的籽粒中,50%-90%的氮来自于营养器官氮素的转运再利用,开花后植物体内贮存氮的转运是生殖器官获得氮素的重要途径,甚至比重新吸收的氮对籽粒的贡献更大[28-29]。因此,研究植物氮素转运机制对于提高植物氮素利用效率同样具有现实意义。
植物从土壤中吸收的NO3-,一部分会被储存在液泡中;一部分被还原成NH4+并进一步同化形成氨基酸合成蛋白质参与根系氮代谢[30]。未被利用的NO3-和氨基酸等有机态氮则进入木质部导管在蒸腾拉力的驱动下向地上部运输[31],在地上部的茎、叶以及其他生殖生长器官中被还原,经同化反应形成谷氨酰胺和谷氨酸参与体内氮代谢[32]。
由根向地上部分转运是调节NO3-在植物体内分配的关键步骤,NO3-在地上、地下部分的分配比例分别由向上运输的木质部介导和向下运输的韧皮部介导[32](图2)。为了将根系吸收的NO3-转移到植物的地上部分,它必须装载到根部的木质部导管中。NRT1.5主要参与了这一步骤[33],NRT1.5在根部靠近原生木质部周围的中柱细胞中表达,是一种低亲和力的双向(流入-流出)硝酸盐转运体,负责将NO3-运出中柱鞘细胞,装载到木质部,转运到地上部分[34]。在nrt1.5突变体中,根部向地上部转运的NO3-相较于野生型减少,同时nrt1.5木质部伤流液NO3-含量也低于野生型植株[33]。在nrt1.5突变体中发现,地上部分K+含量相对缺乏,经研究表明NRT1.5是连接NO3-和K+信号通路的重要组成部分[34]。NRT1.8是已知的与NRT1.5一致性最高的蛋白,其氨基酸序列一致性高达64%[35],但是它却表现出与NRT1.5完全相反的作用。NRT1.8主要在根的木质部薄壁细胞中表达,通过卸载木质部中的NO3-来影响NO3-从根到地上部分的运输,nrt1.8突变体主要表现为木质部汁液中NO3-含量的增加和根到地上部NO3-转运的增加,这表明nrt1.8在将NO3-从木质部汁液中移回根细胞的过程中发挥了作用[36]。而对于韧皮部介导NO3-向下运输,目前只鉴定出了负责根部韧皮部装载的基因NRT1.9,负责韧皮部卸载的基因尚未找到[37-38]。在nrt1.9突变体中,根韧皮部分泌物中硝酸盐含量降低,硝酸盐向下运输减少,表现出促进根-冠运输和植株生长的作用[38]。这表明NRT1.8和NRT1.9都是从根到茎NO3-运输的负调控因子,但机制不同。迄今为止,对NRT基因与作物NO3-长距离运输关系的研究主要集中于小麦、水稻和油菜[39]。其中,对于小麦,只研究了NRT1.5和NRT1.8基因对氮素胁迫的响应[40];对于水稻,已分析了过量表达的NRT1.5的水稻品系的氮素生理特性[41];对于油菜,分析了NRT1.5、NRT1.8和NRT1.9对NO3-缺乏的响应,并构建了一个共表达网络,以寻找参与NO3-从油菜幼苗根到地上部运输的关键基因[42-43]。根据现有证据,基本可以确定NRT1.5、NRT1.8和NRT1.9调控NO3-在作物中的运输和分配。
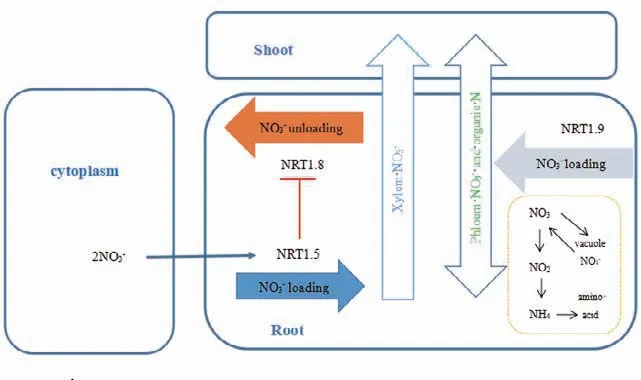
图2 NO3-在植物体内部运输简易模式图(改自文献[32])Fig. 2 Simplified model diagram of NO3- transportation inside the plant (Modified from reference[ 32])
NO3-被运输到叶片后,植物根据叶的发育阶段、氮需求和硝态氮储存能力决定硝态氮的同化或储存。不同组织间硝态氮的协调分配是高等植物高效利用硝态氮的关键[44]。在拟南芥中NRT1.4介导NO3-在叶柄中的储存,是双向转运蛋白,对硝态氮在叶片中的分配中起重要作用,nrt1.4突变体中叶柄处NO3-积累少而叶片积累多,导致叶片比野生型的叶片宽,这表明叶片中NO3-的分布影响了叶片的展开[45]。随着植物生长发育或者在缺氮的条件下,老叶片中的NO3-不断向新叶中转移,NRT1.7主要介导了这一过程[46]。在成熟叶片中,NRT1.7在叶脉的韧皮部中表达,负责装载老叶中的NO3-,运输至新叶,供新叶重新利用[37]。nrt1.7突变体在老叶中保留了大量的NO3-,在老叶的韧皮部汁液中含有更少的NO3-,并减少了NO3-向嫩叶的运输。另外,NRT1.11和NRT1.12这两个基因在展开的叶片中表达较高,主要功能是促进NO3-从成熟和较大的展开叶片到最幼嫩组织的再分配,而nrt1.11、nret1.12双突变体在高NO3-条件下表现出生长缺陷[47]。如上所述,NRT1.4负责NO3-在叶片中的分配,NRT1.7负责装载老叶中储存的NO3-,NRT1.11和NRT1.12负责在较大的展开叶中重新分配木质部携带的NO3-。与野生型相比,nrt1.4叶片更宽,nrt1.7功能的丧失会降低植物在N饥饿条件下的生长,而nrt1.11、nrt1.12双突变体在高NO3-条件下表现出生长缺陷。这表明植物为适应不同的硝酸盐条件而采取不同的NO3-分配策略,以维持生长发育的需求。
在对植物NUE的研究中,液泡NO3-起着不容忽视的作用[48]。NRT2.7和CLCa是两个能将NO3-转入液泡的转运蛋白。已经有研究证明NRT2.7在种子中具有重要的功能,在种子成熟晚期该基因高度表达,起到种子中液泡NO3-累积的作用[49]。而AtCLCa是第一个被发现的NO3-/2H+逆向转运蛋白,也是唯一被证实参与液泡NO3-累积的氯离子通道(CLC)蛋白,其突变体液泡中的NO3-累积量减少50%左右,并且NO3-含量从根到冠都降低,说明CLCa在液泡中累积NO3-起着非常重要的作用[50]。在玉米ZmCLCa基因功能的验证研究中,证明了ZmCLCa可以提高植物对氮素的吸收,有利于玉米在低氮环境下的吸收,但是对于ZmCLCa在积累硝酸盐过程中的机制还需要进一步的研究[51]。CLC家族的另一个成员CLCb也能转运NO3-,但尚不确定它是否参与NO3-进出液泡[52]。另外,AtCLCc负责NO3-和氯的动态平衡,可调节氯的运输,对气孔运动和耐盐性至关重要[53]。与NRT家族相比,CLC家族蛋白在调控液泡NO3-累积方面起着更为重要的作用,可以显著影响植株NO3-的利用。
3 植物氮素转运蛋白的表达调控
植物氮素的吸收和转运主要是由氮素转运蛋白介导的,为了保障氮素能够被植物有效的吸收和利用,需要精准调控氮素转运蛋白活性。国内外学者对植物氮素转运蛋白的表达调控已经做了大量的研究工作,植物氮素转运蛋白的调控可分为转录水平上的调控和蛋白水平上的调控。
研究发现,NRT基因的表达受到NO3-水平的调控。Okamoto等[54]用1 mmol/L NO3-溶液处理拟南芥,利用半定量PCR的方法研究NRT1.1-1.4和NRT2.1-2.7的表达状况,根据它们对NO3-供应的响应差异把它们划分为NO3-诱导、NO3-抑制和NO3-组成型基因,AtNRT1.1、AtNRT2.1和AtNRT2.2被NO3-强烈诱导,表达量升高,AtNRT2.4受NO3-诱导程度较小,它们均属于NO3-诱导型基因;AtNRT2.5被NO3-强烈抑制,表达量下降,属于NO3-抑制型基因;而AtNRT1.2、AtNRT1.4、AtNRT2.3、AtNRT2.6和AtNRT2.7不受NO3-影响,属于表达组成型基因。诱导型(抑制性)基因一般在接触NO3-很短的时间内表达增强(下降),数小时至10余小时后达到高峰(低谷),此后表达量开始降低(升高),说明该基因表达受到反馈调控,NO3-对NRT表达的调控具有时间动态变化特点[55]。另外,不同物种的NRT对NO3-的响应与拟南芥不完全一致,如在拟南芥中AtNRT1.1为NO3-诱导型基因,而在黄瓜中CsNRT1.1属于NO3-组成型基因[56]。除了NO3-,其他的氮素营养,如NH4+、谷氨酸和谷氨酰胺均会抑制NRT基因的表达。
NRT基因的表达还受激素等信号分子调控,研究发现,ACC处理油菜可以促进根系生长和根毛增多,但却降低BnNRT2.1表达[57]。在拟南芥中,对成熟根系施加IAA处理,会引起侧根的发育,在处理30 min后,全株NRT1.1 mRNA含量显著增加,而对NRT2.1的转录有明显抑制作用[58]。在低氮条件下,ABA还可以通过调控NRT2/NAR基因表达量来促进小麦NO3-的吸收[59]。Ruffel等[60]研究发现根区NO3-差异分布下,高N侧根系生长加快、NO3-吸收显著增强。进一步研究发现,高N侧根系能够合成反式玉米素(tZ);然后,反式玉米素作为 “根-冠”信号分子运输到地上部,诱导地上部叶片中谷氨酰胺合成;谷氨酰胺作为“冠-根”间信号分子运输到根系,调控根系中硝态氮吸收[61]。研究发现根区NO3-不均匀分布下“根-冠-根”“CEPCEPR-CEPD”信号通路在促进高氮侧根系硝态氮吸收过程中具有重要作用[62-63]。
昼夜节律也可影响NRT基因表达,白天时,植物维持对NO3-较高的吸收速率,进入夜间后NO3-的吸收速率逐渐降至最低,AtNRT1.1和AtNRT2.1基因的表达量也在白天达到最高,而在夜间降至最低[64]。进一步研究发现在夜晚的条件下供应蔗糖,AtNRT1.1和AtNRT2.1表达量上调,说明NRT基因受昼夜节律调节的关键因素是光合产物的量,Lejay等[65]的研究发现,6-磷酸-葡萄糖作为信号物质可调节AtNRT1.1和AtNRT2.1的表达。
磷酸化是NRT在蛋白水平上最主要的调控方式,而NRT1.1则是最早发现可以被磷酸化的NRT。最近的结构分析表明,NRT1.1在Thr101的磷酸化控制着NRT1.1的结构灵活性。当NO3-浓度高时,NRT1.1去磷酸化,转运蛋白采用结构柔性较低的二聚体构象,起到低亲和力转运蛋白的作用;当NO3-浓度下降时,NRT1.1在Thr101残基上磷酸化,从而使NRT1.1二聚体解耦连,磷酸化的转运蛋白获得了更高的结构灵活性和摄取活性,并作为一种高亲和的转运蛋白发挥作用[66-67]。而在NRT2.1,发现了Ser11、Ser28和Thr521三个磷酸化位点[68-69]。Ser28已被证明在重新补充高浓度(3 mmol/L或10 mmol/L)NO3-后5 min内迅速去磷酸化,但在低浓度(0.3 mmol/L)NO3-下仍保持磷酸化[68],这表明高氮条件下,NRT2.1翻译后修饰对调节根系NO3-吸收具有重要作用。
4 提高NUE的主要途径
提高氮肥利用率,减少氮肥损失及其对环境的压力,既是一个全球性课题,更是我国农业可持续发展面临的严峻挑战[70]。提高氮素利用率的基本原则是,提高植物对氮肥的吸收能力,尽量避免土壤中氮的过量积累、减少氮素损失;提高氮素向生殖器官转运,提高经济系数[71]。提高氮素利用率的技术途径有很多,归纳起来主要有农艺途径、工艺途径和生物途径[72]。
农艺途径主要是根据作物的生长发育特点和需肥规律优化田间管理,改进传统的施肥技术,改善土壤有效氮素含量,以达到提高氮素利用率的目的。具体措施包括合理控制氮肥用量、氮肥深施、氮肥后移、少量多次施肥、合理灌溉、水肥一体化、根区施肥、平衡施肥等[73]。根区定位施肥技术,可以大幅提高养分利用效率,减少面源污染[74];西北内陆棉区膜下滴灌条件下采用的水肥一体化和水肥协同技术能有效提高旱区棉花的氮肥利用率[75];根区盐分差异分布条件下向低盐根区施肥有利于盐胁迫条件下氮素的吸收利用[76]。
工艺途径则是通过改进传统的氮肥制造工艺,研制新型的高效氮肥,使其按照植物的需氮规律提供氮素营养,降低氮肥淋溶、挥发损失,提高氮肥利用效率。如控释肥就具有养分释放与植物吸收同步的特点,一次性基施可以满足全生育期的需要[77]。在滴灌施肥条件下,新型水溶氮肥则更利于实现水肥耦合,提高氮肥吸收利用,降低氮肥的淋溶 损失[78]。
生物途径是通过植物基因型在氮素吸收利用方面的差异,挖掘植物本身的遗传因素,筛选和培育氮高效品种,以提高氮素利用率[79],是提高氮利用效率的最理想方式,不仅经济有效,而且有利于减少污染和对生态环境的破坏。传统技术和手段培育氮素高效植物品种的效率很低、难度很大。但是,随着转基因技术,特别是基因编辑等分子生物学技术的发展和应用,培育氮高效型植物品种已成为可能,目前已经报道利用Cas9等基因组编辑技术,可以删除小麦中消耗氮素的过量储存蛋白基因,从而提高氮素利用效率[80],展现出广阔的利用前景。
5 展望
研究植物本身的氮素吸收和转运的机理机制是提高植物NUE的关键依据。随着分子生物学研究的不断深入,关于植物氮素吸收、转运和利用氮素的生理和分子机制的研究已经取得了重要的进展,如在一些植物中已克隆到多个氮素转运蛋白基因,并对其结构、功能和基因表达调控等方面进行了初步的研究,为有效调控氮素吸收和利用奠定了坚实的基础。但是,氮素转运基因家族成员众多,使得基因筛选和功能鉴定还需要大量的工作;加之氮素的吸收和转运以及调控是一个错综复杂的生物学过程,仅调控过程就涉及多种激素通路和信号分子通路的交互作用,因此还需要持续深入研究。
此外,迄今氮素相关基因的克隆和研究多集中在模式生物拟南芥上,对大宗作物氮素转运蛋白基因的鉴定、功能分析以及氮素吸收的分子生物学研究还不多;同时由于缺乏氮高效的作物种质资源,导致关于氮素高效作物品种应用于农业生产实践的报道极为罕见,这说明深入揭示氮素利用的分子机制及调控机制对提高氮素利用效率的迫切性和重要性。因此,今后应该加强作物氮素吸收利用相关基因的研究,利用转基因和基因编辑等现代生物技术技术手段与常规技术结合,培育出更多真正意义上的氮素高效利用新品种,在减少环境污染氮肥用量的同时确保不减产甚至增产。
在农艺栽培方面,目前采用的栽培管理方式较为单一,采取的栽培管理技术主要目的是围绕高产,以节肥为目标的研究尚不多见,存在的问题是采用的栽培管理方式较为单一。因此,要深入研究不同地区、不同时期、不同种植方式以及不同生境下作物氮素吸收转运基因表达情况和调控模式的变化,以此改良改进和创新现有的栽培管理措施,为作物提供更优的生长条件,为作物氮肥的高效利用提供技术支撑,实现节肥高产相协同。
相信随着分子生物学、遗传学、农学及交叉学科研究的深入,将进一步揭示植物氮素吸收、转运及调控的机制,并开发更多、更有效的大宗作物氮素高效利用技术,为其在农业和生物工程的应用奠定坚实的基础,为节肥增产、节本增效服务。

