不同品种和产区宁夏枸杞根系AMF多样性
吕燕 刘建利 李靖宇 候琳琳 孙敏 苟琪
(北方民族大学生物科学与工程学院,银川 750021)
宁夏枸杞(Lycium barbarum L.)为茄科,枸杞属,多年生落叶灌木,是典型药食同源性植物,是宁夏、甘肃、青海、内蒙古、新疆等少数民族地区脱贫的重要经济林品种,由于其极强耐旱、耐盐碱、耐贫瘠和抗沙荒等环境适应能力,也是西北地区干旱区生态恢复、盐碱地改良的首选土著植物[1]。枸杞之所以成为一种典型的生态和经济功能兼备的植物,其根际微生物在提高枸杞抗逆性方面具有重要的作用[2]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)属于真菌的Glomeromycotina亚门,是最普遍的植物共生微生物之一,借助其菌丝网络,AMF帮助植物吸收营养物质,提高对非生物胁迫和生物胁迫的抗性,从而影响植物的健康[3-4],提高植物的生产力[5]。AMF在宁夏枸杞适应盐胁迫、干旱胁迫中发挥重要作用。刘洪光[6]研究发现,接种Glomus versiforme能调节宁夏枸杞内源激素缓解盐胁迫抑制作用,促进枸杞根系的生长发育,保证枸杞对水分和养分的吸收;韦素贞[7]研究发现,接种Rhizophagus irregularis能增强干旱胁迫下宁夏枸杞抗氧化酶体系的活力、光合作用以及钾离子通道基因的表达,促进植物对钾离子的吸收;张海涵[8]研究发现接种AMF和DSE提高了宁夏枸杞耐旱能力。
AMF多样性受气候、植被和土壤理化性质等环境因子变化的影响[9]。宁夏枸杞中也已开展相关研究,肖龙敏等[10]采用巢氏PCR-DGGE研究发现,宁夏枸杞根际AMF定殖和多样性受种植年限的影响,且随着种植年限增加多样性存在下降趋势;刘洪光[6]发现土壤肥力影响AM真菌多样性指数,不同的宿主会影响AMF的群落结构。张海涵[8]采用巢氏PCR-DGGE研究不同品种和不同产区枸杞根际土壤AMF群落,发现季节和品种影响AMF 群落多样性。唐明等[11]、刘洪光[6]亦采用湿筛倾析法研究宁夏枸杞根系土壤中AMF的孢子和孢子果分布,发现不同的采样地点枸杞AMF α-多样性指数和群落组成存在差异。
AMF不仅以菌丝网和孢子广泛分布于植物根区土壤中,更重要的是侵入植物根系内形成丛枝或泡囊等共生结构[12]。根系AMF由于占据独特的生态位而具有特殊的功能,有研究表明,根系AMF群落与植物根区土壤AMF群落不同[13-14]。以上研究均以宁夏枸杞根区土壤中AMF为研究材料,而对根系AMF并未关注。
本研究以不同品种、不同产区宁夏枸杞根系为材料,采用AMF特异性引物扩增后,基于Illumina Miseq测序平台进行测序,研究宁夏枸杞根系AMF多样性及群落组成,探究品种与产区对AMF群落的影响以及AMF与果实有效成分相关性,为宁夏枸杞AMF菌剂开发奠定基础。
1 材料与方法
1.1 材料
4个宁夏枸杞品种的树龄均为3年,采集其根系和果实样品,每个品种3个生物学重复:“宁杞7号”品种(“N7”)3个重复(“JYAG”、“JYBG”、“JYCG”),“宁杞9号”品种(“N9”)3个重复(“JYGG”、“JYHG”、“JYTG”),“蒙杞1号”品种(“M1”)3个重复(“JYKG”、“JYLG”、“JYMG”),“蒙杞2号”品种(“M2”)3个重复(“JYPG”、“JYRG”、“JYSG”),均来自甘肃靖远县五合乡田窝村。
4个不同宁夏枸杞产区根系和果实样品,品种均为“宁杞7号”,树龄均为3年,每个产区3个生物学重复:宁夏中宁产区(“Zhongning”)3个样品(“ZNAG”、“ZNBG”、“ZNCG”),甘肃靖远产区(“Gansu”)3个样品(“JYAG”、“JYBG”、“JYCG”),宁夏海原产区(“Haiyuan”)3个样品(“GYAG”、“GYBG”、“GYCG”),内蒙古乌拉特产区(“inner mongolia”)3个样品(“NMAG”、“NMBG”、“NMCG”)。
1.2 方法
1.2.1 样品前处理 用自来水冲洗掉枸杞根上黏附泥土,再在无菌条件下用无菌水洗3次,用70%乙醇消毒4 min,无菌水冲洗3次,5%次氯酸钠消毒5 min,无菌水冲洗3次,0.1%氯化汞消毒3 min,无菌水冲洗3次,置于灭菌滤纸上晾干,-70℃冷冻保存。
1.2.2 DNA抽提、18S rDNA序列扩增及高通量测序 参照基因组DNA提取试剂盒说明(MoBio Power Fecal ® DNA Isolation Kit)提取样品总基因组DNA,Nanodrop2000检测DNA纯度和浓度;1%琼脂糖凝胶检测DNA完整性。采用2对特异性引物进行PCR扩增,第一轮扩增引物为AML1/AML2(5′-ATCAACTTTCGATGGTAGGATAGA-3′;5′-GAACCCAAACACTTTGGTTTCC-3′),PCR反应体系为5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、Forward Primer(5 μmol/L)0.8 μL、Reverse Primer(5 μmol/L)0.8 μL、FastPfu Polymerase 0.4 μL、BSA 0.2 μL、Template DNA 10 ng,补ddH2O至20 μL;扩增程序为95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 45 s,32个循环;72℃ 10 min;第二轮扩增引物为AMV4.5NF/AMDGR(5′-AAGCTCGTAGTTGAATTTCG-3′;5′-CCCAACTATCCCTATTAATCAT-3′)[15],扩增程序为95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 45 s,30个循环;72℃ 10 min。将PCR产物进行文库构建,Miseq测序:PE250平台由上海美吉生物医药科技有限公司完成。
1.2.3 生物信息学分析 Miseq测序得到的PE reads首先根据overlap关系进行拼接,对序列质量进行质控和过滤,导入上海美吉生物医药科技有限公司交互式微生物多样性云分析平台(http://www.i-sanger.com/),区分样本后进行OTU按97%相似度聚类,按最小样品序列数抽平样本序列,形成新OTU表,选择每个OTU的代表序列比对数据库Maarjam081/AM[16],将序列相似度≥97%,查询序列对齐长度≥95%,e值<1e-50视为虚拟分子种(virtual taxa,VTs)[17]。
物种组成、物种差异、样本比较等分析参数设置如下:合并低于1%的OTU;物种、样本层级聚类方式用average,分组的样本丰度计算用均值;多重检验校正fdr后检验Tukey;多组比较策略oneagainst-all。
1.2.4 枸杞鲜果中活性成分含量测定 甜菜碱含量测定采用雷氏盐比色法[18],总糖、总黄酮含量测定采用比色法[19]。
2 结果
2.1 α-多样性分析
从不同品种和不同产区样品中分别获得132 972和130 948条有效序列,平均长度为237.63 bp和237.48 bp,所有样品的coverage均达到1.00,测序深度能真实反应样品中AMF物种多样性(表1和表2)。衡量物种多样性Shannon指数在品种间由高到低依次为“宁杞7号”>“宁杞9号”>“蒙杞1号”>“蒙杞2号”,而产区间无显著性差异,Simpson指数反映出的显著性差异结果和Shannon指数一致。反映样品丰富度ACE指数中“宁杞7号”最高,而在“宁杞9号”、“蒙杞1号”与“蒙杞2号”之间无显著差异,产区间无显著性差异,Chao1指数反映出的多样性大小和ACE指数一致。反映样品均匀度Heip指数的与ACE指数显著性差异一致。因此,品种影响宁夏枸杞根系AMF群落α-多样性指数,“宁杞7号”最高,“蒙杞2号”最低,而产区无影响。
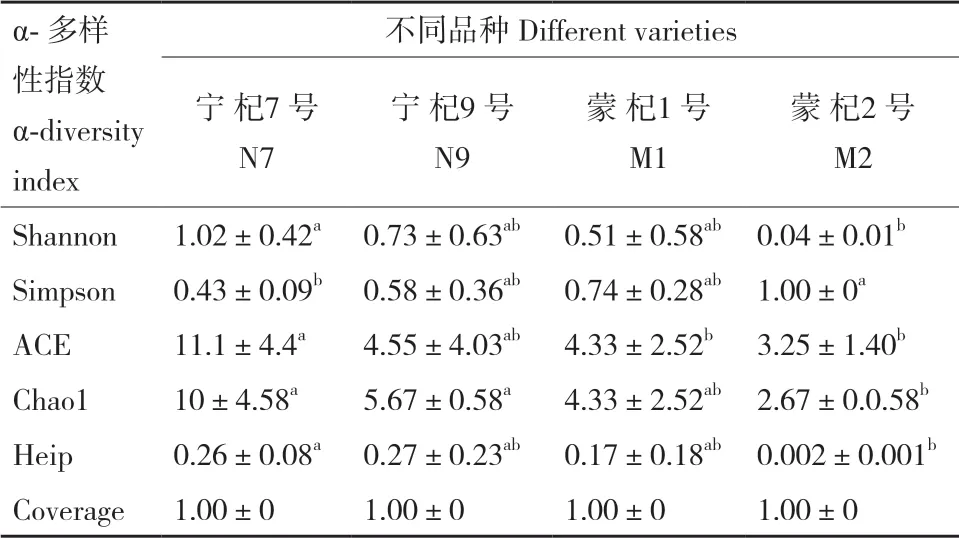
表1 不同品种样品中AMF α-多样性指数Table 1 α-diversity index of arbuscular mycorrhizal fungi in different varieties samples based on OTU
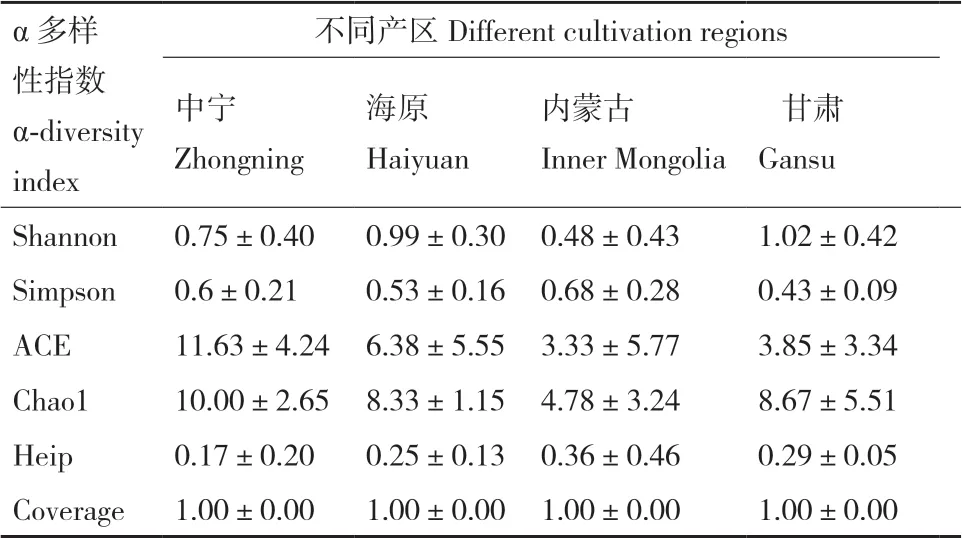
表2 不同产区样品中AMF α-多样性指数Table 2 AMF α-diversity index in samples from different cultivation regions
2.2 物种组成分析
所有宁夏枸杞根系样品中共获得49个AMF OTUs,属于真菌界球囊菌亚门球囊菌纲3个目(球囊霉目、类球囊霉目和球囊菌纲未鉴定目)3个科(球囊霉科、类球囊霉科和球囊菌纲未鉴定科)3个属23个种。
在属水平,4个宁夏枸杞品种和4个不同产区AMF丰度>1%的属有球囊霉属(Glomus)、根孢囊霉属(Rhizophagus)、近明球囊霉属(Claroideoglomus)和未知属(unclassified_c_Glomeromycetes)4种。“蒙杞1号”品种球囊霉属(Glomus)所占比例高达97.9%,“宁杞9号”和“蒙杞2号”品种所占比例为66.7%,“宁杞7号”品种为79.7%;“蒙杞1号”品种根孢囊霉属(Rhizophagus)所占比例为1.7%,“宁杞7号”和“蒙杞2号”品种所占比例为18.0%和33.3%;“宁杞9号”品种未知属(unclassified_c_Glomeromycetes)所占比例为32.5%(图1-A)。“海原”产区球囊霉属(Glomus)所占比例为96.3%,“甘肃”产区为81.2%;根孢囊霉属(Rhizophagus)仅在“甘肃”产区出现,占比为18.0%;“内蒙古”产区和“中宁”产区只出现球囊霉属(Glomus)和球囊菌纲未知属(unclassified_c_Glomeromycetes)2种,占比分别为66.7%、33.3%和66.6%、32.9%(图2-A)。球囊霉属(Glomus)是4个品种和4个产区的优势属,根孢囊霉属(Rhizophagus)为“宁杞7号”、“蒙杞1号”和“蒙杞2号”品种和“甘肃”产区的次优势属;所有属在所有品种(图1-B)和所有产区(图2-B)样品中无显著性差异。

图1 属水平不同宁夏枸杞品种样品中AMF相对分布图Fig.1 Relative abundance of AMF genus among different varieties
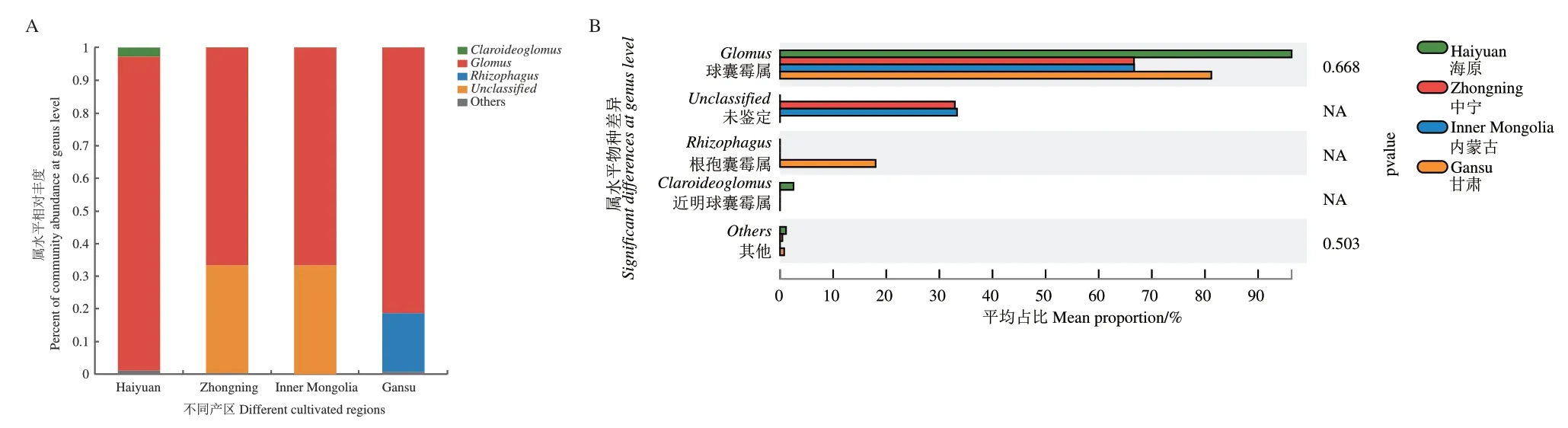
图2 属水平不同宁夏枸杞产区样品中AMF相对分布图Fig.2 Relative abundance of AMF at genus level among cultivated regions
在种水平,4个品种宁夏枸杞根系AMF丰度>1%的有9个VTs和3个未鉴定的球囊霉菌(表3),4个产区根系AMF丰度>1%的有12个VTs和2个未鉴定的球囊霉菌(表4)。所有样品共有种为Glomus.sp.VTX00113,Glomus.sp.VTX00113为“宁杞7号”、“蒙杞1号”品种的优势种;“宁杞9号”品种的优势种为Glomus.sp.VTX00156,为“宁杞7号”品种的次优势种,“蒙杞2号”品种AMF种最少,优势种为Rhizophagus intraradices VTX00100、Glomus.sp.VTX00113和Glomus.sp.VTX00393。“海原”产区和“甘肃”产区的优势种为Glomus.sp.VTX00113,次优势种为Glomus.sp.VTX00156;“内蒙古”产区和“中宁”产区的优势种分别为未鉴定出的球囊霉菌unclassified_OTU32和unclassified_OTU39,次优势种分别为Glomus.sp.VTX00301和Glomus.sp.VTX00155。所有AMF种在4个宁夏枸杞品种根样品中无显著差异(图3-A),Glomus.sp.VTX00113在4个宁夏枸杞产区根样品中有显著性差异(P<0.001))(图3-B)。

图3 种水平不同宁夏枸杞品种和产区样品中AMF组间显著差异图Fig.3 Significant differences of AMF among different varieties and cultivated regions at species level

表3 种水平不同宁夏枸杞品种样品中AMF相对分布表Table 3 Relative abundance of AMF among different varieties at species level
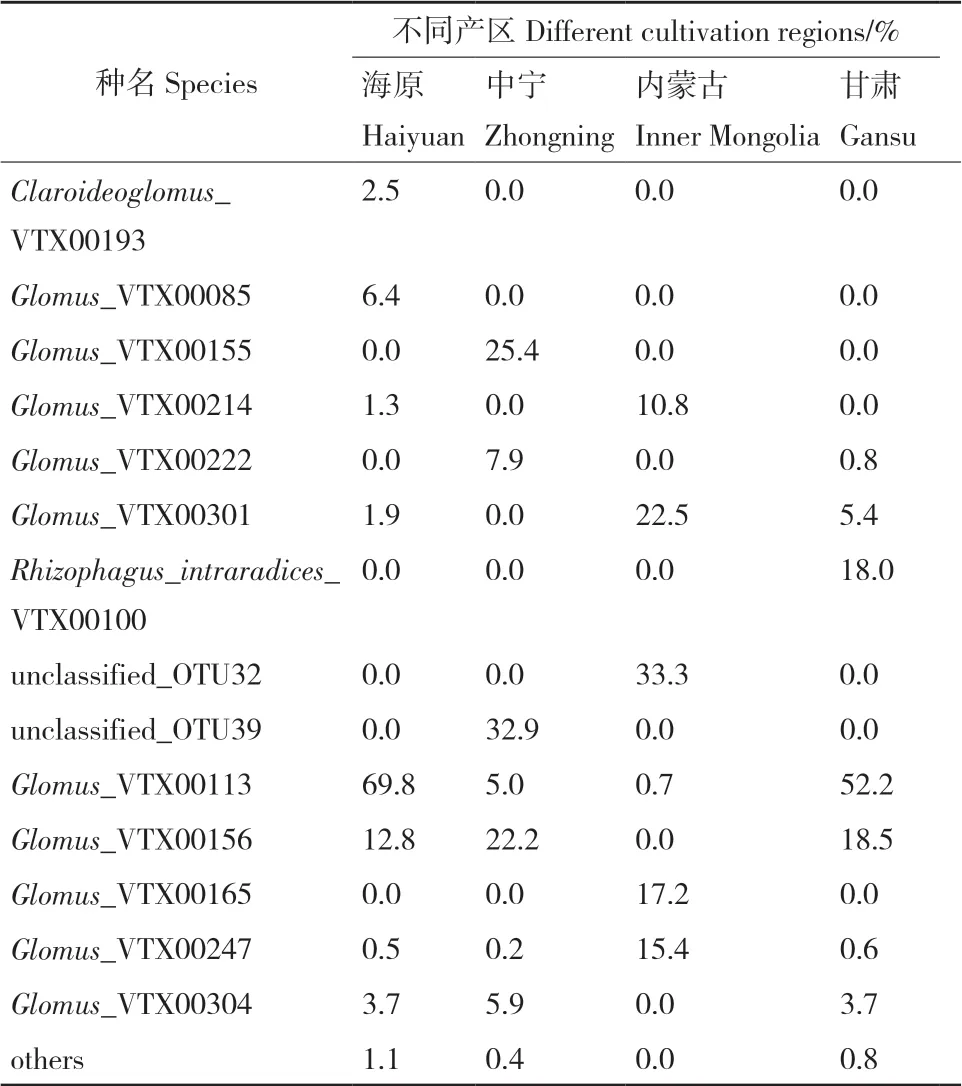
表4 种水平不同宁夏枸杞产区样品中AMF相对分布表Table 4 Relative abundance of AMF among different cultivation regions at species level
不同品种样品所得的OTUs数目分别为“宁杞7号”16个、“宁杞9号”12个、“蒙杞1号”9个和“蒙杞2号”5个,OTUs数目大小依次为“宁杞7号”>“宁杞9号”>“蒙杞1号”>“蒙杞2号”,“宁杞7号”品种OTUs数目最多(图4-A);不同产区样品所得的OTUs数目分别为“中宁”产区22个、“海原”产区13个、“内蒙古”产区10个和“甘肃”产区14个,OTUs数目大小依次为“中宁”产区>“甘肃”产区>“海原”产区>“内蒙古”产区,4个产区共有OTUs有3个(图4-B)。共现性网络图显示OTU20为4个品种和4个产区的重要节点(图5-A),4个产区相互关联的OTUs数目更多(图5-B),表明不同品种间AMF OTUs组成存在差异,“宁杞7号”和“宁杞9号”品种OTUs组成更相似,不同产区AMF在OTU水平组成更相似。

图4 宁夏枸杞根系AMF OTU分布Venn图Fig.4 Venn of AMF in L. barbarum roots at OTU level

图5 宁夏枸杞根系AMF OTU和样品共现性网络图Fig.5 Co-occurrence patterns of AMF in L. barbarum roots at OTU level
2.3 β-多样性分析
基于OTU水平和Bray_Curtis距离的非度量多维尺度分析(non-metric multi-dimensional scaling,NMDS)统计结果显示,不同宁夏枸杞品种根系AMF群落组成差异不大(图6-A);“海原”产区和“中宁”产区的宁夏枸杞根系AMF群落组成相似,而“内蒙”产区和“中宁”产区存在差异(图6-B)。PERMANOVA分析显示,不同品种AMF群落组成(Bray_Curtis距离)无显著差异(P=0.123),不同产区AMF群落组成差异显著(P=0.001)。

图6 基于Bray_Curtis距离AMF群落的NMDS排序图Fig.6 NMDS ordination based on Bray_Curtis similarities of AMF community
2.4 果实有效成分含量与AMF类群关联分析
在种水平,通过对宁夏枸杞根系丰度前30AMF与样品果实中多糖(“PS”)、总黄酮(“fl”)、甜菜碱(“bet”)做相关性分析,所有样品中AMF种与多糖含量无相关性。在不同品种样品中,Glomus.sp.VTX00113与甜菜碱含量呈显著正相关,unclassified_OTU14与甜菜碱含量呈显著负相关,Glomus.sp.VTX00393与总黄酮含量呈显著正相关,其余AMF种与总黄酮含量无相关性(图7-A);在不同产区样品中,Glomus.sp.VTX00113与甜菜碱含量呈显著正相关,Glomus.sp.VTX00247与总黄酮含量呈显著正相关,其余AMF种与甜菜碱和总黄酮含量无相关性(图7-B)。因此,宁夏枸杞果实多糖含量与AMF无相关性,Glomus.sp.VTX00113与甜菜碱含量显著正相关,unclassified_OTU14仅在不同品种样品中与甜菜碱含量显著负相关,Glomus.sp.VTX00393仅在不同品种样品中与总黄酮含量显著正相关,Glomus.sp.VTX00247仅在不同产区样品中与总黄酮含量显著正相关。

图7 基于种水平宁夏枸杞根系AMF与枸杞有效成分相关性heatmap图Fig.7 Correlation heatmap of AMF and main active ingredients in L. barbarum roots at species level
3 讨论
AMF作为植物共生菌,既定殖于宿主植物根系内,又存在于环境土壤中[12],研究AMF多样性可选择的研究材料主要有根系、孢子和土壤[20]。唐明等[11]用湿筛倾析法在宁夏盐池和海原地区的枸杞(Lycium chinense)根系土壤中AMF的孢子和孢子果发现绕孢球囊霉(Glomus ambisporum)和单孢球囊霉(Glomus monosporum);盛敏[21]采用湿筛倾析法鉴定西北盐碱土生境中枸杞(Lycium chinense)根际土壤AMF孢子,发现6种AMF,包括薄壁原囊霉(Archaespora leptotichum)、地表多孢囊霉(Diversispora versiforme)、缩球囊霉(Glomus constrictum)、副冠球囊霉(Glomus coronatum)、根内球囊霉(Glomus intraradices)和摩西球囊霉(Glomus mosseae),其中地表多孢囊霉(Diversispora versiforme)是优势种,球囊霉属(Glomus)AMF占主要地位。本研究通过高通量测序研究不同品种和不同产区宁夏枸杞根系AMF,结果表明“宁杞7号”、“蒙杞1号”和“蒙杞2号”品种AMF的优势种均为Glomus.sp.VTX00113,“宁杞9号”品种AMF优势种为Glomus.sp.VTX00156;“海原”产区和“甘肃”产区根系AMF优势种为Glomus.sp.VTX00103,“内蒙古”产区和“中宁”产区的优势种均为无法鉴定的球囊霉菌,可能是Marrjam数据库中缺乏一些SSU序列导致。
利用分子生物学技术对宁夏枸杞AMF群落结构进行研究都集中在根际土壤,肖龙敏[22]采用巢氏PCR-DGGE对宁夏枸杞根际土壤研究发现,不同树龄“宁杞1号”品种枸杞大部分序列与球囊霉属(Glomus)序列相似,不同样地(宁夏中宁六队、长滩、上桥、硝池塘、七队和宁夏农林科学院枸杞研究所)“宁杞1号”品种枸杞优势AMF为球囊霉属(Glomus)和管柄囊霉属(Funneliformis),不同样地(宁夏中宁六队、长滩、上桥)“宁杞7号”品种枸杞优势 AMF为球囊霉属(Glomus);张海涵[8]采用巢氏PCR-DGGE对宁夏农林科学院园林场不同枸杞品种(“宁杞1号”、“宁杞5号”和“柠杞菜1号”)根际土壤研究发现克隆测序的所有序列均属于球囊霉属(Glomus);纳小凡等[23]利用Illumina MiSeq测序对种植5年、10年和15年宁夏枸杞根际土壤微生物ITS基因的部分区域进行测序,发现AMF球囊霉属比例均未发生显著变化。本研究在4个不同品种和4个不同产区宁夏枸杞根系中分别发现24和35个AMF OTUs,结果表明宁夏枸杞根系中AMF含量较低,且优势属均为球囊霉属(Glomus),与根际土壤中研究结果一致。
选育宁夏枸杞品种时大多采用自然选优、杂交育种和倍性育种等方法[24],通过扦插繁育技术来扩大品种。本研究选取的4个宁夏枸杞品种均是从“宁杞1号”的突变株选育而来,内蒙古选育的“蒙杞1号”和“蒙杞2号”育成时间最晚。本研究发现内蒙古选育的 “蒙杞2号”品种AMF多样性和丰富度最低,“宁杞7号”品种最高。Holland等[25]研究葡萄AMF群落时发现在葡萄品种之间AMF物种丰富度和群落结构没有差异,本研究结果表明不同品种宁夏枸杞根系AMF群落结构不存在显著差异,可能与物种有关,有待于后续实验采用更多宁夏枸杞品种深入研究来确证。
我国北方农田土壤中以球囊霉属(Glomus)的频度最高,农田土壤中AMF优势种类明显,土壤理化性质对其影响不大[26]。生境特征和地理距离的变化可能导致AMF的地理分布格局不同[27]。AMF的分布不仅与植物种类、基因型有关,还与温度、日照时间、水分、CO2浓度、O2分压、氮沉降等气候因子、土壤理化因子和耕作栽培措施等人类活动有关[28-29]。李越鲲等[30]采用MiSeq 高通量测序ITS区研究我国枸杞产区(宁夏中宁、宁夏兴仁、新疆精河、青海格尔木)根际土壤真菌群落结构发现不同地区枸杞根际土壤真菌种群结构有一定差异。本研究发现“海原”和“靖远”产区的根系AMF群落结构最相似,且优势AMF种相同;不同产区的宁夏枸杞根系AMF群落结构组成存在差异,这可能是由于不同产区不同的气候、耕作方式以及形成不同的土壤理化等导致。
AMF会影响宿主植物次生代谢产物的积累。Al-Garni[31]研究表明,在盐胁迫下AMF侵染会促进芦苇中甜菜碱的积累,Amiri等[32]研究表明接种AMF会促进香叶天竺葵叶片中总黄酮和酚类物质的含量,改善植株的化学生理特性。贺学礼等[33]研究发现接种Glomus mosseae后民勤绢蒿在应对水分胁迫中叶片总黄酮含量显著升高,植物抗旱性增强。吕桂云[34]和贺超兴等[35]研究发现,接种Glomus mosseae和Glomus versiforme能够提高黄瓜和甜瓜果实中维生素C、可溶性糖和氨基酸的含量并增加果实产量。王锐竹等[36]研究发现,接种Rhizophagus irregularis不仅会提高番茄果实中可溶性固形物和番茄红素的含量,还可改善植物根区环境,提高土壤有机质含量。曹冠华等[37]研究发现,滇黄精根状茎中多糖和总黄酮含量等主要功效成分与AMF、DSE定殖率呈正相关。AMF能影响宿主植物次生代谢产物积累的机理也开展部分研究。Mirjani等[38]和刘灵[39]研究发现,AMF通过提高类黄酮生物合成途径(PAL)和酚酸生物合成途径相关酶(C4H和4CL2)的基因表达,增加类黄酮和酚酸类物质的生物合成,提高抗氧化活性。王林闯等[40]研究发现,甜椒接种Glomus mossea后叶绿素含量和光合速率提高,植株的光合产物相应增多。也有研究显示AMF与植物建立共生关系后能够扩大植物根系吸收面积[41],提高AMF和DSE定殖率[42],使植物表现出更强的抗胁迫能力和更好的生长发育状况[43]。本研究发现Glomus.sp.VTX00393在不同品种中与总黄酮含量显著正相关,Glomus.sp.VTX00247在不同产区中与总黄酮含量显著正相关,Glomus.sp.VTX00113在所有产区和品种中显示与甜菜碱含量显著正相关,但AMF与宁夏枸杞果实多糖含量无显著相关性。后续试验需将通过高通量分子测序获得的虚拟种和形态种对应,通过AMF孢子分离、人工扩繁、回接进一步验证AMF与宁夏枸杞果实甜菜碱与总黄酮间的关系。
4 结论
品种影响宁夏枸杞根系AMF群落α-多样性、优势种,但不影响β-多样性,产区影响β-多样性、优势种,不影响α-多样性指数;AMF与枸杞果实甜菜碱、总黄酮含量相关,与多糖含量无相关性。

