枣果实维管组织中荧光示踪剂引入方法的应用
章英才 黄月 海源 张媛 扈亚杰 赵梦怡
(宁夏大学生命科学学院,银川 750021)
枣(Ziziphus jujuba Mill)为鼠李科(Rhamnaceae)、枣属(Ziziphus Mill)落叶乔木,其果实的药用和营养价值都很高,是典型的具有药食兼用的果品之一[1]。近年来,在枣属植物果实解剖结构特性[2]、枣果实维管束解剖结构[3]等方面取得了一定的研究结果,反应了不同枣属植物的果实结构存在着异同[4-8]。光合同化物进入果实贮藏积累和运输经历了较复杂的过程,其中同化物韧皮部卸载过程是决定从“源”到“库”果实转运的重要步骤,对果实产量和品质起决定作用[9-10]。植物库器官韧皮部卸载途径主要有共质体途径和质外体途径两种[11-12],近年来果实生殖贮藏库韧皮部同化物的卸载研究取得了显著的进展,揭示了许多果实同化物卸载的途径及其卸载机制[13]。研究表明,冬枣、梨枣和酸枣果实发育早期或前期同化物从筛分子的卸出主要采取质外体途径,果实发育中期转变为共质体途径,果实发育后期重新转变为质外体卸载途径[14-15]。因此,光合同化物在果实库中的卸载,随着不同类型的果实、果实的不同发育时期、以及果实库器官的不同组织部位而存在着差异。
韧皮部同化物卸载的研究方法主要有生理方法,如“空种皮杯法”、“卸载穴法”、“浆果杯法”、“组织圆片法”等;植物解剖学研究方法,如透射电子显微镜胞间连丝的超微结构观察[15]、胶体金免疫电子显微镜观察;荧光染料活细胞示踪技术,如荧光探针引入示踪结合激光共聚焦扫描显微镜观察[16-17];其他研究韧皮部卸载细胞学路径的方法,如显微注射法、绿色荧光蛋白示踪技术、同位素示踪放射自显影技术等。其中,荧光染料活细胞示踪技术研究植物体内物质运输具有悠久的历史,尤其是羧基荧光素酯的应用极大的简化了韧皮部卸载和韧皮部后运输的检测,并且,结合激光扫描共聚焦显微技术,促进了同化物的韧皮部卸载及其在细胞间运输的研究[16-17]。维管束是枣果实有机物和水分运输的重要通道,而韧皮部为同化物卸载和运输的主要场所,在枣果实生长发育和品质形成中具有非常重要的作用。荧光染料活细胞示踪技术利用荧光染料的特点,使其与果实维管组织中的化合物结合而标记,从而对卸载路径的过程进行示踪。由于枣果实维管束深埋于组织中,对维管束在果实中的分布、果实维管束的结构进行研究,是保障荧光染料活细胞示踪技术研究结果准确的基础。
灵武长枣(Ziziphus jujuba Mill cv. Lingwuchangzao)原产于宁夏灵武市,是枣中一个较优良的、经过多年自然筛选、具有宁夏地方特色的药食同源鲜果品种,具有较高的食用及药用价值[18]。果实中同化物的积累受卸载路径的影响,因此,研究果实韧皮部同化物卸载和运输的途径,对提高同化物向果实中运输、阐明同化物积累机制非常重要[19]。目前,对灵武长枣的研究多数集中于其鲜果保鲜、生物学特性以及品种培育方面,而对于枣果实的显微结构特征及其维管束的分布和结构研究较少,果实的显微结构与其他枣属植物果实的异同也未有系统研究,灵武长枣果实同化物卸载途径与冬枣、梨枣和酸枣等枣品种是否存在差异并不清楚。本研究以不同发育时期灵武长枣果实为实验材料,在前期研究的基础上[20-21],采用石蜡切片技术明确不同发育时期果实维管束分布、结构特征和变化规律,在此基础上,通过枣果实维管组织中荧光示踪剂引入方法的应用,采用荧光染料活细胞示踪技术,探讨枣果实维管束韧皮部同化物卸载路径的研究方法,为枣属及其他同类果实同化物韧皮部卸载研究提供参考。
1 材料与方法
1.1 材料
以位于宁夏灵武市的宁夏红枣工程技术研究中心试验基地6年生“灵武长枣”为供试材料,采用随机设计,3次重复,每次重复选择生长发育良好、树势适中、长势和花期相似、栽培管理水平一致的5-10株植株。用毛线于6月10日标记同一天开放的花朵,每个重复标记3 000朵。
在“灵武长枣”开花坐果到果实成熟的发育过程中共设计4次实验,具体分别在果实膨大前期(7月10日)、快速膨大期(8月9日)、着色期(9月8日)、完熟期(9月28日)左右,每次实验时间均设定于上午9:00-11:00进行,按所标记植株从树冠的东、西、南、北4个方位以及上、中、下、里、外各个方向选择标记花朵的枣吊作为试验对象进行石蜡切片试验和荧光示踪剂引入试验,其中荧光示踪剂引入试验后将枣吊采摘用冰壶带回实验室,以试验部位的枣果实作为试验材料。
1.2 方法
1.2.1 枣果实石蜡切片制作及观察 不同发育时期果实经蒸馏水冲洗数次后,用刀片分割成合适的小块,迅速投入FAA(70%乙醇∶冰醋酸∶甲醛=90∶5∶5)固定液中,抽气至样品沉底;固定24 h后将样品从FAA固定液中取出,依次经过不同浓度梯度的酒精脱水、透明、浸蜡、包埋,包埋块采用石蜡切片法切片,切片厚度8-12 μm;切片经二甲苯脱蜡、复水、番红染色(50%酒精溶液配置)、脱水、固绿染色(95%酒精溶液配置)、脱水、透明、加拿大树胶封片[20-21],经过LEICA显微镜下观察并 拍照。
1.2.2 枣荧光染料活细胞示踪技术
1.2.2.1 羧基荧光素酯(CFDA)的引入标记
(1)羧基荧光素酯(CFDA)母液的配制:用丙酮溶解荧光染料5(6)羧基荧光素酯(5(6)-carboxyfluorescein diacetate,CFDA)(Sigma-Aldrich公司产品),使得羧基荧光素酯CFDA母液的浓度为25 mg/mL。避光贮存在-20℃。
(2)CFDA母液的稀释:用含有5 mmol/L Mes-Tris和300 mmol/L山梨醇、pH为5.5的溶液稀释荧光素母液,使荧光素的浓度为1 mg/mL,得到荧光素稀释液,备用。
(3)CFDA的引入方法:由于灵武长枣果柄较短、质脆、易断裂造成果实脱落,因此选取靠近果柄的短枝作为引入荧光素酯的操作点。具体引入方法如下:方法1:选择标记花朵的枣吊,将靠近果柄的短枝冲洗干净后擦干,将1.5 mL尖底微量Eppendorf离心管底部用末端缠绕脱脂棉(占据管体积的2/3)的细棉线穿过后,将棉线的另一端用一细针(或缝纫针)从上向下穿过短枝韧皮部,不要划伤或穿透木质部(图1-A);用细铁丝将Eppendorf管固定并保持竖直(图1-B);将棉线缠绕于短枝四周对该棉线进行固定,迅速在针穿进和穿出的部位滴加适量2.5 mmol/L EDTA(也可用移液枪滴入伤口处),防止胼胝质形成而阻碍运输,在针穿出部位涂抹凡士林防止CFDA溶液流失,用微量注射器向Eppendorf管中注入200 μL CFDA稀释液(图1-C);迅速盖好离心管盖子(扎有通气小孔),并用锡箔纸包好,防止CFDA见光分解,用剪刀剪掉短枝前端的枝条和叶片(图1-D)。CFDA溶液在大气压力下慢慢渗入棉线进而进入韧皮部。CFDA处理48 h后采摘枣吊,用冰壶带回实验室。

图1 CFDA的引入方法1图示Fig.1 Photos showing the introduction method 1 of CFDA
方法2:选择标记花朵的枣吊,用砂布将靠近果柄的短枝表皮轻轻磨擦后,用水冲洗掉表皮毛,不伤及木质部,迅速将棉花团缠绕在靠近果柄的短枝上(图2-A);用封口膜将棉花团封好以免CFDA溶液挥发,采用微量注射器将配制好的1 mg/mL CFDA溶液200 μL缓慢注入棉花(图2-B);立即用封口膜(可再涂抹凡士林)密封针孔防止溶液外渗(图2-C);然后用锡箔纸将靠近果柄的短枝部位覆盖好,防止CFDA见光分解,用剪刀剪掉短枝前端的枝条和叶片(图2-D)。CFDA在植物体内转运48 h后采摘枣吊,用冰壶带回实验室。

图2 CFDA的引入方法2图示Fig.2 Photos showing the introduction method 2 of CFDA
1.2.2.2 洋地黄皂苷的引入处理 洋地黄皂苷对细胞质膜有通透作用,用洋地黄皂苷处理作为对照(处理)。选择部分标记花朵的枣吊,在引入CFDA的同时,将200 μL左右浓度为80 μg/mL(由二甲基亚砜母液稀释所得)的洋地黄皂苷,采用前述引入CFDA的方法[见1.2.2.1(3)方法1和方法2]引入果实(图3-A-F)。CFDA和洋地黄皂苷引入时,可以任意采用引入CFDA的方法1或方法2,可以相同也可以不同;如图3所示,CFDA的引入采用方法1,洋地黄皂苷的引入采用方法2(图3),CFDA和洋地黄皂苷引入方法不同。处理48 h后采摘枣吊,用冰壶带回实验室。

图3 CFDA和洋地黄皂苷同时引入的方法图示Fig.3 Photos showing the simultaneous introduction methods of CFDA and digitonin
1.2.2.3 Texas-Red的引入标记 德克萨斯红Texas-Red(磺酰罗丹明101磺酰氯)是一种红色的活细胞荧光染料,可以将Texas-Red引入果实来标记木质部,从而达到区分木质部与韧皮部的目的。将部分CFDA标记枣果实果柄浸泡于1 mg/mL Texas-Red溶液中(或将果柄的韧皮部完全去掉,只留下木质部),避光标记30-40 min,Texas-Red溶液在蒸腾拉力的作用下被吸进木质部(图4)。标记结束立即进行组织切片置于激光共聚焦显微镜CLSM下进行观察。

图4 Texas-Red标记的方法图示Fig.4 Photos showing the introduction method of Texas-Red
1.2.2.4 组织切片 将试验植株的3次重复处理的枣吊上采摘的果实3-5个,果实洗净、擦干,选取带有维管束的果肉组织分别进行徒手纵切或横切,用体积百分含量为80%的甘油封片(可防止荧光的快速泯灭,同时价格低廉节省材料),低温避光保存,尽快用激光共聚焦扫描显微镜CLSM观察CFDA和Texas-Red在果实维管束内的转运情况,观察荧光并拍照。
1.2.2.5 激光共聚焦显微镜观察 用激光共聚焦显微镜(CLSM)分别观察只引入CFDA、同时引入CFDA和洋地黄皂苷、同时引入CFDA和Texas-Red后,CFDA在枣果实维管束内的转运和Texas-Red的标记情况。CFDA产生的荧光采用488 nm激光激发,Texas-Red采用543 nm激光激发,利用CLSM观察荧光染料的标记情况并拍照。
2 结果
2.1 枣果实维管束特征分析
膨大前期果实的维管束数量较多,尤其是内果皮附近的维管束数量多、分布集中(图5-A-C)。维管束发育趋向成熟,此时有单个维管束进行发育,也有两个维管束背靠背进行发育,木质部、形成层、韧皮部可以初步分辨(图5-B-D)。形成层由多层的扁平细胞构成,将木质部与韧皮部分隔开,韧皮部由小的排列紧密的韧皮薄壁细胞、筛管、伴胞组成,排列较为紧密(图5-B-D)。

图5 膨大前期果实维管束特征Fig.5 Vascular bundles characteristic of fruit during the early bulking period
快速膨大期果实薄壁组织内分布着基本成熟的维管束,由于果实的快速膨大,致使相同视野内维管束的分布减少,此时期的维管束多为两两背靠背式、3个或4个围成圆式发育,维管束木质部、形成层、韧皮部清晰可辨,各维管束木质部彼此紧靠,木质部的导管细胞壁木质化明显(图6-A-B)。韧皮部的筛管与筛胞清晰可辨,由木质部向外延伸的形成层和韧皮部的中心基本在一条直线上,三者排列似扇形,形成层与韧皮部的面积宽广(图6-C-D)。
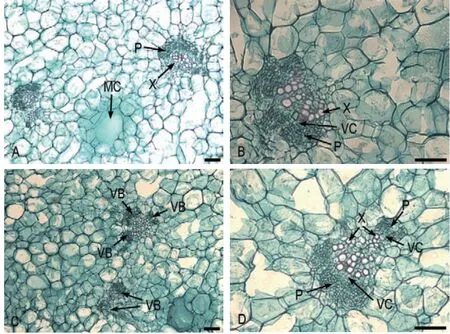
图6 快速膨大期果实维管束特征Fig.6 Vascular bundles characteristic of fruit during the rapid enlargement period
着色期果实发育结构特征基本与快速膨大期相似,此时中果皮的细胞空腔进一步增大,数量增多,围成空腔的薄壁细胞拉长,体积增大明显(图7-AB)。相同视野内的维管束数量更少,维管束主要有四至八个围成并产生多个分支结构,木质部、形成层、韧皮部的排列与快速膨大期基本相同,结构进一步发育成熟,韧皮部筛管与伴胞分化明显、清晰可辨(图7)。

图7 着色期果实维管束特征Fig.7 Vascular bundles characteristic of fruit during the coloring period
完熟期果实薄壁细胞形成的空腔继续增大,空腔的分布扩散至整个中果皮(图8-A-B)。与着色期相比,维管束数量亦无明显变化,但普遍出现相邻维管束链接成线,且在维管束横切中出现纵切现象,可能是由于维管束在后期发育时会出现维管束分叉现象,生长时间越长分叉现象越明显(图8-B-D)。
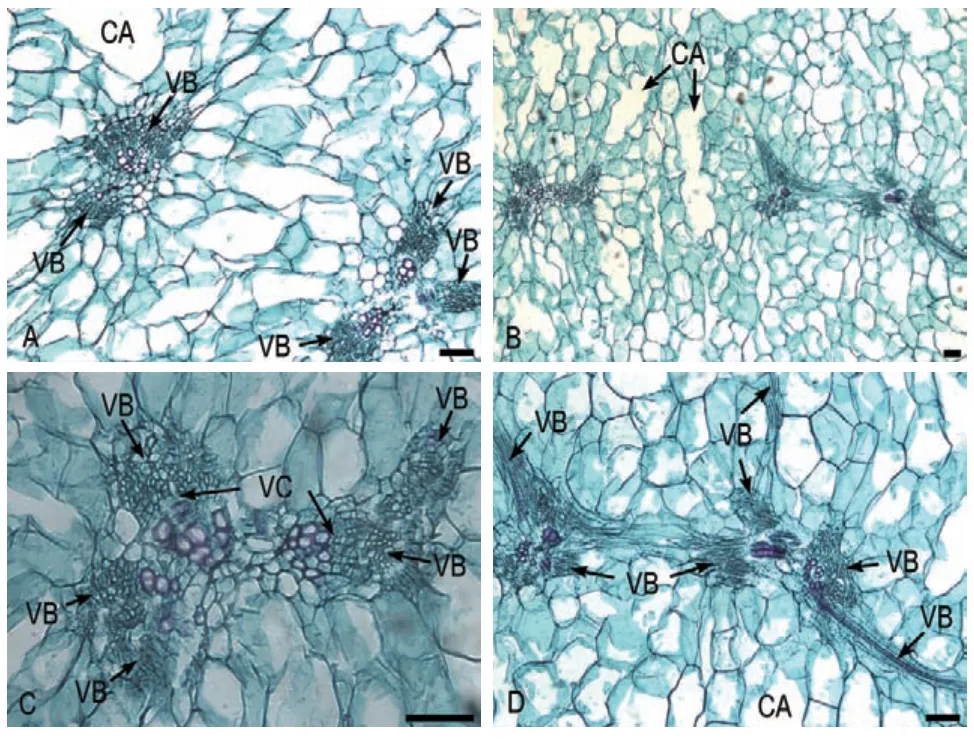
图8 完熟期果实维管束特征Fig.8 Vascular bundles characteristic of fruit during the maturation period
2.2 枣果实维管束荧光示踪剂引入结果
5(6)羧基荧光素酯(CFDA)引入韧皮部后,由细胞内源酯酶分解为有荧光信号的5(6)羧基荧光素(CF),转变为膜不通透的荧光指示剂,可在韧皮部长距离运输。CFDA引入膨大前期果实48 h后采摘果实横切,CLSM观察到不仅果实的韧皮部中具有明显的CF绿色荧光,同时在周围薄壁细胞中也分布着CF绿色荧光(图9-A1-A3),说明在膨大前期韧皮部和周围薄壁细胞之间存在着共质体联系,果实韧皮部同化物为共质体卸载途径;并且,韧皮部CF绿色荧光的分布也反映了维管束数量较多且分布集中,既有维管束单个发育,也有两个维管束背靠背发育,其CF绿色荧光分布在外围,而木质部位于中央,荧光示踪剂分布特征与膨大前期果实维管束特征一致(图5)。快速膨大期果实CF绿色荧光主要局限于果实的韧皮部中,但韧皮部周围薄壁细胞中也分布着少量的CF绿色荧光(图9-B1),当同时引入CFDA和洋地黄皂苷48 h后,周围薄壁细胞中CF绿色荧光明显增加(图9-B2),说明快速膨大期果实主要以质外体途径运输同化物,但也通过共质体卸出同化物;并且,韧皮部CF绿色荧光的分布反映了维管束数量的减少(图9-B1-B2),由于维管束多为两两背靠背式、3个或4个围成圆式发育,各维管束木质部彼此紧靠,排列似扇形(图6-C-D),因而,维管束纵切CF绿色荧光分布在外围,而木质部分布于中央(图9-B1-B2)。CFDA引入着色期果实48 h后绿色荧光局限于果实的韧皮部中,在韧皮部周围薄壁细胞中基本没有CF绿色荧光(图9-C1),当同时引入CFDA和洋地黄皂苷48 h后,周围薄壁细胞中分布着大量的CF绿色荧光(图9-C2),说明着色期果实通过质外体途径运输同化物;并且,韧皮部CF绿色荧光的分布一定程度反映了维管束数量的减少(图9-C1-C2),以及多个维管束形成的多分支结构(图7-A-D)。完熟期韧皮部CF绿色荧光的分布说明了维管束数量的减少,维管束纵切CF绿色荧光分布在外围,而木质部分布于中央反映了维管束产生的分支结构(图9-D1-D2);并且,Texas-Red红色的活细胞荧光染料引入部分已经被CFDA标记48 h后的完熟期枣果实,CFDA标记且局限于维管束韧皮部(图9-D1),红色荧光示踪剂Texas-Red标记木质部(图9-D2),维管束木质部与韧皮部清晰分明,实验结果准确可靠。不同发育时期枣果实维管束荧光示踪剂引入结果,反映了荧光示踪剂的分布特征与维管束分布特征的相关性。
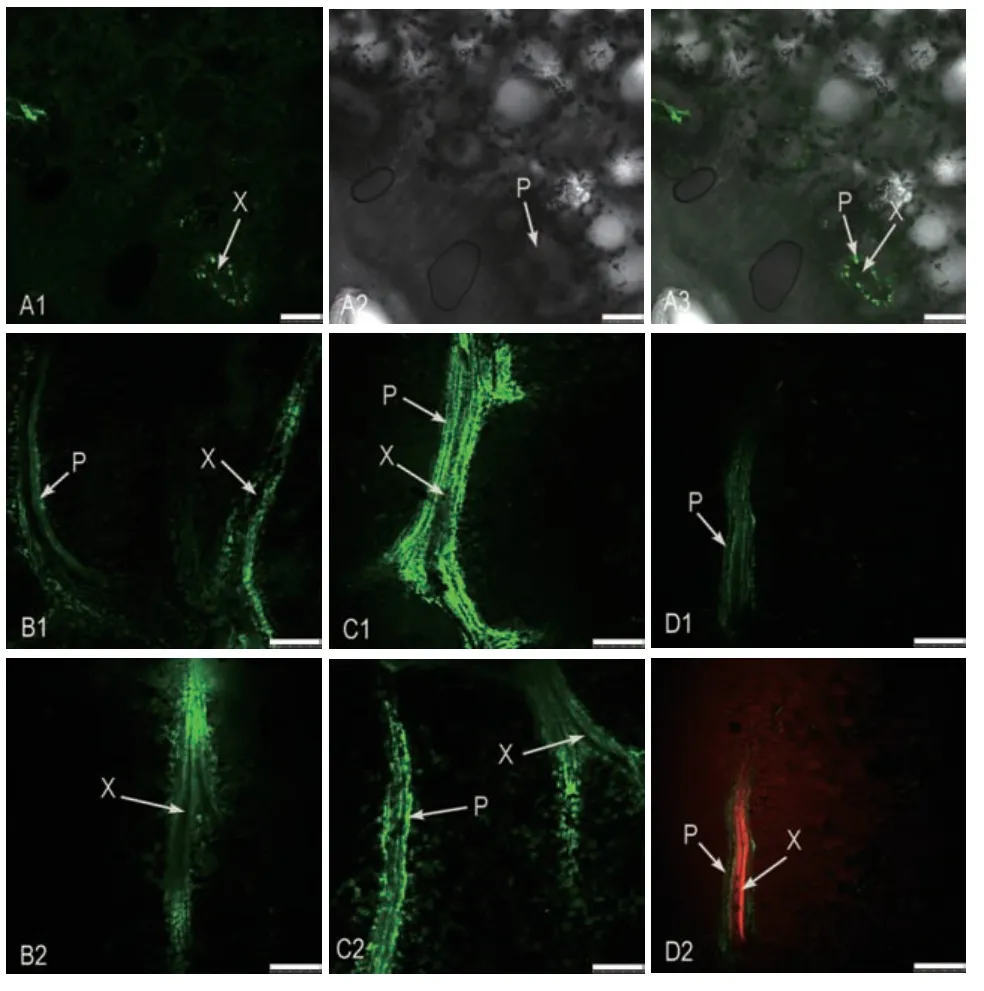
图9 枣果实维管束荧光示踪图Fig.9 Fluorescence tracing map of vascular bundles in jujube fruit
3 讨论
荧光染料活细胞示踪技术利用荧光染料的特点,将荧光染料引入枣果实维管束中,使其与果实维管组织中的化合物结合而标记,经徒手切片或冰冻切片在CLSM下观察,从而对卸载路径的过程进行示踪。由于枣果实体积较小且维管束深埋于薄壁组织中,较其他切片方式而言,徒手切片为活细胞观察但其切片厚度一般不易掌握,往往会出现切片较厚的情况,在普通显微镜下不易识别维管束的特征,CLSM荧光条件下更不易识别,为保障徒手切片在CLSM下观察同化物卸载路径研究的准确性,避免盲目观察产生的错误。因此,通过石蜡切片技术首先明确不同发育时期枣果实维管束结构特征、分布和变化规律,在此基础上,通过枣果实维管组织中荧光示踪剂引入方法的应用,探讨枣果实维管束韧皮部同化物卸载路径,是保障荧光染料活细胞示踪技术研究结果准确的基础。边媛[3]的研究认为,枣果实维管束有核内维管束、内果皮维管束和中果皮维管束3种类型,均由果柄维管束发育而来,核内维管束直接由果柄中心2条维管束伸入果核形成,内果皮和中果皮维管束由果柄其余10条维管束及其分支形成。我们的研究也认为,随果实的发育,维管束分支逐渐增加,形态因分支数目、分支角度不同,并且维管束均为外韧无限维管束,呈卵圆形,木质部导管呈辐射状紧密排列在维管束内侧,韧皮部排列在维管束外侧与木质部并生成束。膨大前期果皮维管束韧皮部比较发达,为早期内果皮木质化对大量物质的需求提供了可能,从快速膨大期到着色期、完熟期随果肉细胞发育,维管束分支增多,由最初的2个、3个分支增加到4个分支,与葡萄果实维管束的发育相似[22]。认为枣果实发育过程中维管束分支数目的增加与果实膨大生长相适应,为果实生长发育奠定了物质基础。
枣果实韧皮部同化物卸载运输途径的研究非常重要,相比其他文献,以图示的方式全过程展示枣荧光染料活细胞示踪技术是本文最大的亮点之一。CFDA和Texas-Red是目前应用广泛的荧光染料,Texas-Red可引入枣果实来标记木质部,CFDA对细胞无毒且化学惰性,具有膜透性,引入韧皮部后,其运输方式与同化物的卸载方式相类似,是一个比较理想的共质体标记物,被用于不同类型库器官中同化物的卸载路径研究。当CFDA被装载到细胞里,经内源酯酶分解为膜不通透的共质体同化物卸载的荧光指示剂CF,CF与同化物结合,其与蔗糖的运输途径也极为相似,能沿着胞间连丝扩散,从而对同化物韧皮部卸载路径进行标记。并且结合具有质膜通透作用的洋地黄皂苷的同步引入果实处理,作为韧皮部质外体卸载途径特征的印证。通过在CLSM下观察CF和Texas-Red在枣果实内的分布情况,完整的记录活体细胞内部的连续变化,进而明确枣果实韧皮部同化物卸载的路径。在传统荧光染料活细胞示踪法的基础上,本研究应用了一种更为有效的、多途径引入韧皮部荧光示踪剂CFDA和木质部荧光示踪剂Texas-Red、可快速示踪枣果实韧皮部同化物卸载路径的荧光标记方法,荧光染料引入枣果实不需要专门的设备,操作方便,在CLSM荧光观察过程中不需对样品进行特殊处理、成本低廉、高效,观察结果可靠度高。其特点主要表现在以下方面:(1)活体标记,可以追踪荧光染料在果实内的转运规律;(2)安全,无需使用放射性同位 素;(3)相关性高的特定示踪,荧光的分布反映了同化物的卸载路径;(4)简单,操作简单且CLSM观察结果可靠;(5)稳定性好,进入细胞后荧光不受内环境影响;(6)结果客观,荧光染料的引入对细胞生理活动没有任何影响;(7)经济实惠,费用经济且效率高。
在荧光示踪剂引入位点的选择方面,一类如无花果[16]等果柄较长、质地较坚韧结实、不容易断裂的果实,可采用果柄部位引入荧光示踪剂研究同化物韧皮部的卸载路径,果柄是引入荧光示踪剂的最佳部位;另一类如蓝莓[17]等果柄较短、质地不够坚韧结实的果实,通过果穗所在的茎将荧光示踪剂引入韧皮部。对于“灵武长枣”这类枣属植物来说,由于枣的叶肉细胞小而紧密,细胞间隙小,叶表皮覆盖着蜡质,通过摩擦叶片表皮或通过叶片压力注射等方法很难将荧光素物质引入叶片韧皮部;并且,由于木本果树代谢复杂,韧皮部流速度慢、距离长,可能导致荧光示踪剂因长时间引入而淬灭,达不到理想的标记效果,从而影响实时追踪同化物在果实内的卸载和运输情况;另外,由于枣果柄非常短细、质脆、特别容易断裂造成果实脱落,通过枣果柄处韧皮部引入荧光示踪剂操作异常困难,因此选取靠近果柄的短枝作为引入荧光素酯的位点,有利于荧光示踪剂以较短的距离快速引入果实,避免了荧光的快速泯灭。
在荧光示踪剂引入剂量和时间的选择方面,无花果[16]采用的剂量为1 mg/mL CFDA溶液200 μL,引入时间为24 h,Texas-Red引入时间为1 mg/mL 30 min;而蓝莓[17]采用的剂量为1 mg/mL CFDA溶液200 μL,引入时间为48 h或72 h,Texas-Red引入时间为1 mg/mL 40 min左右。由于本实验方法为定性研究方法,膨大前期果实体积较小,引入可以采用1 mg/mL CFDA溶液200 μL、80 μg/mL洋地黄皂苷200 μL左右的常规浓度和剂量,引入时间选择48 h的适中时间;而从快速膨大期到着色期、完熟期随果实发育体积不断增大,CFDA和洋地黄皂苷引入的剂量也可以适当增多,Eppendorf管和引入用的棉花团的体积也要相应增大,引入时间也可略微延长;而对于Texas-Red引入来说,采用1 mg/mL Texas-Red引入30-40 min,也可以适当增加引入的时间。但不论是CFDA还是Texas-Red,引入时间都不能过长,否则会引起荧光的快速泯灭而影响研究结果的准确。
另外,由于枣吊短枝前端的枝条和叶片,特别是非功能叶片作为库存在,能和果实竞争而固定一部分CFDA荧光染料或洋地黄皂苷,使得引入果实内的荧光染料或洋地黄皂苷减少,不能达到最佳实验效果,影响CLSM观察结果。如果通过加大CFDA荧光染料和洋地黄皂苷用量来弥补,一方面对果实有害;另一方面也造成了不必要的浪费。因此,在CFDA和洋地黄皂苷引入操作时,通过剪掉短枝前端的枝条和叶片的方法来避免此情况的发生。
4 结论
通过“灵武长枣”果实维管组织中荧光示踪剂引入方法的应用,采用1 mg/mL CFDA溶液200 μL、80 μg/mL洋地黄皂苷200 μL的常规引入浓度和剂量,选择48 h的适中引入时间,Texas-Red采用1 mg/mL浓度引入30-40 min,定性研究了枣果实维管束韧皮部同化物卸载路径,以图示的方式全过程展示枣荧光染料活细胞示踪技术,创新应用了具有质膜通透作用的洋地黄皂苷的同步引入处理,作为韧皮部质外体卸载途径特征的印证,取得了较好的研究结果。

