固定化真菌漆酶在环境有机污染修复中的应用研究进展
陈明雨 倪烜 司友斌 孙凯
(农田生态保育与污染防控安徽省重点实验室 安徽农业大学资源与环境学院,合肥 230036)
漆酶是一类胞外含铜多酚氧化还原酶(EC 1.10.3.2),普遍分布在高等植物、昆虫和微生物体内,首次被日本科学家发现于日本紫胶漆树的汁液中[1]。分泌漆酶的真菌来源较为广泛,主要包括担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和半知菌类(Deuteromycota),其中最重要的是担子菌门中的白腐真菌[2]。漆酶在生物体内的主要作用包括色素形成、木质素合成、角质层硬化和污染物解毒等[3-4]。 鉴于真菌漆酶具有良好的催化机能和底物广谱性,其已被用于去除生态环境中的多种难降解有机污染物。例如,Ulu等[5]利用改性Fe3O4磁性颗粒固定漆酶,该固定化漆酶对活性蓝171和酸性蓝74染料具有显著地脱色和降解效果。另有研究指出,漆酶和2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)[2,2’-azinobis(3-ethylbenzthiazoline-6-sulfonate),ABTS]介质在3 h内可以完全降解非甾体抗炎药双氯芬酸(diclofenac,DCF),且反应7 d后DCF的羟基化产物也被彻底消除[6]。
漆酶的催化中心含有4个铜离子,它们共同调控漆酶对不同底物分子的氧化反应[3]。该过程以水体中溶解氧作为最终电子受体,催化有机污染物的单电子氧化形成活性自由基或醌类中间体,随后这些活性中间体自发地发生耦合或键断裂反应。漆酶介导有机污染物的转化具有反应条件温和、催化效率高、底物广谱、操作可控和经济环保等优点,其能够作为一种环境友好型“绿色催化剂”[2]。目前,酶固定化技术的快速发展为漆酶在环境有机污染物去除中的大规模应用提供了广阔空间[7]。与游离态漆酶相比,固定化漆酶增强了酶的稳定性和催化效能,并提高了酶的重复利用率[8-9]。本文概述了真菌漆酶的结构特征、底物谱和催化机能,比较了漆酶的常规固定化技术及其利弊,系统地总结了固定化漆酶介导雌激素、抗生素、多环芳烃(polycyclic aromatic hydrocarbons,PAHs)、个人护理产品、合成染料,以及磺胺类药物转化的自由基耦合和氧化分解机制,该综述有望为固定化漆酶在生物修复领域中的大规模应用奠定科学的理论基础和提供技术指导。
1 真菌漆酶
1.1 真菌漆酶的分子结构和催化特性
普遍认为,真菌漆酶是一种酸性等电点单体糖蛋白,由500-550个氨基酸组成,分子量变化范围在50-70 kD;同时伴有不同程度的糖基化,糖基化含量约为10%-25%[10]。铜离子是构成漆酶催化活性中心的关键位点,在酶促反应中起着电子转移的作用[11]。根据漆酶的分子结构特征,其催化活性中心含有3种类型的Cu2+结合位点,即T1-Cu(Ⅰ Cu2+)、T2-Cu(Ⅱ Cu2+)和T3-Cu(Ⅲ Cu2+)。在漆酶铜簇位点的四面体几何结构中,T1-Cu和T2-Cu各1个,T3-Cu有2个[12]。T1-Cu位 点 的Cu2+是顺磁性“蓝色”铜,在610 nm有特征吸收峰,该位点是漆酶催化底物氧化的重要活动窗口,其可以从底物分子中获取电子并通过组氨酸-半胱氨酸-组氨酸(His-Cys-His)三肽序列传递给水中的溶解 氧[1,13]。T2-Cu位点的Cu2+是顺磁性“非蓝色”铜,该位点不稳定,在可见光区的吸收峰较弱。T3-Cu位点的2个Cu2+是反磁性双电子受体,构成一个双核铜簇中心[2]。T2-Cu和T3-Cu共同组成真菌漆酶的三核铜簇位点,该催化核心能够接收T1-Cu位点传递的电子并将水中溶解的分子氧还原为水[14]。
1.2 漆酶催化底物的广谱性和作用机制
真菌漆酶作为一种含铜多酚氧化还原酶,其催化底物十分广泛,包括木质素、酚类化合物和非酚类化合物等。例如,Chen等[15]研究了漆酶和磁性纳米粒子的协同作用对木质素模式化合物2-苯氧基-1-苯乙醇的生物降解作用。结果表明,其降解产物主要包括2-苯基氧基烷、2-苯基苯酚、2,3-二苯基氧基烷和4-苯基苯酚等。孙凯等[3]总结了漆酶催化氧化真菌体内外源或内源小分子酚类化合物及其衍生物的自由基耦合反应,该过程可以生成具有特殊功能的同源或异源生物大分子聚合物。真菌漆酶的氧化还原电位越高,可催化的底物范围越广[11]。添加小分子氧化还原介质能够进一步扩大漆酶催化的底物谱,常用的介质有1-羟基苯并三唑(1-hydroxybenzotriazole,HBT)、ABTS、紫脲酸、三苯胺和丁香醛等,这些介质在氧化还原反应中起到电子穿梭体的作用[16]。
如图1所示,真菌漆酶的催化氧化作用机制主要表现在底物自由基中间体的产生和分子氧还原成水两个方面。T1-Cu位点的Cu2+与两个组氨酸(His)的N和一个半胱氨酸(Cys)的S配位形成扭曲的四面体结构[1]。漆酶在共价键Cu-S(Cys)的配位附近接受来自底物转移的单电子,该底物被氧化成活性自由基中间体,同时T1-Cu位点的Cu2+转变成Cu+;随后这些自由基中间体在酶促位点外发生氧化耦合或目标底物的键断裂反应,最终将底物转化为大分子聚合产物或小分子分解产物[2]。T2-Cu位点的Cu2+与T3-Cu位点的Cu2+紧密相连形成的三核铜簇是真菌漆酶的催化活性中心,该铜簇位点利用T1-Cu位点传递来的电子将氧气还原成水。在真菌漆酶催化的氧化反应中,底物被氧化形成活性中间体,4个电子和4个H+通过His-Cys-His途径传递到三核铜簇中心,并将1个氧分子还原成2个水分子[13]。由此可见,真菌漆酶催化底物的氧化过程中仅生成唯一副产物水,具有高效、绿色、经济、环保等优点。
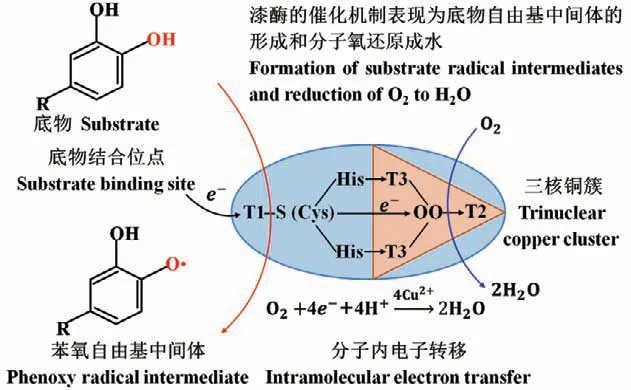
图1 真菌漆酶催化底物的分子内电子转移机制Fig. 1 Intramolecular electron transfer mechanism of substrate catalyzed by fungal laccase
2 真菌漆酶的固定化
2.1 漆酶固定化材料
与游离态漆酶相比,固定化技术显著提高了漆酶的催化活性、热稳定性、存储周期和循环利用次数[17]。载体的选择是漆酶能否实现有效固定化及效果优劣的关键[1]。目前,常用的经济型固定化载体材料主要包括无机载体材料、高分子载体材料和复合载体材料[18]。无机载体材料如纳米材料、磁性材料、介孔材料和碳基材料等,均具有良好的热稳定性、化学稳定性和机械稳定性[19];其中纳米材料比表面积较大,具有更强的化学、机械、热学和成本效益等特性,已经成为固定化漆酶的理想载体[20]。与非磁性纳米载体相比,磁性纳米载体表面含有较丰富的羟基官能团,使其更容易与漆酶的蛋白质位点结合[5]。例如,Muthuvelu等[21]将漆酶固定在铜铁氧体磁性纳米粒子(CuFeMNPs)表面,固定化CuFeMNPs的活性比游离态漆酶提高了18%,其在较宽的温度和pH范围内仍具有良好的动力学电位和稳定性,且重复使用6次后依然保持70%以上的催化活性。该类载体材料的最大优点在于可以通过磁力吸引达到迅速分离固定化漆酶的效果。单一的磁性颗粒一般不直接用于漆酶的固定化,通常将其与有机或无机载体结合形成磁性复合载体来提升漆酶的固定化效率[22]。
高分子载体材料主要分为天然高分子材料和人工合成高分子材料。天然高分子材料主要有甲壳中提取的壳聚糖和海藻中提取的海藻酸,其中壳聚糖是一种具有生物相容性的优良材料[23]。人工合成高分子材料包括聚丙烯酰胺和树脂等。目前,研究人员为增强漆酶与载体之间的稳定结合,通常采用有目的、有方向的化学修饰法,在天然高分子材料的基础上人工改良形成新的高分子材料。例如,Dwamena等[24]利用阴离子表面活性剂凝胶对壳聚糖进行表面修饰,制备多孔壳聚糖水凝胶胶囊。与具有热稳定性和操作稳定性的传统壳聚糖水凝胶相比,修饰后的多孔壳聚糖水凝胶胶囊具有良好的漆酶加载效率,并且在极端温度下仍保持良好的稳定性。复合载体材料可以是无机-无机、有机-无机和高分子-高分子材料,这种材料能够将两种材料的优点结合在一起,提高固定化漆酶的加载效率和使用性能。例如,Girelli等[19]将二氧化硅的稳定性和机械强度与壳聚糖的生物相容性和凝胶特性相结合,利用制备的二氧化硅-壳聚糖复合载体包埋、固定漆酶;结果表明,在较宽的pH(6-8)和温度(40-60℃)范围内漆酶表现出较高的活性和稳定性,其可重复循环利用15次。另有研究将海藻酸钠组成的核壳体系与磁性材料相结合,作为多功能复合载体用于固定漆酶;该封装法形成的微球能实现85.5%的漆酶固定化率,且在该固定化方法下漆酶的催化结构能在水、乙酸缓冲液和实际废水中维持稳定,同时也可实现固定化漆酶的磁力回收、提高漆酶催化活性和效率[25]。
2.2 漆酶固定化方法及其优缺点
2.2.1 吸附法 吸附法主要包括物理吸附法和离子吸附法。物理吸附法是指通过氢键、疏水作用和范德华力等相互作用使漆酶分子吸附到不溶于水的载体表面,这是一种操作步骤简洁且不需要额外添加化学试剂的漆酶固定化方法[26]。离子吸附法是一种利用漆酶和载体之间形成静电作用力的固定化方法(图2-A)。吸附法的特点之一是没有选择性,吸附质并不固定在吸附剂表面的特定位置,其优点在于固定化技术简单,可供选择的载体较多,酶蛋白的活性中心不易受破坏,酶的高级结构变化不明显。例如,Kołodziejczak-Radzimska等[27]采用吸附法将漆酶固定在介孔Al2O3表面,用获得的固定化生物催化剂对酵母出水中的黑色素进行脱色,整个过程操作简单,漆酶的流动性较好。尽管如此,吸附法也存在一定的缺陷和弊端,如漆酶和载体之间的结合能力通常较弱,漆酶无法高效固定在载体表面且容易浸出,导致固定化漆酶的重复利用率较低[28]。
2.2.2 包埋法 包埋法是一种将漆酶固定在高聚物的细微凝胶网格或高分子半透膜中的方法,该方法能有效防止酶分子的渗出(图2-B)。当酶分子或酶制剂被限制在某种载体中时,底物则需要渗入载体内与酶接触。根据载体材料和包埋方法的不同,可以将包埋法分为凝胶包埋法和半透膜包埋法。凝胶包埋法常用的载体有海藻酸钠、明胶和琼脂等天然凝胶,以及聚丙烯酰胺和聚乙烯醇等合成凝胶或树脂。半透膜包埋法常用的载体材料有聚胺、火棉胶和醋酸纤维素等,该半透膜在阻止漆酶通过的同时允许酶的作用底物自由出入[18]。在使用包埋法固定漆酶的过程中,由于酶分子本身未发生物理化学变化,因此不会引起漆酶分子构象的改变[9]。例如,Ratanapongleka等[29]采用包埋法将多色香菇(Lentinus polychrous)漆酶固定在海藻酸钡中,用于去除对乙酰氨基酚(acetaminophen,AP);与游离态漆酶的Km值(203.56 M)相比,固定化漆酶的Km值(98.86 M)较低,说明固定化可提高漆酶与AP的亲和力,且显著地增加了漆酶对pH和温度的稳定性,当固定化漆酶重复使用5次后,AP去除率和酶活性仍保持在70%以上。然而,只有小分子物质可以穿过载体与酶接触,故包埋法只适用于漆酶催化小分子底物形成低分子量产物[30]。此外,作为载体的高聚物网格和半透膜对小分子物质扩散存在阻力,这有可能改变固定化漆酶的动力学行为并降低其催化活力。
2.2.3 交联法 交联法是一种利用双功能或多功能试剂在酶分子之间、酶分子与惰性蛋白之间或酶分子与载体之间进行交联反应形成共价键的固定化方法(图2-C)。常用的交联试剂有戊二醛、己二胺、双偶氮苯和异氰酸衍生物等。例如,曹文娟和袁海生[31]采用壳聚糖交联法固定桦熠孔菌(Lenzites betulina)漆酶,研究固定化漆酶对染料的脱色和降解作用。结果表明,在壳聚糖2.5%、戊二醛7%、交联时间2 h、固定化时间5 h、1 g壳聚糖小球和1 mL给酶量(1 U/mL)的最佳条件下,漆酶的固定化效率为56%;与游离态漆酶相比,固定化漆酶具有更宽的温度范围和更稳定的pH,且重复使用8次后剩余酶活力仍高达64%。Rouhani等[32]利用戊二醛作为交联试剂将漆酶固定到Fe3O4-石墨烯复合纳米材料上,在接触时间为4 h、戊二醛浓度为5%和漆酶浓度为5 mg/mL的反应条件下,漆酶活性高达86%,固定化漆酶在贮藏20 d后仍保持88%的初始活性,而游离态漆酶在同等条件下的活性仅保持32%。此外,与游离态漆酶相比,固定化漆酶的可重用性得到明显改善。然而,由于交联法的反应较为剧烈,所以单独使用该方法固定漆酶的效果不佳。因此,交联法多与其他固定化方法联合使用。例如,与包埋法联用可防止包埋的酶或细胞泄漏,与吸附法联用可防止吸附的酶脱落。
2.2.4 共价结合法 漆酶的共价结合法是指酶蛋白的非必需基团通过共价键和载体形成不可逆的连接,这种连接是一种化学反应,即酶表面的活性氨基酸残基与载体表面的活性官能团之间的反应(图2-D)。共价键结合法普遍通过醚、硫醚、酰胺或氨基甲酸酯键形成共价键,参与结合的官能团主要包含半胱氨酸、赖氨酸、天冬氨酸和谷氨酸的侧链[9]。共价键在漆酶与载体之间提供了强大的连接,因此比其它可用的固定化方法更容易重复使用,即使是高浓度的底物溶液或盐溶液都无法使酶从载体上脱落[28]。由此可见,采用共价结合法固定的漆酶稳定性极强,酶的重复利用率也比较高;但该方法反应剧烈,在固定化的过程中漆酶直接参与了化学反应,导致酶蛋白空间结构改变,从而降低了漆酶的催化活性[30]。

图2 四种常规的真菌漆酶固定化方法Fig. 2 Four conventional methods of fungal laccase immobilization
2.3 固定化技术的条件优化
2.3.1 反胶束固定化技术 反胶束一般是在水溶液中通过不溶于水的溶剂和表面活性剂相互作用形成[33]。将漆酶置于反胶束体系中来达到固定化的作用,可以减少外界因素对漆酶活性的影响,更好地发挥漆酶的催化作用,提高漆酶利用率。例如,Xu等[34]采用异辛烷模拟含油污泥含油量制备了反胶束,通过对各种因素的优化发现,反胶束固定化漆酶降解PAHs的最佳条件为反应时间24 h、pH 4.2、温度30℃;该条件下,漆酶反胶束体系对菲、蒽和苯并[β]荧蒽等PAHs的降解率分别达到50.3%、68.2%和68.9%。
2.3.2 酶 膜 反 应 器(enzyme membrane reactors,EMRs)固定化技术 采用膜作为支撑材料的漆酶固定化方法是一种很有前途的技术,因为该技术可以在温和的条件下快速进行,且将酶促反应的高效率与膜的选择透过性有机结合,使酶活性维持在较高水平[35]。膜生物反应器具有较长的固体停留时间和较高的生物加载量,酶分子可以通过共价键或各种非共价的相互作用固定在膜内或膜上[36]。目前,漆酶主要通过共价键结合或吸附作用实现在EMRs上的固定化,以确保生物催化系统的稳定结合和可重用性[9]。例如,通过聚醚砜膜共价固定嗜热毁丝霉(Myceliophthora thermophila)漆酶的EMRs技术,能够连续去除废水中的多种雌激素类化合物,其对雌酮(E1)、17β-雌二醇(17β-E2)和17α-雌二醇(17α-E2)的去除率均达到80%以上[37]。由此可见,EMRs具有较好的热稳定性和机械操作稳定性,可以有效运行100 h,易于连续化、自控与集成化,证实了其作为酶反应器系统的高生产率和实际应用 潜力[38]。
3 固定化真菌漆酶在有机污染物去除中的 应用
真菌漆酶能够以分子氧作为电子受体,催化酚类和非酚类底物氧化形成活性自由基或醌类中间体[2]。这些活性中间体不仅可以通过C-C、C-O-C或C-N-C等共价耦合途径形成大分子聚合物,也能够通过自由基相互攻击生成小分子分解产物,聚合或分解产物的形成有效降低了环境中有机污染物的生态毒性[13]。大量的报道指出,漆酶在催化雌激素、抗生素、PAHs、个人护理产品和磺胺类药物等有机污染物自由基耦合和氧化分解反应中起到至关重要的作用,以真菌漆酶为基础的环境生物修复技术已经受到越来越多研究者的关注[39-40]。固定化真菌漆酶在环境有机污染物去除中的应用,见表1。
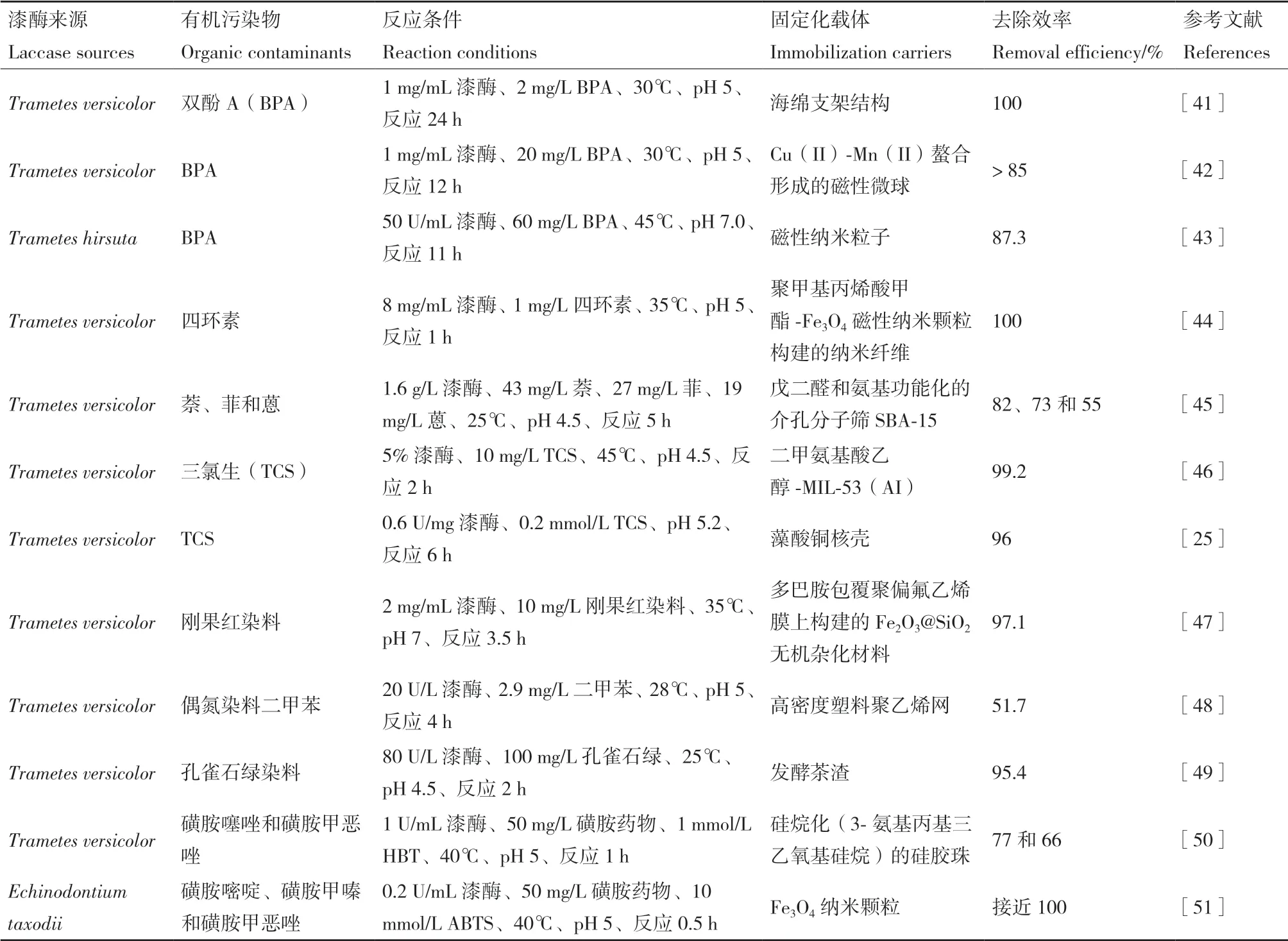
表1 固定化真菌漆酶在环境有机污染物去除中的应用Table 1 Applications of immobilized fungal laccase in the removal of environmental organic contaminants
3.1 雌激素
雌激素是一类广泛存在于水体中的微污染物,即使在低浓度条件下也能够干扰生物体的内分泌系统,长期接触会对人类和水生生物的健康造成严重危害[52]。目前,世界卫生组织已经将雌激素列为第一类致癌物[53]。环境中的雌激素如双酚A(BPA)、17β-E2和17α-乙炔基雌二醇(17α-EE2)主要来源于工业生产、畜牧养殖和农业活动。其中,BPA是一种重要的有机化工原料,主要用于制造聚碳酸酯和环氧树脂塑料,普遍存在于塑料食品容器、厨房用具、医疗设备、婴儿用品以及罐头和瓶盖的内部涂层中[17,54]。BPA在化学工业中的应用超过50年,在地表水、地下水,甚至人类尿液和血液中均检测到BPA[55]。在所有类固醇雌激素中,17β-E2是最危险的,因为它具有极强的致癌性、稳定性和高雌激素活性,并能在水生生物和人体内富集[56]。人工合成的17α-EE2可以作为避孕药片,通常女性每日只代谢体内17α-EE2总剂量的20%-48%,剩余的被排出进入废水循环[52]。近年来,研究者已经在世界范围内的各种水源中普遍检测到天然或合成雌激素[57]。目前,在我国江河等地表水甚至地下水中也频繁检测出BPA、17β-E2和17α-EE2等雌激素,暴露在环境中的雌激素对人群健康造成诸多负面 影响[52]。
雌激素中酚类结构的存在使它们成为真菌漆酶催化反应的活性底物,形成的不溶性低聚物很容易从水中沉淀或过滤出来[13]。以BPA为例,漆酶不仅能够催化BPA单体的C-C或C-O-C耦合形成二聚体、三聚体、四聚体和多聚体产物,也可以诱导BPA的氧化分解生成4-异丙基苯酚和2-(4-羟基苯基)-2-丙醇,最终矿化为CO2和H2O(图3)。Ashkan等[58]通过将氨基乙醇引入到甲基丙烯酸缩水甘油酯和多孔聚乙烯膜嫁接形成的聚合物上,制备了具有BPA生物降解能力的漆酶多层固定化膜,团队主要研究了3种介质对BPA氧化降解的影响。结果表明,添加ABTS能够使低浓度的BPA转化率提升至100%。Tatiane等[59]将漆酶固定在单氨乙基-N-氨乙基(MANAE)-琼脂糖形成的复合载体上,该固定化方法显著地提高了漆酶的热稳定性及其对BPA的降解效率。在重复使用15次后,固定化漆酶对BPA的降解能力仍保持在90%以上。因此,将漆酶固定在MANAE-琼脂糖上,可用于大规模高效连续降解水体中BPA。另有研究者采用共沉淀法,合成氨基功能化磁性纳米粒子并对其进行改性,利用磁性交联酶聚合体将漆酶固定在纳米颗粒上。结果表明,该固定化漆酶对初始浓度为60 mg/L的BPA去除率最大可达87.3%[43]。
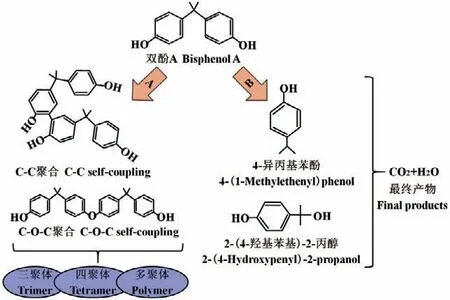
图3 真菌漆酶催化BPA聚合和分解的双功能机制Fig. 3 Dual-functional mechanisms of BPA polymerization and decomposition catalyzed by fungal laccase
3.2 抗生素
抗生素是一种治疗和消除病原菌感染的化学物质,被广泛用于医疗和畜牧业中,能够降低人类和动物感染性疾病死亡率。然而,该类化合物无法被人体和动物完全吸收,大部分经粪尿排出体外,流入土壤和水体环境,对野生生物造成负面影响,导致生态失衡[60]。目前,由于抗生素的过度滥用,研究人员已经在饮用水中检测到抗生素残留,这将对人类健康构成直接威胁[61]。根据欧盟规定[62],环境中抗生素浓度不应超过10 μg/L,而四环素类抗生素在环境中的残留浓度高达450 μg/L-900 μg/L。环境中的抗生素会对耐药细菌造成选择性压力,并可导致抗性基因在环境中迁移,从而对公众健康造成严重危害[63]。例如,四环素类抗生素如四环素(TC)和土霉素(OTC)就是一种广泛存在于废水和天然水体中的广谱抗菌剂[64]。
漆酶能够高效降解环境中抗生素。Shao等[65]利用氨基功能化的中空介孔碳球固定漆酶,研究表明其对盐酸四环素和盐酸环丙沙星的降解率均高达99%以上。图4列举了固定化漆酶-HBT混合反应体系中TC的降解机理,HBT可以通过氢原子转移机制促进漆酶催化TC的氧化、脱氢和脱甲基[44]。目前,丁香醛、丁香醇、ABTS和HBT作为几种常见的氧化还原介质,已经被广泛用于提高漆酶对抗生素的降解效率。例如,Sun等[66]探讨了漆酶-HBT体系对腐殖酸溶液中TC转化的影响;结果发现,漆酶-HBT体系显著提高了TC的降解效率,且TC可能通过与腐殖酸形成交叉耦合产物来降低其生物毒性。汤星阳等[67]指出复合介质的效果要优于单一介质,添加双天然介质丁香醛和香草醛,在0.1 U/mL漆酶、50℃、120 r/min和pH 4.0的最优反应条件下,漆酶对土霉素的降解率达到95.14%。
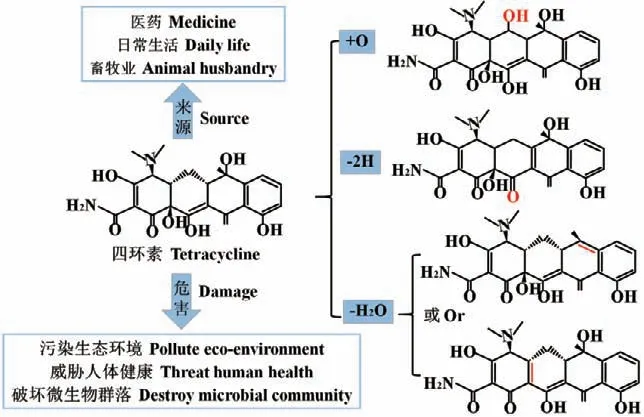
图4 真菌漆酶诱导四环素转化的氧化机制Fig. 4 Oxidation mechanism of tetracycline induced by fungal laccase
3.3 多环芳烃
PAHs是土壤和水生环境中广泛存在的一类持久性有机污染物,主要来源于化石燃料燃烧和石油产品外泄。PAHs能够被多种环境介质吸收,汽车尾气和家用采暖是户外PAHs的主要来源。此外,食品也可能因为环境来源、工业加工和某些家庭食品配制,而受到PAHs污染[68]。一些含有4个或更多苯环的PAHs如苯并[a]蒽和苯并[a]芘,可与DNA反应形成共价加合物,引起DNA氧化损伤,从而对生物体产生诱变和致癌作用[69]。PAHs具有稳定性高且不易被降解的特点,能够通过食物链传递作用迅速被人体吸收并广泛分布在机体中,进入淋巴的PAHs通过血液循环,在机体的肝脏中进行代谢,进而对人体健康产生不利影响[34]。由于能源消耗的快速增长以及交通和航运的发展,许多国家的PAHs排放量不断增加。因此,PAHs已成为各国环境污染问题关注的焦点。目前,已有16种PAHs被美国环境保护局列为优先控制污染物。
漆酶诱导的自由基氧化过程在PAHs代谢中发挥巨大作用。漆酶对16种优先控制的PAHs氧化能力差异主要取决于PAHs的电离能,由于真菌漆酶的氧化还原电势比较低,因此对同样电离能较低的蒽和苯并[α]芘的氧化作用最为突出[70]。Pozdnyakova等[71]研究发现,在漆酶的作用下蒽和菲会降解成相应的醌类代谢物,如蒽被漆酶氧化生成9,10-蒽醌,苯并[α]蒽易被氧化为苯并[α]蒽-7,12-二酮(图5)。另有研究指出,漆酶能够催化氧化苯并[α]芘,生成具有不同取代位置的醌类化合物[72]。Pozdnyakova等[73]通过考察不同介质对PAHs降解的影响,发现ABTS是较好的蒽氧化介质,HBT是较好的芴氧化介质,此外,芘和蒽混合物的降解速率要高于单一体系。Chang等[74]通过解释表面活性剂与黏土和酶的结构以及分子相互作用,论证了漆酶物理吸附在非离子表面活性剂改性黏土中对PAHs降解的重要意义。Elhusseiny等[75]采用分光光度法测定了漆酶对萘和蒽的降解效率;结果显示在作用后3 d内,蒽的降解率为27.87%,而萘的降解率高达86.47%且在5 d内完全降解,蒽在11 d后的降解率达到93.69%。萘在漆酶-介质体系的降解过程中首先转化为萘酚,萘酚再代谢为水杨酸和苯甲酸。

图5 真菌漆酶-介质体系氧化降解多环芳烃的作用机制Fig. 5 Degradation mechanisms of PAHs oxidized by fungal laccase-mediator
3.4 个人护理产品
三氯生(TCS)和三氯卡班(TCC)是一类常用作个人护理产品的高效抗菌化合物,广泛存在于水、生物和土壤中。TCS稳定性好、亲脂性强,被认为是潜在内分泌干扰物,具有抗雄激素的作用[46,76]。 污水处理厂对TCS的去除效率不高,其生成的副产品如甲基三氯生、2,4-二氯酚和2,4,6-三氯酚对环境的危害性更大[77]。在农业领域中,用处理过的废水灌溉农田和用生物油改良土壤,往往都会造成TCS污染。例如,Nie等[78]利用14C标记追踪TCS在植物体内的分布情况,结果发现其在不同组织中的生物富集因子大小顺序依次为根>茎>叶>果实。TCC化学结构稳定且具有疏水性,其在陆生和水生环境中的长期暴露给生态系统和人类健康造成巨大危害[79]。人体TCC暴露风险主要来自皮肤接触含TCC的产品、食用含TCC污染的食品和水。在正常肝细胞中,TCC暴露可打破细胞氧化还原平衡,其表现为谷胱甘肽代谢的降低和活性氧的过量产生,从而导致DNA损伤和脂质过氧化。自2017年9月起,美国食品和药物管理局已禁止在非处方消费者抗菌洗涤液中添加TCC[80]。
真菌漆酶可以催化氧化TCS和TCC的氧化耦合和分解反应。Dou等[81]系统地探讨了腐殖酸对漆酶介导TCS动力学、产物分布及作用机制的影响;结果表明,漆酶能够高效去除TCS,添加腐殖酸减少了TCS自聚体的生成,但增强了腐殖酸-TCS交叉耦合物的形成。如图6所示,TCS在漆酶催化的耦合反应中的自聚合反应分为两步。首先,漆酶催化TCS单电子氧化,形成相应的TCS反应活性自由基中间体。随后,这些活性中间体在酶促反应位点外相互耦合形成TCS二聚体、三聚体和四聚体等低聚物。理论上可以在苯氧自由基中间体的邻位或对位上生成多种TCS同分异构体的C-C和C-O-C低聚物[82]。在缺乏介质的反应体系中,漆酶催化TCS转化的主要机制是通过自由基介导的耦合反应形成低聚物;而在添加介质(HBT)的反应系统中,漆酶诱导TCS转化的主要途径则是通过醚键断裂生成2,4-二氯苯酚和3-氯苯酚等小分子分解产物[83]。
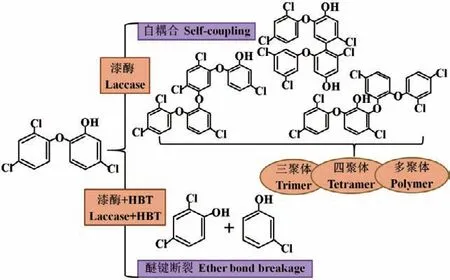
图6 真菌漆酶介导TCS转化的自由基耦合和氧化分解机制Fig. 6 Radical coupling and oxidative degradation mechanisms of TCS transformation mediated by fungal laccase
3.5 合成染料
偶氮染料和蒽醌染料作为最常用的合成着色剂,广泛存在于纺织品、彩纸、食品、人造纤维和皮革等产品中[84]。在工业生产过程中产生的有机偶氮染料不仅会造成严重的水污染,还会在野生生物体中产生潜在的致癌、致畸、致突变风险[85-86]。当含有染料的纺织废水被排放到水生环境时,增加了水的颜色,影响阳光在水中的透过,从而降低光合活性、减少水中溶解氧浓度。一系列物理或化学方法包括吸附、膜过滤、电化学技术和高级氧化工艺等已经被用来去除合成染料,但是它们大多存在运行和投资成本高、产生二次污染等缺点[87]。因此,研究人员将关注点更多地放在具有催化效率高、耗能少和环保等特性的生物酶上[88]。
漆酶可以利用高度非特异性的自由基来消除蒽醌和偶氮染料中发色基团的分子结构,从而达到染料脱色和降解的目的(图7)。该方法已经被应用于处理染料废水。Legerskáe等[89]研究真菌漆酶对两种单偶氮染料橙2和酸性橙6的脱色效果。结果表明,在处理120 h后前者的脱色率为72.8%,后者的脱色率为43.5%,可见漆酶对萘酚型偶氮染料的脱色率高于非萘酚型偶氮染料。Othman等[90]将漆酶固定在添加多壁碳纳米的硝酸纤维素上用于活性黑5(RB5)脱色,反应6 h和24 h后RB5脱色效果分别达到68.09%和84.26%。Abbasi[87]将漆酶固定在碳纳米管上用于提高其吸附性能,在pH 6.8和pH 2.0时固定化漆酶对直接蓝71(DB71)染料和反应蓝19(RB19)染料的吸附量分别达到最大值61.35和97.08 mg/g;其中DB71去除率为80%-86%(pH 2-10),DB71去除率最高可达89%(pH 7)。根据粒子扩散动力学,染料在漆酶-碳纳米管表面或内部的扩散速率相对较高,这种仿生纳米复合材料在废水处理中具有极大的潜在应用价值。

图7 真菌漆酶催化蒽醌和偶氮染料脱色的作用机制Fig. 7 Decolorization and degradation mechanisms of anthraquinone and azo dyes initiated by fungal laccase
3.6 磺胺类药物
磺胺类药物是一类在结构上具有对氨基苯磺酰胺的化合物的总称,属于人工合成抗菌药,具有抗癌、抗真菌、消炎镇痛等多种功效。在畜牧业和水产养殖业中,磺胺类药物通常作为饲料添加剂用于促进动物生长。磺胺类药物在生物体内代谢周期长,极易在水产品中残留,从而导致水产品药物残留超标。近年来,研究者已经在河流、湖泊、海洋等水体中频繁检出磺胺类药物,其残留质量浓度在ng/L-μg/L级别[91]。为了确保消费者购买的食品安全,中国及欧盟等[92]都提出了食品中允许添加的磺胺类药物最大残留限量不应超过100 μg/kg。
磺胺类药物的氧化还原电位较高,难以直接被真菌漆酶氧化降解,但是添加氧化还原介质可以有效地促进漆酶去除磺胺类药物。如图8所示,丁香酸介质可被漆酶氧化为2,6-二甲氧基苯并醌(2,6-DMBQ)中间体,随后该中间体和磺胺类药物形成交叉耦合产物[51]。丁香酸、丁香醛和丙酮等介质对漆酶的亲和力各不相同,因此导致漆酶对磺胺类药物的催化效率差异显著。丁惠君等[93]研究了两种介质(丁香醇和HBT)对漆酶降解磺胺类抗生素的影响。结果表明,加入丁香醇介质处理组的磺胺类抗生素降解率达到70%-90%,比不加介质的漆酶组高出60%-70%,而加入HBT介质处理组的磺胺类抗生素降解率仅为16%-45%。主要原因可能是因为两种介质分别产生高活性的酚氧自由基和氮氧自由基,对漆酶降解黄胺类抗生素起到不同的促进作用。另有研究指出,漆酶-ABTS体系在6 h内能够彻底降解磺胺甲恶唑(sulfamethoxazole,SMX),该复合体系对SMX和磺胺嘧啶(sulfadiazine,SDZ)混合物中相应污染物的降解率也分别达到82%和85%[94]。
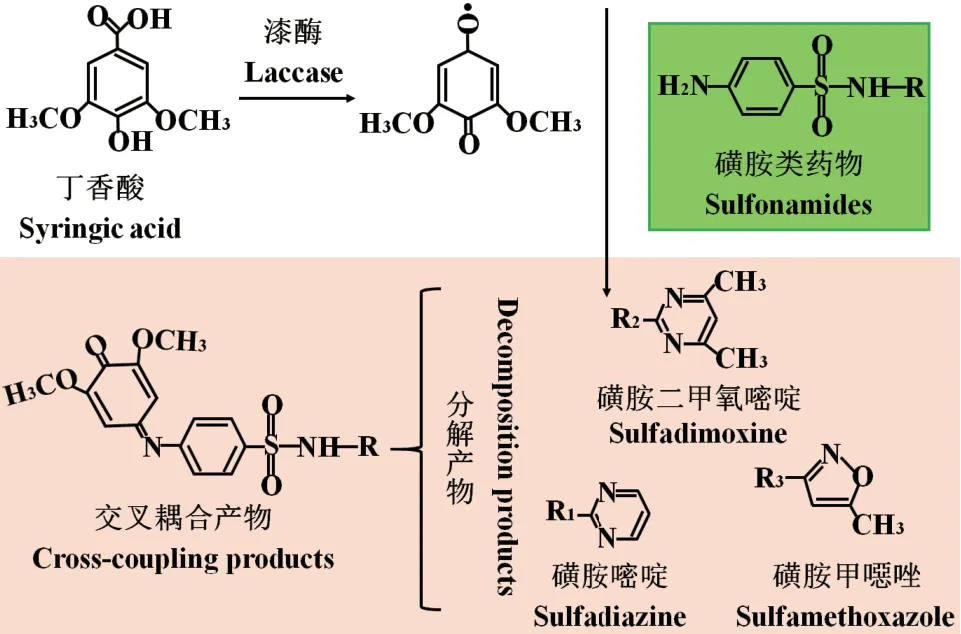
图8 真菌漆酶催化磺胺类药物的转化机制Fig. 8 Transformation mechanisms of sulfa drugs catalyzed by fungal laccase
4 结语
与传统的物理化学方法相比,固定化真菌漆酶具有反应条件温和、催化活性高和环境友好等优点,有望大规模应用于环境有机污染物修复。然而,如何提高漆酶的催化活性和重复利用率,降低漆酶在环境修复中的应用成本,已经成为研究者亟待解决的关键问题。固定化技术可以提高漆酶的稳定性和使用效率,本文比较了吸附、包埋、共价结合和交联等4种常规酶固定化方法的优缺点,并提出反胶束和酶膜两种优化的固定化技术,举例说明无机载体、高分子载体和复合载体在固定漆酶中的应用,重点总结了固定化漆酶介导雌激素、抗生素、多环芳烃、个人护理产品、合成染料和磺胺类药物的自由基耦合和氧化分解机理。综合以上有关固定化真菌漆酶在有机污染物降解和转化中的应用,整理出国内外相关研究人员的最新研究进展。在未来的研究过程中,研究者仍需从以下几个方面不断开展创新型研究,充分发挥真菌漆酶在环境修复中的潜在应用价值:(1)探索更加优良的固定化载体材料,降低制备成本、增强漆酶稳定性;(2)有针对性地研究出能够稳定应用的综合固定化技术,提高漆酶催化效率和重复利用率;(3)充分发挥真菌漆酶在环境有机污染修复领域的优良特性,与生物化学修复技术相结合,扩大漆酶在绿色环境发展中的作用。

