不同类型氮组成对异养硝化好氧反硝化体系中氮转化的影响
樊 琳,产江为,周 波,胡思海,张江华,吴耀国*
1.西北工业大学应用化学系,陕西 西安 710129
2.中国地质调查局西安地质调查中心,陕西 西安 710054
氮元素是影响甚至是控制水体富营养化的关键要素之一[1]。因此,陆地水生生态系统中的脱氮研究一直是我国乃至世界生物地球化学科学的学科前沿,研究解决自然界中污染水体的氮转化规律及氮的复合污染问题是一项紧迫的任务[2,3]。传统的生物脱氮技术依赖于硝化作用和反硝化作用的有机结合,但由于硝化和反硝化作用的功能微生物其生态位差别非常大,硝化和反硝化作用通常需要在两个独立的反应器中进行[2,4,5]。而好氧反硝化微生物的发现,使得硝化和反硝化作用能够同步进行成为可能,这不仅大大节省了基建投资费用,反硝化过程产生的碱度也能够补偿硝化作用所消耗的酸度,进一步减少了运行成本[2,3]。凭借其独特优势,好氧反硝化生物脱氮技术自提出以来,受到国内外环境领域学者的广泛关注[2-6]。因此,有必要在异养硝化-好氧反硝化(HN-AD)体系中研究氮的转化规律。
目前关于HN-AD 体系中氮转化领域的研究非常多[2,3,7,8],主要集中在探究环境因子对与氮转化的影响,例如:温度、碳种类、pH、C/N 和溶解氧等。例如,Zheng JH,et al.研究了低温状态下,异养硝化需氧反硝化细菌Acinetobacter harbinensisHITLi7T的脱氮能力和生长动力学特性[3]。Chen 等探究了DO(溶解氧)、pH、C/N(碳氮比)对异养硝化和好氧反硝化细菌Acinetobactersp.T1 脱氮功能的影响[5]。Fu 等研究了复合发酵液对异养硝化好氧反硝化细菌群落对人工湿地盐分污水中氮去除的影响[6]。以上研究丰富了人们对影响异养硝化好氧反硝化菌脱氮性能的认识,然而在自然环境中,除了以上环境因子,环境中初始氮源种类、浓度、不同氮组成的比例等因素对HN-AD 体系中氮转化过程也存在很大影响。而这种地域特性对于水体中氮转化的影响研究鲜有报道。
鉴于上述,本研究将这种新型生物脱氮技术应用到较为现实的自然污染水体中,通过建立HN-AD 体系模拟自然水生生态系统,考察了不同初始浓度、不同氮源种类、不同氮组成对HN-AD体系中氮转化的影响,初步探讨其氮转化机制,以期为富营养化水体的修复提供理论支持。
1 材料与方法
1.1 试剂与仪器
NH4Cl、KI、KNaC4H12O10·4H2O,均为分析纯,购买自广东光华科技股份有限公司、KNO3、NaNO2、HgI2、C12H14N2·2HCl、NH2SO3H,均为分析纯,购买自国药集团化学试剂有限公司。本实验所用-N、-N 和-N 分别用NH4Cl,KNO3和NaNO2配制。其中,NH4Cl、KNO3和NaNO2标准储备液浓度均为100 mg/L,4 ℃冰箱下保存,实验中根据需要稀释至使用浓度。实验用水均为超纯水,电阻率不低于18 KΩ·cm;电子天平(上海越平);紫外分光光度计(上海光谱);可见分光光度计(尤尼珂上海);便携式pH 测量仪、便携式ORP 测量仪(上海三信);离心分离机(安徽中科中佳);超声波清洗机(昆山超声仪器);曝气泵(广东中山蓝海电器)。
1.2 采样
沉积样和水样采自西北工业大学长安校区启翔湖(北纬34°1′30′′-34°1′40′′,东经108°45′3′′-108°45′40′′),湖表面积为0.03 km2,平均水深1.4 m,最大水深3 m。该地区属典型的大陆性季风气候,夏季炎热多雨,冬季寒冷干燥,年均气温15.6 ℃,年平均降水量约554 mm(夏秋季多雨)。在20 个随机沿湖堤岸的沉积-水界面分别采集沉积物样和水样,其中采集的20 个沉积样混合均匀后形成复合样品,20 个水样等比例混合均匀形成水样。水样和沉积物样品的理化性质见表1 所示。

表1 水和沉积物样品的物理化学性质(n=3)Table 1 Physicochemical property of the water and sediment samples(n=3)
1.3 实验方法
将100 g 均质沉积物和800 mL 湖水注入1000 mL 棕色玻璃瓶中,同时根据实验目的外加适宜的化学组分。微宇宙实验是在持续曝气反应器中进行,实验装置如图1 所示。每个反应器中根据实验设计要求,加入不同浓度的-N、-N、-N 等化学物质构成微宇宙系统。
分别取5 mL待测溶液于离心管中,于10000 r/min转速下离心10 min取上清液测量溶液中-N、-N、-N 含量。其中,-N 测定采用纳氏试剂法、-N 测定采用N-(1-萘基)-乙二胺光度法、-N 测定采用紫外分光光度法。
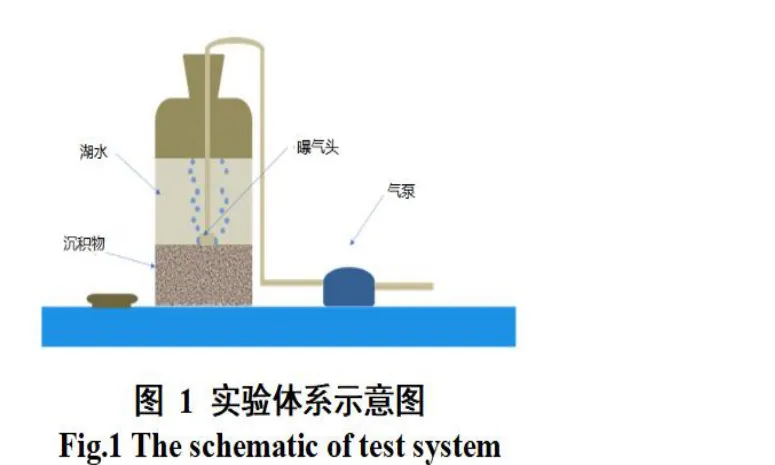
2 结果与讨论
本实验设置6×3 组实验,其中D1、D2、E1、E2、F1、F26 组实验分别为-N 与-N 组合、-N 与-N 组合、-N 与-N 组合等多种组合形式中的一种。试验中通过对比单一氮源条件下体系中氮转化的规律,得出一种氮源的介入对另一种固定氮源氮转化带来的影响。其中,D1与D2组分别探究-N 与-N 的介入对-N 转化的影响,E1与E2组分别探究-N 与-N 的介入对-N 转化的影响,F1与F2组分别探究-N 与-N 的介入对-N 转化的影响。每组实验下又设置3 小组,分别探究0,25,50 mg/L 3 种浓度的介入氮源对已有氮源的影响情况。所有实验小组均于上述已经确定的体系中进行实验探究,各小组均添加曝气装置,不添加外来碳源。不加碳的原因是:(1)搭建体系中的沉积物含有碳源;(2)确立体系实验过程中发现,外加碳后,体系内氮转化速率过快,不利于研究进行。
设置D1-1、D1-2、D1-3、D2-1、D2-2、D2-36 小组实验。其中D1组中3 个实验分别探究0,25,50 mg/L浓度的-N 对50 mg/L-N 中氮转化过程的影响;D2组中3 个实验分别探究0,25,50 mg/L浓度的-N 对50 mg/L-N 中氮转化过程的影响。图2 是硝态氮加入对氨氮体系中氮转化的影响情况。图3 是亚硝态氮加入对氨氮体系中氮转化的影响。该实验过程中持续监测DO 含量,数据显示DO 始终维持在7~9 mg/L 范围内,整个反应过程均于好氧条件下进行。
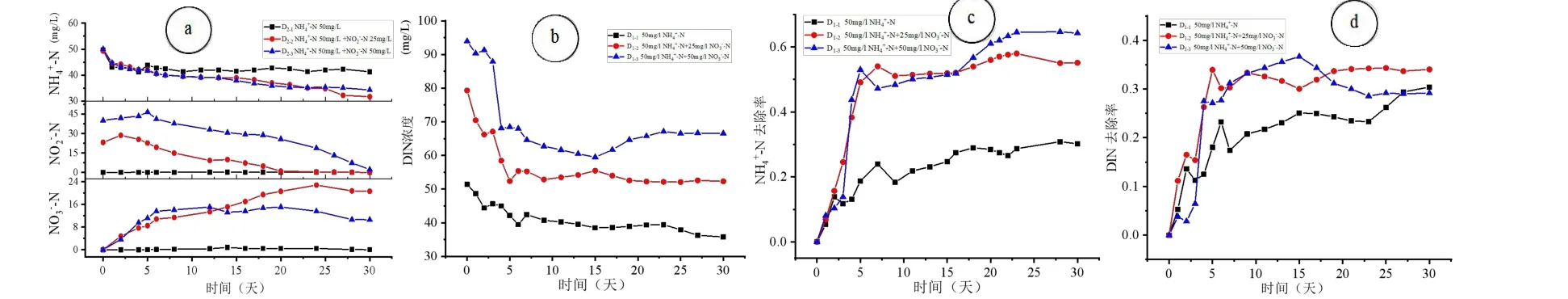
图2 硝态氮加入对氨氮体系中氮转化的影响Fig.2 Effect of NO3--N on the nitrogen transformation in -N system
由图2 可以看出,浓度相同的氨氮体系中投加不同浓度的硝态氮后,氮转化特点为:(1)对比D1-1未投加硝态氮组别,其他两组加入硝态氮的组别中,前5 d 内氨氮降解速率明显加快,且比较D1-2和D1-3随着硝态氮浓度增加,氨氮的去除率越大;(2)加入硝态氮后,体系中亚硝态氮的最大积累浓度没有明显变化,但达到该值的时间明显前移;(3)整个反应体系中硝态氮浓度反应前后几乎没有变化。这是由于加入硝态氮导致氨氮降解速率增大,是因为硝态氮有利于增加羟胺氧化酶的活性,进而加速氨氮向亚硝态氮的转化[7,9]。这也是导致亚硝态氮峰值前移的原因之一,另外随着硝态氮的量增加,反硝化作用中反应物浓度增大,又有利于反硝化→进行,这也导致了前期亚硝态氮的积累速度增加。整个反应过程中,硝态氮浓度存在起伏波动,但最终在反应前后其含量维持不变,这可能是由于硝化作用和反硝化作用产生和消耗的硝态氮量几乎抵消[10,11]。
由图3 可以看出,浓度相同的氨氮体系中投加不同浓度的亚硝态氮后,氮转化特点为:(1)对比D2-1未投加亚硝态氮组别,其他两组加入亚硝态氮的组别中,氨氮的去除率增加;比较D2-2和D2-3随着亚硝态氮浓度增加,氨氮去除率没有明显变化,甚至有下降趋势。(2)体系中亚硝态氮含量一直处于递减,起始亚硝态氮浓度为25 mg/L 时,亚硝态氮大约在第20 d 降解完全,去除速率为1.19 mg/L/d,起始亚硝态氮浓度增加到50 mg/L 时,反应到30 d 时,去除速率为1.26 mg/L/d,因此增加亚硝态含量对其自身的去除影响不大。(3)由于亚硝态氮介入,硝态氮积累浓度出现大幅增长。但起始亚硝态氮浓度为50 mg/L 的体系中硝态氮的积累量反而小于25 mg/L 的体系。这说明亚硝态氮的介入有利于反硝化细菌的生长[8,11,12],进而促进亚硝态氮向氮气的转化反应→N2O ↑→(N2)↑。从而使得→转化的产物减少,进而促进硝化作用进行,增加氨氮的去除率。
体系中增加亚硝态氮,对其去除速率影响较小的原因有两个方面:一方面可能是体系已经达到了对亚硝态氮去除的最大负荷;另一方面较高浓度的亚硝态氮具有一定的毒性,会抑制微生物的活性,进而减慢了其去除速率[7,11-13]。随着亚硝态氮的介入,硝态氮的大量积累的原因有:一方面亚硝态氮是硝化作用→的反应物,增大反应物浓度有利于促进反应进行,故增加了硝态氮积累;另一方面亚硝态氮也是反硝化过程→的产物,增大产物浓度会抑制反应进行,进一步促进了硝态氮的积累[9,11,14,15]。增加亚硝态氮含量会降低生物活性,因此过多的亚硝态氮可能不利于硝化作用积累更多的硝态氮。

图4 氨氮加入对硝态氮体系中氮转化的影响Fig.4 Effect of -N on the nitrogen transformation in NO3--N system
图4 所示,向浓度相同的硝态氮体系中投加浓度不同的氨氮后,体系中氮转化的特点为:(1)对比E1-1未投加氨氮组别,其他两组加入氨氮,硝态氮的转化作用出现了明显抑制;比较E1-2和E1-3可知,氨氮浓度增加对硝态氮转化影响作用的提高不明显。(2)氨氮本身的变化情况随着浓度升高。(3)随着氨氮浓度的增加,体系中亚硝态氮的积累量降低,且达到最大值时间前移。
加入氨氮对硝态氮的降解有抑制作用,有几方面因素:(1)氨氮可以直接作为细菌合成生物大分子例如蛋白质的氮源,一般认为氨氮作为氮源要优于硝态氮[9,14,15]。因此,向硝态氮体系中加入氨氮会影响微生物对硝态氮的降解。(2)加入氨氮后,体系中微生物优先利用氨氮进行硝化作用会产生硝态氮,这也弥补了反硝化消耗的硝态氮[7,13]。因此导致反应前后检测到的硝态氮浓度几乎保持不变,甚至出现积累。整个反应过程,反应前后亚硝态氮的积累量减小,主要是因为体系中反硝化作用由于氨氮的介入受抑制:→。而加入氨氮体系中,前期亚硝态氮的积累主要是由于硝化作用产生→,加入的氨氮浓度越高,亚硝态氮的积累量越大且达到最大值的时间越早。
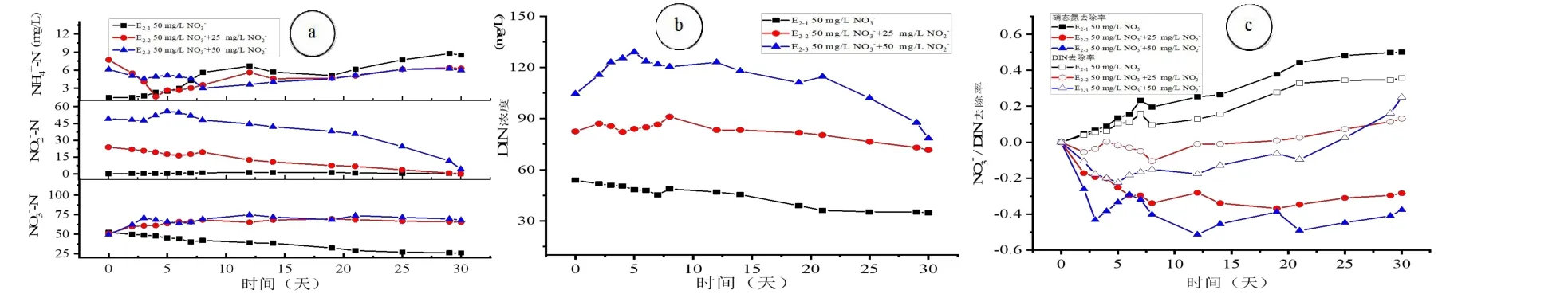
图5 亚硝态氮加入对硝态氮体系中氮转化的影响Fig.5 Effect of -N on the nitrogen transformation in NO3—N system
图5 可以看出,向浓度相同的硝态氮体系中投加浓度不同的亚硝态氮后,氮转化特点为:(1)对比E2-1未投加亚硝态氮组别,其他两组加入亚硝态氮的组别中,硝态氮的转化受到了极大地抑制作用,未加入亚硝态氮时,其转化率达到了50%,但加入了亚硝酸盐后,体系中硝态氮几乎没有降解,甚至产生了少量积累;比较E2-2和E2-3可知,改变投加亚硝态氮的浓度对硝态氮转化影响作用不明显。(2)亚硝态氮的加入对于氨氮的积累也有一定的抑制,这与D2组别中的实验结果一致,增加体系中亚硝态氮浓度有利于氨氮降解,故不利于其积累;(3)在硝态氮体系中投加亚硝态氮,亚硝态氮本身的降解并未受到影响。
图6 可以看出,向浓度相同的亚硝态氮体系中投加浓度不同的氨氮后,体系中氮转化的特点为:(1)对比F1-1(未投加氨氮)和F1-2,F1-3(投加氨氮),前6 d 体系中主要发生硝化作用,体系中氨氮浓度下降,亚硝态氮浓度维持稳定,尤其是→转化过程明显加快,体系中硝态氮的积累增大。特别是前3 d 体系中溶解性无机氮浓度相对稳定,说明此时体系中正在进行:→→的反应,在此过程中,亚硝态氮的浓度并未出现下降现象。反应第3 d 到第5 d 体系中氨氮浓度不再下降,亚硝态氮浓度开始下降,硝态氮浓度达到峰值,体系内溶解性无机氮略有下降,说明此时体系中存在→的硝化反应和→N2的反硝化反应。(2)反应进行6 d 后,体系中亚硝态氮浓度继续下降,而氨氮与硝态氮浓度几乎维持稳定,整体溶解性无机氮浓度也在下降。最后到达第20 d 时,体系中伴随亚硝态氮浓度持续降低,硝态氮浓度也开始下降,体系中主要进行反硝化反应。

图6 氨氮加入对亚硝态氮体系中氮转化的影响Fig.6 Effect of -N on the nitrogen transformation in -N system

图7 硝态氮加入对亚硝态氮体系中氮转化的影响Fig.7 Effect of -N on the nitrogen transformation in -N system
由图7 可知,向浓度相同的亚硝态氮体系中投加浓度不同的硝态氮,氮转化的特点为:(1)对比F2-1(未投加硝态氮)和F2-2,F2-3(投加硝态氮),亚硝态氮降解速率下降。加入硝态氮浓度越大,对亚硝态氮的降解率越小。(2)硝态氮的加入,氨氮的积累量减少。(3)随着硝态氮加入,体系内硝态氮积累含量反而增加,这导致体系内DIN 去除率大大降低,且硝态氮浓度越大,抑制DIN 去除作用越明显。加入-N 对-N 体系中氮转化影响,有以下几方面因素:(1)体系中亚硝态氮降解减慢,是因为硝态氮是硝化反应的产物:→,加入产物会影响反应进度;硝态氮是反硝化的反应物:→,反应有利于的积累。对比F2-1和F2-2,F2-3,硝态氮的加入会进一步导致亚硝态氮的累积,会降低亚硝态氮的降解率[11,15,17]。(2)加入硝态氮导致氨氮积累量减小,一方面是因为硝态氮有利于增加羟胺氧化酶的活性,进而加速氨氮向亚硝态氮的转化,减小其积累量,这与D1的实验现象一致。另一方面,硝态氮加入,不利于体系中亚硝态氮的同化反应进行:。(3)当体系中含有亚硝态氮时,体系中硝态氮的含量几乎维持不变,但增加硝态氮不影响亚硝态氮最终的去除率,故导致体系中DIN 的去除率大大减小。
3 结论
通过模拟自然水生生态系统,构建HN-AD 体系,探究在该体系下氮组成对氮转化的影响。HN-AD 体系中以-N/-N、-N/-N、-N/-N 等不同组合氮源作为体系中外来碳源,一种氮源对另一种氮源氮转化影响为:(1)当-N 与-N 分别加入到含有-N 的体系中,加速体系中氨氮的降解,氨氮的降解率从30%分别提高到65%和55%;(2)当-N 与-N 分别加入到含有-N 的体系中,会严重影响硝态氮的降解,-N 的体系中硝态氮的降解率从50%左右下降到几乎不降解,-N 的体系中硝态氮浓度甚至会增加;(3)当-N 与-N 加入到含有-N 的体系中,会降低亚硝态氮的降解率,但亚硝态氮的转化率几乎都能达到100%。因此,在水生生态系统中存在HN-AD 体系并导致氮转化率的提高,而培养良好的HN-AD沉积物可能是修复富营养化水体的有用生物工具,研究结果为修复水体氮污染水体提供理论依据。

