基于转录组学技术分析蛋白质限制与补偿对羔羊肝脏抗氧化性能的影响
康凌云 陈建胜 甘瀚凌 韩露露 冯海霞 刁其玉 邢凯 崔凯
(1. 中国农业科学院饲料研究所 农业农村部饲料生物技术重点实验室,北京 100081;2. 北京农学院,北京 102206;3. 山东省德州市陵城区农业农村局,德州 253500)
自由基稳衡理论指出,动物机体内的自由基处于不断产生与清除的动态平衡中,当ROS的产生及其作用超过抗氧化系统对ROS的清除能力时,就会破坏机体氧化还原稳态,引起氧化应激[1]。畜牧生产中,氧化应激导致幼畜成活率下降和腹泻等动物性疾病,并对畜禽生 产水平和畜产品品质造成严重影响[2]。日粮中营养物质是动物体内自由基产生的物质基础,也是动物体内清除自由基的物质来源[3]。日粮变化能够影响胚胎及出生后幼畜的抗氧化酶活性和代谢调节能力。在肉羊生产过程中,饲料成本在养殖成本中占有较高比例,加之我国蛋白饲料资源缺乏,导致在早期发育过程中存在蛋白供应不足现象,对羔羊的健康生长产生重要影响。因此,探明蛋白质水平与机体抗氧化应激的作用机制具有重要意义。氧化应激编程假说(oxidative stress programming hypothesis)指出,氧化应激是影响胎儿早期生长发育以及后代患代谢疾病的第一因素[1]。He等[4]研究发现妊娠后期母羊饲粮蛋白质水平限制降低了后代羔羊的抗氧化能力,经过产后营养水平的恢复,多数的抗氧化指标及基因表达水平可恢复到正常水平。张帆等[5]研究发现妊娠后期母羊低营养水平(低精料补充料比例)能够降低羔羊初生重,但经补偿生长作用,生长性能也得到恢复,羔羊血清抗氧化能力得到提高。高蛋白日粮能使小鼠胰腺产生ROS,其生成水平随蛋白质的消化吸收而变化,而且氧化负荷导致胰腺抗氧化防御系统能力下降[6]。李东东等[7]研究发现高蛋白水平的饲粮有助于提高肉鸡的抗氧化功能和生产性能。
RNA-seq技术能够从整体转录水平系统研究基因转录图谱并揭示复杂生物学通路和性状调控网络机制,并在畜牧学研究中得到广泛应用[8-10]。前人研究证实,妊娠期母体日粮水平能够改变胚胎及幼畜抗氧化能力,并对幼畜的代谢和免疫功能产生长期效应。然而,关于断母乳幼畜饲粮营养水平对其抗氧化机能研究较少。本试验选用双胞胎湖羊羔羊作为研究对象,基于RNA-seq技术测定肝脏基因表达变化情况,探讨蛋白质限制与补偿对羔羊物质代谢及抗氧化功能的影响,为羔羊早期健康培育提供理论依据。
1 材料与方法
1.1 材料
本试验在江苏省泰州市姜堰海伦羊业有限公司湖羊养殖基地进行,历时90 d;试验羊只为湖羊,RNA提取试剂购自ThermoFisher公司。
1.2 方法
1.2.1 试验处理 本试验选取15日龄、体重相近(6.08±0.56 kg)且发育正常的湖羊公羔32只,分为两组。对照组饲喂正常蛋白水平的代乳粉(CP为25%)和开食料(CP为21%),记为试验组NPL(normal protein level,NPL);另一组饲喂蛋白水平分别为19%的代乳粉和15%的开食料,记为试验组LPL(low protein level,LPL),每个处理16只羔羊。试验羊15日龄断母乳,人工饲喂相应的代乳粉至60日龄,开食料自由采食。61-90 d所有试验羊均自由采食蛋白水平为21%的开食料。分别在羔羊60日龄和90日龄进行屠宰,采集羔羊肝脏组织用于后续转录组学测定分析。
1.2.2 试验日粮 正常水平代乳粉和开食料的配制参照发明专利ZL201210365927.6[11]和肉羊饲养标准(中华人民共和国农业部,2004)[12],低蛋白水平参照岳喜新[8]的试验结果进行配制。两组开食料成分及代乳粉和开食料营养水平见表1。

表1 NPL组和LPL组开食料的成分及代乳粉和开食料营养水平(风干基础)Table 1 Ingredients and nutrient composition of the milk replacer and starter(dry matter basis)
1.2.3 饲养管理 试验正式开始之前对整个圈舍进行全面的消毒,按照羊场的正规程序对试验羊只进行免疫。试验用羔羊单栏饲喂,每只羊活动空间约为2 m2,每半个月对所有栏位进行消毒1次。15-60日龄试验羊代乳粉每天的饲喂总量按体重的2.0%进行,饲喂量根据试验过程中羔羊的健康状况进行适当的调整,以保证羔羊的正常生长。30日龄前每天饲 喂3次(07:00、13:00和19:00),31-60日龄每天饲喂两次(08:00和18:00)。
1.2.4 样品采集与分析测定
1.2.4.1 肝脏样品采集 羔羊在60和90日龄时,每组分别随机选取2只羔羊于清晨8:00进行屠宰。宰前16 h禁水禁食。肝脏组织用生理盐水冲洗干净后放到液氮预冷的1.5 mL冻存管中,并迅速置于液氮中速冻,存放到-80℃冰箱中备用。
1.2.4.2 RNA提取及质量检测 分别取60和90日龄2对双胞胎羔羊肝脏组织约50 mg,利用TRIzol法提取总RNA,用DNA酶(DNase-I)进行处理。通过琼脂糖凝胶电泳检测RNA的完整性,用核酸测定仪测定RNA浓度。文库构建及测序工作由北京诺禾致源生物信息科技有限公司完成。
1.2.4.3 原始数据分析 测序得到原始图像文件经 CASAVA 1.8 软件进行碱基识别(base calling)和 Bcl2Fastq 分析转化为原始测序序列(rawdata),结果以FASTQ文件格式存储。对Raw data进行过滤,去除接头和低质量的reads,得到高质量的 clean reads。使用TopHat v2.0.9完成clean reads和绵羊参考基因组Oarv3.1的比对[13]。
1.2.4.4 差异表达基因鉴定 应用Cufflinks对比对结果进行基因定量,通过每个基因的FPKM(fragments per kilobase of exon model per million mapped reads)估算基因表达水平[14]。应用DESeq将归一化得到的FPKM值进行差异基因分析[15]。采用Fold-change(FC,表达差异倍数)以及P统计学方法对差异基因差异程度进行筛选,满足|log2FC|>1且Padj<0.05定义为差异表达基因(different expressed genes,DEGs)[16]。
1.2.4.5 差异基因功能分析 利用DAVID(the database for annotation,visualization and integrated discovery)在线分析软件(http://david.abcc.ncifcrf.gov/)对差异表达基因进行GO(gene ontology)功能聚类分析[17]和KEGG(kyoto encyclopedia of genes and genomes)通路分析[18]。
1.2.4.6 实时荧光定量PCR(qRT-PCR)分析 选择与抗氧化相关的4个差异表达基因进行qRT-PCR验证。将转录组测序用到的RNA,通过反转录试剂盒(FastQuant RT Kit购于天根生化科技有限公司)合成cDNA第一链,以其为模板,利用SuperReal PreMix Plus Kit(购于天根生化科技有限公司)在Bio-Rad CFX96实时荧光定量仪上进行qRT-PCR。以GAPDH作为内参基因,每个基因的定量分析设置3次生物学重复,3次技术重复,采用相对定量2-△△Ct法分析。
2 结果
2.1 RNA提取与质量检测
琼脂糖凝胶电泳检测结果如图1所示,28S rRNA与18S rRNA电泳条带清晰,OD260/OD280值在1.9-2.1之间,各样品的RIN值均大于6.8,满足RNA-seq分析要求。

图1 肝脏总RNA凝胶电泳图Fig.1 Electrophoregram of total RNA in the liver
2.2 测序数据质控
测序结果表明,所有样品Raw reads数目在41 189 720至60 109 450之间,去除接头和低质量的reads,Clean reads 数目在40 057 846至58 311 854之间,占raw reads的比例为95.54%-97.50%,所有样品的错误率均为0.02%。参考序列比对结果见表2。标准试验条件下,映射到基因组的序列(total mapped reads or fragments)比例≥70%,其中具有多个定位的测序序列(multiple mapped reads or fragments)占总体的百分比≤10%。本试验条件下,所有样品Clean reads占参考基因组均值为78.01%±0.76%,Multiple-mapped reads值小于3.18%,均符合试验要求。测序原始已上传至NCBI SRA数据库(编号:SRX2160967)。

表2 所有样品的测序数据评估表Table 2 Data information of all samples collected by RNA-seq
2.3 差异表达基因鉴定
RNA-seq结果表明,羔羊60日龄时,低蛋白水平组和正常蛋白水平组(LPL60 vs NPL60)差异表达基因有302个,表达上调基因167个,表达下调基因135个;61-90日龄,LPL组羔羊采食正常蛋白水平日粮30 d,LPL90组和NPL90组差异表达基因12个,表达上调基因8个,表达下调基因4个。本次试验共鉴定得到23个差异表达基因参与机体抗氧化调节过程(图2,表3)。
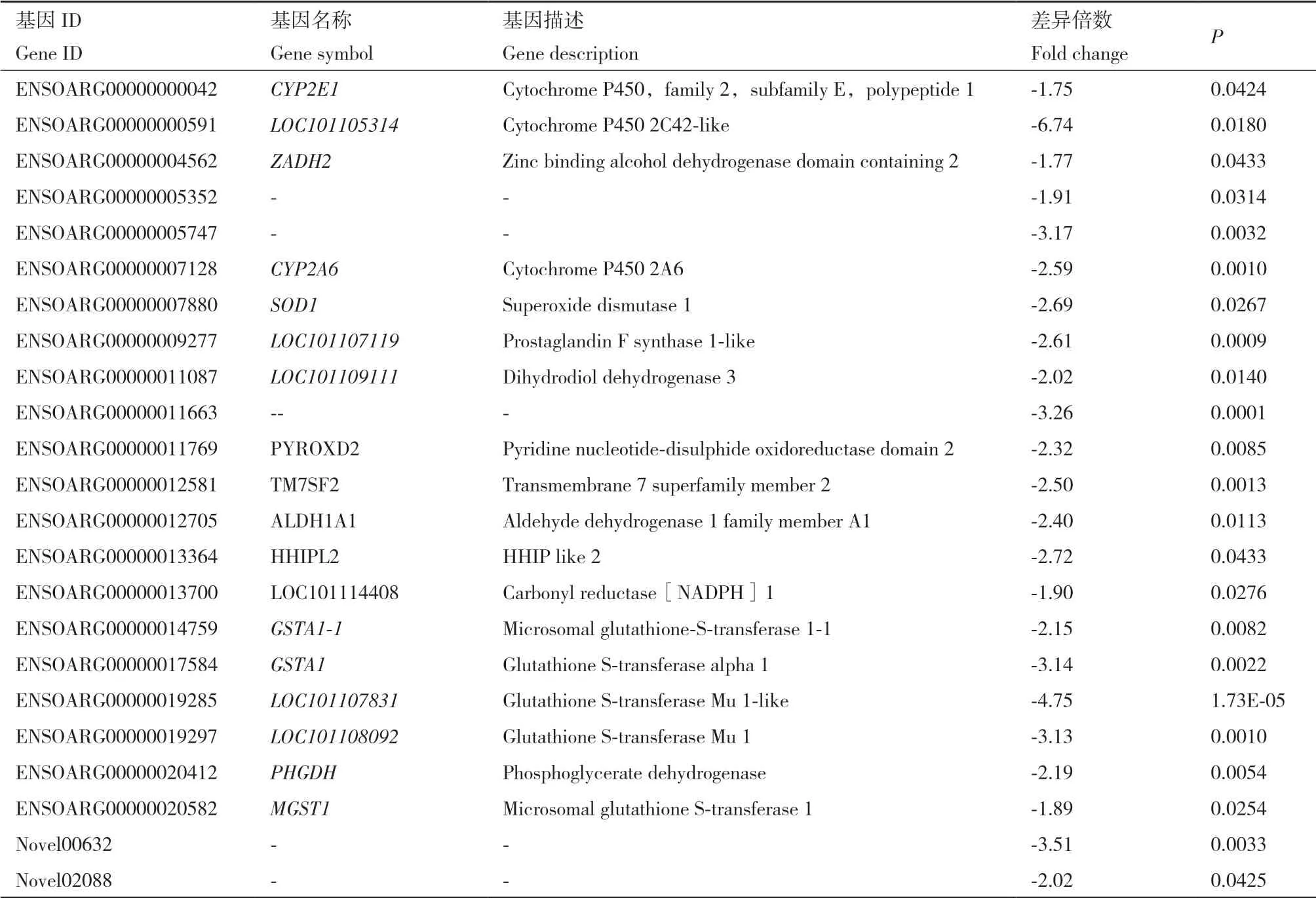
表3 参与抗氧化过程的差异表达基因Table 3 Different expressed genes related to antioxidation process

图2 差异表达基因聚类热图Fig.2 Heat map analysis of different expressed genes
2.4 差异表达基因GO分析
GO(gene ontology)是一个标准化的基因功能分类体系,包括基因参与的生物学过程(biological process,BP),细胞组分(cellular component,CC)和分子功能(molecular function,MF)3个部分。通过GO功能显著性分析发现,60日龄差异表达基因显著富集的主要条目如图3所示。差异表达基因显著富集的生物学过程包括血管发育(GO:0001568),血管形态形成(GO:0048514),脉管系统发育(GO:0001944),血管生成(GO:0001525),血管生长因子信号途径(GO:0038084),细胞组分迁移调节(GO:0051270)和细胞迁移(GO:0016477);差异表达基因显著富集的分子功能条目包括血管内皮生长因子激活受体活性(GO:0005021),生长因子结合(GO:0019838),谷胱甘肽转移酶活性(GO:0004364)和跨膜受体蛋白激酶活性(GO:0019199)。其中,与机体抗氧化相关条目氧化还原酶活性(GO:0016491),谷胱甘肽转移酶活性(GO:0004364)和氧化还原过程(GO:0055114)显著下调(表4)。LPL组羔羊采食正常蛋白水平日粮30 d后,没有显著富集的GO条目。

表4 抗氧化相关基因及GO条目Table 4 GO terms and genes related to antioxidation process

图3 差异表达基因GO分析Fig.3 GO analysis of different expressed genes
2.5 KEGG代谢通路富集分析
对差异表达基因进行KEGG pathway 代谢通路显著性富集分析发现,60日龄时,差异表达基因参与的生物学途径主要包括化学致癌途径,P450介导的外源性物质代谢途径,谷胱甘肽代谢,甘氨酸、丝氨酸和苏氨酸代谢途径,类固醇生物合成途径和细胞因子受体相互作用途径等。LPL组羔羊采食正常蛋白水平日粮30 d后,酪氨酸代谢途径呈现显著下调(表5)。
2.6 荧光定量PCR验证RNA-Seq结果
为了进一步验证RNA-Seq结果的准确性,选取与抗氧化功能密切相关的4个不同的基因进行了qRT-PCR定量分析。对qRT-PCR与RNA-Seq结果进行分析,发现两者的表达趋势一致,说明RNASeq结果良好(图4)。
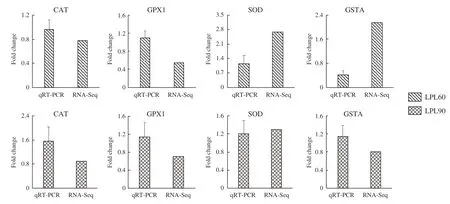
图4 RNA-Seq与qRT-PCR结果比较Fig.4 Comparison of results between RNA-Seq and qRT-PCR
3 讨论
选用双胞胎羔羊作为动物模型,能够最大程度的减少遗传背景造成的影响,更清晰的表明试验因素的作用。本研究选用双胞胎羔羊作为试验动物,通过RNA-seq技术共筛选得到差异表达基因302个;LPL组羔羊采食正常蛋白水平日粮30 d,LPL90组和NPL90组差异表达基因12个。
氧化应激是机体自由基生成增加或清除能力降低导致氧化系统和抗氧化系统失衡,自由基在体内积累而引起的氧化损伤过程[19]。前人研究证实,氧化应激能够降低动物生长性能[20],肌肉感官品质和嫩度降低[2],引发人和动物心血管疾病[21-22]。真核生物在代谢过程中,98%的氧通过细胞色素氧化酶系统还原成水并释放能量,极少量的氧还原成超氧根阴离子(O2ˉ)、羟自由基(OH)和过氧化氢(H2O2)等活性氧[23]。生理状态下,细胞内的抗氧化物质可以及时清除活性氧,使活性氧的清除和生成处于动态平衡过程中。细胞内的抗氧化物质包括还原型谷胱甘肽(glutathione)、还原型辅酶II(NADPH)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)[24]。本次试验共鉴定得到23个差异表达基因参与机体抗氧化调节过程。动物血清中的SOD具有清除自由基的能力,是体内重要的抗氧化酶[25],抗氧化系统受损则导致血液中SOD的活性降低[26]。RNA-seq结果表明,低蛋白水平羔羊肝脏组织SOD1基因的表达水平下调2.69倍,表明低蛋白日粮引起羔羊抗氧化功能下调。GO分析表明,低蛋白水平组羔羊参与氧化还原酶活性的基因呈现显著下调,破坏氧化还原反应过程。谷胱甘肽转移酶是催化谷胱甘肽结合反应的关键酶,催化具有亲电取代基的外源性化合物与内源的还原型谷胱甘肽反应,减少对机体造成的损害[27]。谷胱甘肽能够抑制自由基生成,降低氧化应激,缓解免疫抑制。GO和KEGG分析表明,谷胱甘肽转移酶活性降低,谷胱甘肽代谢途径减弱,谷氨酸盐合成谷胱甘肽减少,降低了机体的抗氧化作用。
本研究发现,低蛋白日粮引起羔羊细胞因子受体作用通路相关基因表达水平显著提高。细胞因子(cytokine)是细胞经刺激诱导产生的小分子可溶性蛋白,分为白细胞介素(IL)、干扰素(IFN)、肿瘤坏死因子家族(TNF)、集落刺激因子(CSF)和趋化因子(CF)等,对调节机体获得性免疫、血细胞生成和损伤组织修复等起到重要作用[28]。动物免疫反应包括Th1细胞分泌IFN、IL2、IL12和TNF参与的细胞免疫以及Th2细胞分泌的IL4、IL5、IL6等参加的体液免疫[29]。机体的抗氧化系统和免疫系统密不可分。免疫细胞对氧化应激非常敏感,因为免疫细胞细胞膜含有高浓度、对过氧化反应高度敏感的不饱和脂肪酸,因此免疫细胞受过量自由基刺激后免疫功能下降,进而影响免疫系统功能[30]。
4 结论
本研究采用RNA-seq技术鉴定得到蛋白质限制和补偿水平羔羊肝脏组织差异表达基因,通过GO和KEGG分析发现差异表达基因中抗氧化相关基因及其作用通路。日粮蛋白质限制引起差异表达基因中参与抗氧化相关的基因表达显著下调,降低了羔羊抗氧化能力,恢复日粮蛋白水平30 d,抗氧化基因表达随之恢复。

