利用细胞代谢组学探究TRPA1在胃癌中的影响作用
邓 蕊, 余苏云,吴媛媛,李晓曼,陈文星,2,王爱云,2,陆 茵,2
(南京中医药大学 1. 药学院,江苏省中药药效与安全性评价重点实验室,2. 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
胃癌已成为全球范围内第五大常见癌症及第三大癌症相关死亡原因[1],近2/3的患者最终面临死亡。目前癌症的诊断技术及治疗手段虽在不断发展,但胃癌患者的预后状况并没有得到显著改善,手术切除仍是胃癌患者预后最好的治疗方式[2]。此外,靶向治疗药物的开发也取得了一定的成效,如靶向人表皮生长因子受体2(HER2)的曲妥珠单抗(trastuzumab)及靶向血管内皮生长因子(VEGF)的雷莫芦单抗(ramucirumab),对实现精准治疗及个性化医疗意义重大。然而,这些疗法的治疗效果有限且对患者的生活质量有较大影响。因此,新型胃癌治疗靶点仍是目前研究的焦点。
近年来,瞬时受体电位(transient receptor potential,TRP)通道蛋白成为肿瘤治疗领域的一类“明星”治疗靶点[3]。生理情况下,TRP作为多种细胞内、外界环境信号的感受器,通过被温度或相应的配体激活后,介导Ca2+等阳离子进入细胞内调节生理活动。病理状态,包括在恶性肿瘤发展过程中,TRP蛋白存在异常表达现象,而这往往与肿瘤的发展进程有着密不可分的关系[4]。
TRPA1作为目前TRPA(ankyrin)亚家族中的唯一成员,能够被大蒜素(allicin)、肉桂醛(cinnamaldehyde)等化合物所激活。近年来研究证实,TRPA1的激活在前列腺癌、鼻咽癌的增殖、生长及转移过程起重要作用[5-6]。同时,Takahashi等[7]证明了TRPA1在浸润性导管乳腺癌组织中存在异常表达情况,其通过Ca2+依赖的抗凋亡途径促进肿瘤细胞的化疗耐受性。但关于TRPA1与胃癌发展进程的文章较为缺乏,因此,本研究从TRPA1表达情况与胃癌进程的相关性入手,初步探讨其在胃癌转移过程中的具体作用,并对其可能作用机制及潜在治疗药物进行探寻。
1 材料与方法
1.1 材料
1.1.1实验细胞 实验所用细胞株均为南京中医药大学中药药效与安全性评价重点实验室自存。所有细胞均由1640培养基(含10%FBS)培养基放置于恒温培养箱中进行培养。
1.1.2实验药品与试剂 RPMI 1640基础培养基粉末购于Gibco公司(货号:31800022);胎牛血清(fetal calf serum,FBS)购于Gibco公司(货号:10100-147);胰酶购于Amresco公司(货号:R223-01);Transwell小室购于Corning公司(货号:3422);结晶紫购于源叶生物科技有限公司(货号:B26890);CCK-8购于APExbio公司(货号:K1018);小豆蔻明(Cardaomin)购于源叶生物科技有限公司(CAS:19309-14-9, 货号:B21380);HC030031购于MCE公司(货号:HY-15064);TRPA1抗体购于爱博泰克生物科技有限公司(货号:A8568)。
1.1.3实验仪器 多功能酶标仪(Biotek, Synergy2);长时间细胞动态成像及数据分析系统(Essen, IncuCyte Zoom);电泳仪(Bio-Rad, 型号Mini protean 3 cell);凝胶成像系统(Bio-Rad, 型号ChemiDoc XRS+);梯度PCR仪(Applied Biosystems, 型号Cycler);荧光定量PCR仪(Applied Biosystems, 型号7500);荧光倒置显微镜(Zeiss, 型号AX10)
1.2 实验方法
1.2.1Kaplan-Meier plotter数据库的应用 ① 打开Kaplan-Meier plotter在线数据库(https://kmplot.com/analysis/); ②进入胃癌患者相关生存曲线分析界面;③在“Affy id/ Gene symbol”栏输入“TRPA1”,选择Affmetrix ID为208349_at的样本进行分析;④点击“Draw Kaplan-Meier plot”,获取TRPA1基因表达水平与胃癌患者生存期的相关性信息。
1.2.2CCK-8检测MKN-45细胞活力 将MKN-45细胞培养至细胞融合度90%左右,以每孔7×103个的密度接种于96孔板中,每组设置6个复孔,培养24 h。设计溶剂对照组、小豆蔻明(1、2、4、8、16、32、64、128 μmol·L-1),继续培养24 h后,每孔加入10 μL CCK-8溶液孵育2 h,之后利用酶标仪在450 nm处测量吸光度值,实验重复3次。
1.2.3长时间细胞动态成像及数据分析 以每孔7×103个细胞的密度将MKN-45细胞接种于96孔板中,待细胞贴壁后,给予不同浓度HC030031(0.5、1、2、4、8、16、32、64 μmol·L-1),设置空白对照及溶剂对照,每组设置6个复孔,随后将培养板放至长时间动态成像系统中,每隔1 h进行全板扫描,共扫描72次,成像结束后利用系统进行图像处理。
1.2.4Transwell检测MKN-45细胞迁移能力 利用无血清1640培养基处理MKN-45细胞过夜后,用胰酶消化并分别使用含不同浓度小豆蔻明(2、4、8 μmol·L-1)及等体积含DMSO的培养基对细胞进行重悬,以每孔1×105个细胞密度接种100 μL于上室,下室加入800 μL含30%FBS培养基,继续培养24 h,取出小室,用4%多聚甲醛固定10 min,再用0.1%结晶紫染色15 min,PBS清洗干净并风干后拍照。
1.2.5化合物3D结构下载 登录美国国家生物技术信息中心 (NCBI) 数据库 (https://www.ncbi.nlm.nih.gov/),在下拉菜单中选择PubChem Compound,以cardamonin为关键词进行检索,选择CID号为641785的化合物进行下载,并以SDF格式保存。
1.2.6蛋白质3D结构下载 登录Protein Data Bank蛋白质结构数据库RCSB PDB (http://www1.rcsb.org/),以TRPA1为关键词进行检索,选择PDB号为6PQO的蛋白质进行下载,以PDB格式进行保存。
1.2.7成分-靶点分子对接 将已下载的TRPA1蛋白质结构导入SYBYL-X 2.0,使用Automatic模式寻找蛋白中的最佳结合口袋。随后导入cardamonin结构,并勾选“Perform CScore Calulations”项,使用Total Score及CScore进行评价,筛选出CScore≥4且Total Score最高的结合模式。
1.2.8Western blot检测TRPA1蛋白水平表达情况
1.2.8.1检测胃癌细胞与正常胃上皮细胞中TRPA1表达情况 将细胞分别接种于六孔板中,细胞生长至融合度到80%-90%时,提取蛋白,将蛋白统一至25 μg依次上样,电泳、转印等步骤后,一抗4 ℃孵育过夜,1×TBST洗涤3次,二抗室温孵育1.5 h,1× TBST洗涤3次。最后用化学发光法在凝胶系统中进行曝光显影,对结果进行半定量分析,实验重复3次。
1.2.8.2检测小豆蔻明对MKN-45细胞TRPA1蛋白表达水平影响 将人源胃癌细胞株MKN-45接种于6孔板中,细胞生长至融合度至70%左右时,每孔分别加入不同浓度的小豆蔻明(2、4、8 μmol·L-1)及等体积含DMSO的培养基孵育24 h,随后按“1.2.8.1”所述操作进行检测。
1.2.9GC-MS代谢产物分析
1.2.9.1色谱条件 色谱柱:HP-5毛细管色谱柱(30 m x 0.25 mm,0.25 μm, Agilent公司);载气:高纯氦气;流量:1.0 mL·min-1;分流比:20 ∶1;进样量:1 μL;进样口温度:250 ℃;检测器温度:280 ℃;升温程序:初始温度为60 ℃,保持1 min,随后以20 ℃·min-1升温至320 ℃,维持5 min。
1.2.9.2质谱条件 离子源:电子电离源(EI);电离能量:70 eV;离子源温度:300 ℃;传输线温度:300 ℃;质谱扫描范围:m/z50-550。
1.2.9.3样本收集 胃癌细胞与正常胃上皮细胞代谢差异分析:取对数生长期、生长状态良好的GES-1,AGS,BGC-823,MGC-803和MKN-45细胞,以PBS洗涤细胞3次后,用刮刀刮取培养皿中的细胞,4 ℃离心(1 200 r·min-1,10 min),收集细胞沉淀,保存于液氮中,用于细胞内代谢组学分析。每种样本平行6份。
1.2.9.4样品前处理 按照参考文献[8]方法处理细胞,冻干的细胞裂解物加60 μL的0.1%甲酸水溶液,使其复溶,4 ℃离心(13 000 r·min-1,10 min),取上清于液相小瓶中。以混合各自等分试样的样品为质控样本,空白为提取溶剂。
1.2.9.5数据处理与分析 将采集的GC-MS原始数据文件导入MS-DIAL软件中进行色谱峰提取和物质鉴定,得到包含代谢物名称、保留时间、质荷比及峰高三维信息数据集,归一化后数据导入SIMCA-P 13.0软件进行偏最小二乘法判别分析(PLS-DA),以VIP值>1,P值<0.05为条件,筛选正常人胃粘膜上皮细胞(GES-1)与四种不同胃癌细胞(AGS,BGC-823,MGC-803,MKN-45)的差异性代谢物。运用MetaboAnalyst 4.0(http://www.metaboanalyst.ca/)网站进行代谢通路分析。
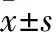
2 结果
2.1 TRPA1表达水平与胃癌患者生存期呈负相关对TRPA1与胃癌患者生存期相关性进行分析(Fig 1A-C),结果发现,胃癌患者总生存期(overall survival,OS),首次进展生存期(first progression,FP),再进展生存期(post progression survival,PPS)均与TRPA1表达呈负相关生存曲线,由此提示我们,TRPA1与胃癌进程密切相关,其表达水平升高可能对胃癌发生发展起促进作用。

Fig 1 The mRNA expression of TRPA1 in gastric cancer patients significantly negatively correlated with their survival
2.2 TRPA1在胃癌细胞中异常高表达基于上述数据库统计结果,进一步通过体外实验对胃正常上皮细胞(GES-1)及多株胃癌细胞(MGC-803、MKN-45、BGC-823、AGS)TRPA1表达水平进行检测(Fig 2)。由于TRPA1是一种瞬时离子通道蛋白,其蛋白层次表达水平指示着蛋白功能的发挥。因此,我们使用Western blot 对不同细胞间TRPA1蛋白水平的表达进行了检测。结果显示,与正常胃上皮细胞相比,胃癌细胞TRPA1的表达水平明显更高。其中,MKN-45细胞TRPA1蛋白表达水平最高。

Fig 2 TRPA1 overexpressed in gastric cancer cells
2.3 HC-030031抑制胃癌细胞迁移作为一类瞬时离子通道蛋白,TRPA1的激活能够介导以Ca2+为主的一系列阳离子流入细胞,进而产生一系列下游的生理及病理效应。同时,上述研究结果均表明,胃癌中存在TRPA1异常高表达现象,那么这种异常表达现象是否与胃癌发展进程存在一定相关性?于是,我们利用选择性TRPA1抑制剂HC-030031,对TRPA1与胃癌转移之间的相关性进行探索。首先,我们利用长时间动态活细胞成像设备在无需标记及不影响细胞活动的状态下对MKN-45细胞进行长时间观察成像(Fig 3A,B),选择不影响MKN-45细胞增殖活力的4、8 μmol·L-1进行体外验证。利用Transwell从垂直角度验证TRPA1与胃癌迁移的关系,如Fig 3C所示,使用HC-030031处理细胞后,细胞的垂直迁移能力受到了明显抑制,且与给药剂量存在剂量依赖性。
2.4 小豆蔻明与TRPA1的结合潜力为进一步从抗肿瘤中药中筛选能够有效抑制TRPA1的化合物,我们利用虚拟筛选对TRPA1的潜在抑制剂进行寻找。文献检索过程中发现,小豆蔻明能够选择性抑制TRPA1介导的Ca2+内流,并具有浓度依赖性[9]。进而,我们利用分子对接技术对小豆蔻明与TRPA1的结合能力进行研究,对接结果如Fig 4所示,小豆蔻明能够有效地嵌入TRPA1蛋白的活性腔结合口袋中,且CSCORE评分为满分5分,表明该对接结果一致性良好。由此,小豆蔻明与TRPA1蛋白的结合能力较强,并可能抑制TRPA1功能的发挥。
2.5 小豆蔻明减少胃癌细胞TRPA1蛋白表达为探究小豆蔻明对胃癌细胞中TRPA1表达的影响,我们选用TRPA1表达水平相对最高的MKN-45细胞进行验证。给予MKN-45细胞不同浓度的小豆蔻明(2、4、8 μmol·L-1)刺激24 h后,对细胞总蛋白进行提取,并对细胞TRPA1蛋白表达进行检测。结果显示(Fig 5),一定浓度范围内,小豆蔻明能够剂量依赖性抑制TRPA1蛋白表达。说明小豆蔻明在抑制TRPA1功能发挥的同时,具有抑制TRPA1功能蛋白表达的作用。
2.6 小豆蔻明抑制胃癌细胞迁移CCK-8结果显示 (Fig 6A),小豆蔻明在一定浓度范围内(1-16 μmol·L-1)对MKN-45细胞的增殖活力没有影响。由此,选择2、4、8 μmol·L-1的小豆蔻明进行Transwell实验,探究小豆蔻明对MKN-45细胞迁移能力的影响。结果显示 (Fig 6B, C),使用小豆蔻明对细胞进行处理后,与TRPA1抑制剂HC-030031相似,细胞的迁移能力被明显抑制了,且这种抑制作用存在剂量依赖性。
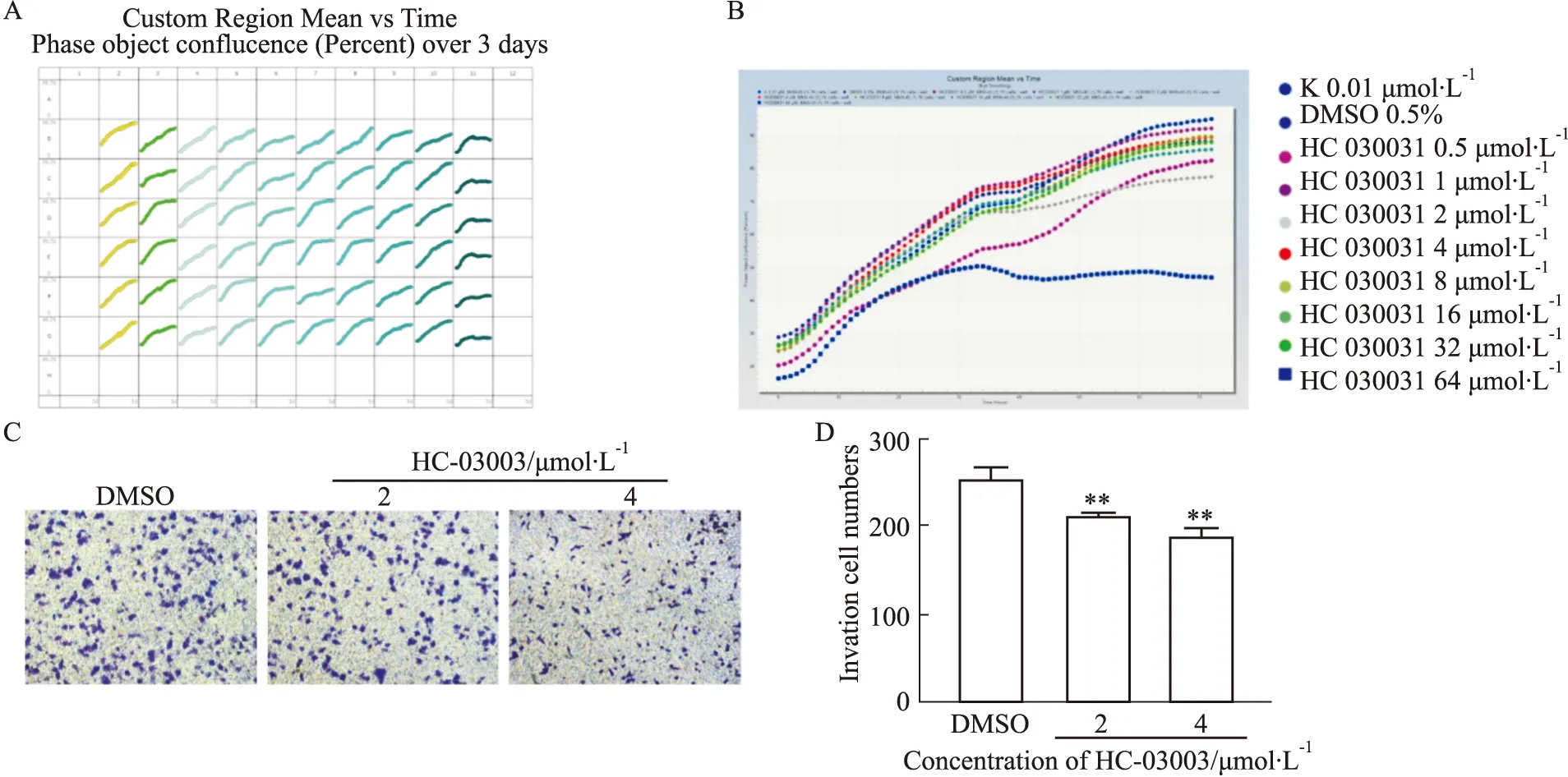
Fig 3 Metastasis of MKN-45 cells in vitro inhibited by HC-030031
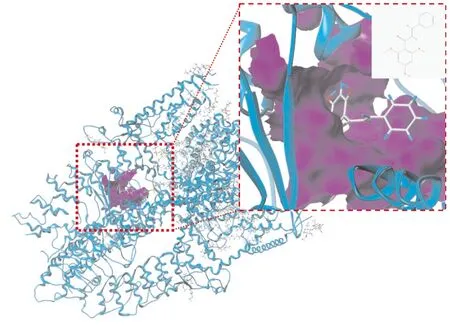
Fig 4 Docking analysis of TRPA1 and cardamonin
2.7 细胞代谢轮廓的分析为进一步探究小豆蔻明抑制胃癌细胞转移的内在机制,GC-MS技术被用于探究正常细胞与胃癌细胞代谢产物差异,以及小豆蔻明对差异代谢物的影响。从细胞样本中共鉴定得到45个小分子代谢物,以计算各代谢物在QC样本中峰面积的RSD值,超过90%的化合物RSD值小于30%,表明实验操作及仪器稳定,数据可靠。结果见Fig 7A。利用SIMCA-P 13.0软件构建PLS-DA模型。得分图如Fig 7B所示,模型参数为R2X=0.921,R2Y=0.907,Q2=0.829,表明所建模型稳定可靠。结果显示,GES-1样本与4种胃癌细胞样本区别明显,且相隔较远,表明其正常胃上皮细胞与胃癌细胞中代谢物存在明显差异。
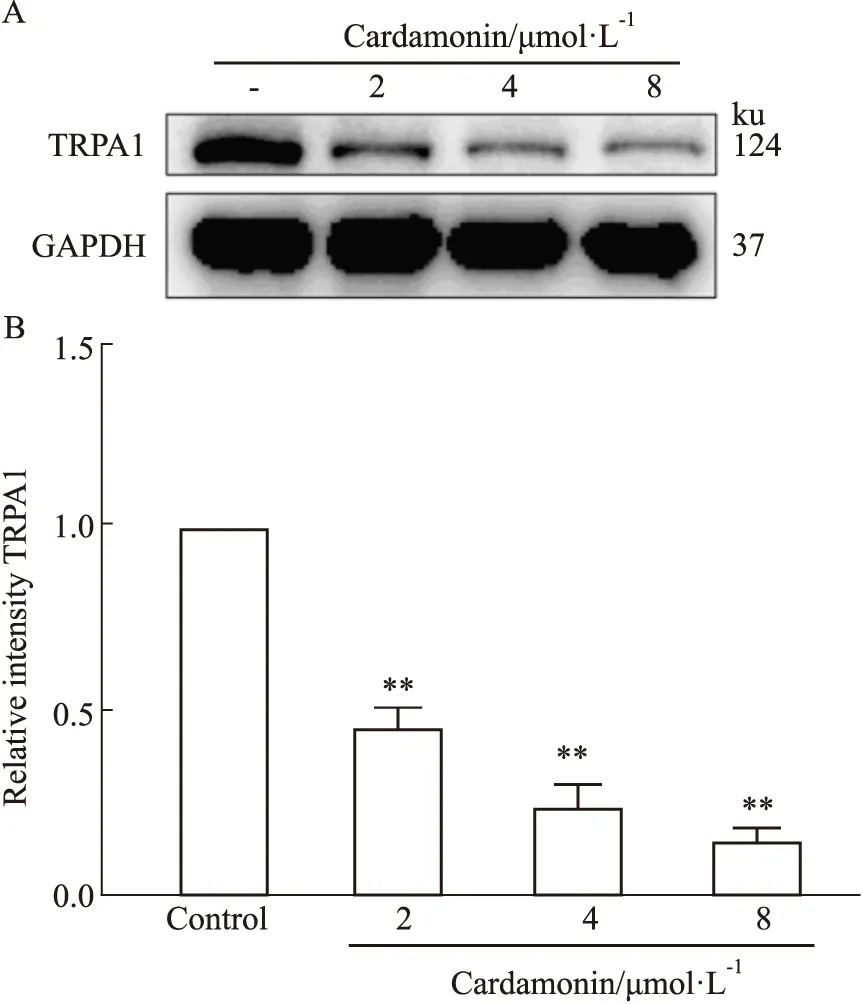
Fig 5 Expression of TRPA1 protein inhibited by cardamonin
2.8 细胞代谢差异产物的鉴定将正常人胃粘膜上皮细胞 (GES-1) 分别与4种胃癌细胞两两比较,对筛选出的差异代谢物进行鉴定,分别得到10种(GES-1 vs AGS),7种(GES-1 vs BGC-823),3种(GES-1 vs MGC-803)和7种(GES-1 vs MKN-45)代谢物。对上述代谢物数据归一化处理后进行聚类分析,结果表明正常细胞与胃癌细胞的代谢产物差异较大,见Fig 8。对差异代谢产物进行分析发现,正常细胞与4种胃癌细胞有2个共有差异代谢物:天冬酰胺 (L-Asparagine) 和肌醇 (myo-inositol),且胃癌细胞中天冬酰胺含量均增加,肌醇含量均出现减少。由此,与天冬酰胺及肌醇相关代谢途径可能在诱导胃癌进程中起着重要作用。

Fig 6 Metastasis of MKN-45 cells in vitro inhibited by cardamonin
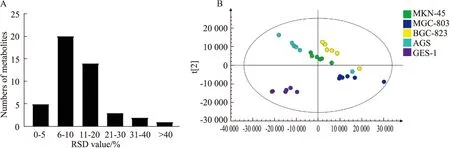
Fig 7 Analysis of differential metabolites after cardamonin treatment

Fig 8 Heatmap visualization of different metabolites of GES-1 and gastric cancer cells
2.9 小豆蔻明对共有细胞代谢差异产物的影响提取正常细胞 (GES-1)、胃癌细胞 (MKN-45)以及给药后胃癌细胞(MKN-45)中天冬酰胺(L-Asparagine)和肌醇(myo-inositol)的峰面积。以正常细胞代谢水平为基准,给以8 μmol·L-1小豆蔻明后,天冬酰胺和肌醇的代谢物水平均有所回调。见Fig 9。
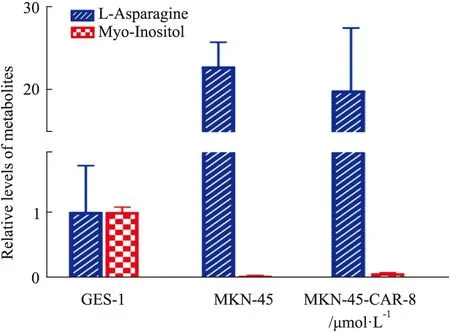
Fig 9 Relative levels of L-asparagine and myo-inositol between GES-1, MKN-45 and MKN-45-CAR-8 μmol·L-1
2.10 相关代谢通路富集分析将上述鉴定得到的差异代谢产物导入MetaboAnalyst 4.0网站中进行代谢通路富集分析,以影响值>0.1为条件,筛选得到9条相关代谢通路,见Fig 10。包括苯丙氨酸、酪氨酸和色氨酸生物合成;谷氨酰胺和D-谷氨酸代谢;苯丙氨酸代谢;甘氨酸、丝氨酸和苏氨酸代谢;丙氨酸、天冬氨酸和谷氨酸代谢;氨酰基-tRNA的生物合成;酪氨酸代谢;磷酸肌醇代谢;精氨酸生物合成等代谢通路,其中圆点大小表示该代谢通路的重要程度。

Fig 10 Metabolic pathway enrichment of different metabolites of GES-1 and gastric cancer cells
3 讨论
小豆蔻明(cardamonin,CAR)为存在于姜科山姜属植物草豆蔻(AlpiniakatsumadaiHayata)干燥近成熟种子中的一种黄酮类化合物。目前研究证实,小豆蔻明在多种疾病中的潜在治疗作用已得到广泛研究,包括疼痛,炎症性肠炎及癌症在内的多种疾病类型[10]。目前,Wang等[11]在胃癌细胞AGS中证实,小豆蔻明通过抑制LncRNA-PVT1的表达,下调p-STAT3水平,并阻断STAT3的激活,以诱导AGS细胞凋亡。同时,小豆蔻明具有剂量依赖性抑制TRPA1介导的钙内流作用。考虑到TRPA1的异常表达情况与肿瘤进程的相关性,我们提出科学假说,小豆蔻明抑制胃癌发展进程作用的发挥是否跟TRPA1有关,其具体机制又是怎样?进一步文献检索后我们发现,小豆蔻明能够通过调节肿瘤细胞代谢抑制乳腺癌进程[12],促使我们思考,正常细胞与胃癌细胞是否存在代谢产物的差异,通过靶向这种差异是否可能逆转肿瘤进程?
本实验结果表明,TRPA1在胃癌细胞中存在异常高表达现象,并与胃癌患者不良预后呈正相关。体外实验发现,相比正常胃上皮细胞,胃癌细胞中TRPA1蛋白表达水平更高,且具有促进胃癌细胞迁移能力的作用,TRPA1抑制剂的给予逆转了TRPA1的促转移作用。同时,分子对接结果显示,小豆蔻明可能作为一种潜在的TRPA1抑制剂,呈现出与TRPA1抑制剂相似的抑制肿瘤转移作用。进一步利用细胞代谢组学对不同细胞的代谢差异产物进行分析,挖掘出天冬酰胺及肌醇相关通路可能为小豆蔻明抑制TRPA1介导的胃癌转移的重要途径。
本研究使用GC-MS技术,对正常胃上皮细胞及多株胃癌细胞系的代谢产物进行检测及分析,结果发现,与正常胃上皮细胞相比,胃癌细胞代谢产物出现显著变化,且多株胃癌细胞代谢产物存在交集,即胃癌细胞中天冬酰胺的产生均增加,而肌醇的产生均出现下降趋势。结合TRPA1在胃癌中的异常表达现象及小豆蔻明对胃癌细胞转移的抑制作用,我们猜想,天冬酰胺及肌醇相关的代谢通路是小豆蔻明通过TRPA1发挥抑制胃癌转移的可能途径。
上世纪80年代,已有文章证实,急性粒细胞型白血病细胞无法合成天冬酰胺,而依赖于正常细胞中合成的天冬酰胺,为肿瘤细胞供应能量,由此,靶向循环系统中的天冬酰胺能够有效杀死肿瘤细胞[13]。而肌肉肌醇 (myo-inositol) 是人体中含量最高的一种肌醇,占全部肌醇含量的90%以上[14],近年来,由于其在多种疾病包括肿瘤发生发展过程中的潜在治疗作用被广泛报道,受到了人们的重视[15]。我们证实,胃癌细胞中存在肌醇水平下降而天冬酰胺水平上升的现象。说明天冬酰胺或许是肿瘤细胞与正常细胞的标志性代谢差异产物,靶向天冬酰胺药物的开发可能对于临床肿瘤的治疗起着一定的参考意义,而肌醇水平的恢复或许也是治疗肿瘤的可能途径。进一步对给予小豆蔻明前后MKN-45细胞差异代谢产物进行检测,发现小豆蔻明在一定程度上具有恢复肌醇水平并抑制天冬酰胺的作用。靶向天冬酰胺及肌醇或许是小豆蔻明发挥抑癌作用的重要途径,有待进行更深入地研究。
代谢组学作为一门研究内源性代谢小分子化合物含量变化的新兴技术,能够用以分析潜在肿瘤标志物,扩充基因组学及蛋白组学的研究结果。本研究基于GC-MS代谢组学手段,对正常胃上皮细胞及胃癌细胞的差异代谢产物进行检测,未来还可利用核磁共振(nuclear magnetic resonance,NMR)及液相色谱-质谱法等技术手段对各类恶性肿瘤的代谢产物进行代谢谱解析,构建系统精准的癌细胞代谢产物库。此外,给予药物刺激后再次检测细胞内代谢产物差异,能够更加直观的揭示药物对细胞内代谢网络的调控作用[16],对于抗肿瘤药物的开发具有重要意义。进一步联合蛋白组学与基因组学共同分析,并应用于肿瘤的诊断、治疗甚至预防过程,有益于指导临床构建个体化治疗方案,为精准医疗的实现提供技术手段。

