丹参酮ⅡA通过调控Grp78/caspase-12通路改善小鼠内质网应激性肝损伤
李晓明,常 伟,刘 浩
(蚌埠医学院药学院,安徽 蚌埠 233030)
急性肝损伤是所有肝脏疾病共有的病理过程,其病因较为复杂[1]。大量研究发现,外源性物质诱发的肝细胞内质网应激与多种肝病的发生关系密切,也是急性肝损伤发生的新的机制[2]。本课题组前期利用衣霉素成功构建了内质网应激性急性肝损伤小鼠模型,为急性肝损伤机制研究提供了新的模型,但相关治疗药物仍缺乏研究[3]。丹参酮是一种临床常用的抗炎消菌药,其主要含有丹参酮Ⅱ A、隐丹参酮、丹参酮Ⅰ等活性成分[4]。许多基础和临床研究表明,丹参酮多种活性成分对急性肝损伤均具有一定的预防和治疗作用,如丹参酮Ⅱ A对利福平(rifampicin,RIF)、雷公藤甲素(triptolide, TP)、4-羟基壬烯酸(4-hydroxynonenal,4-HNE)等药物诱导的多种急性肝损伤模型均具有较好的肝保护作用[5-9]。同时也有研究发现,丹参酮Ⅱ A对缺血/再灌注性肝损伤以及α-萘异硫氰酸酯(α-naphthyl isothiocyanate,ANIT)诱导的肝内胆汁淤积性肝损伤保护作用较好[10-11],但对衣霉素诱导的内质网应激性急性肝损伤的作用尚未见报道。为此,本研究通过建立衣霉素诱导的小鼠内质网应激性急性肝损伤模型,考察丹参酮Ⅱ A对衣霉素诱导小鼠急性肝损伤的保护作用及其部分机制,为临床合理使用丹参酮Ⅱ A提供参考依据。
1 材料与方法
1.1 化学试剂衣霉素,购自美国Sigma公司,纯度98%,每瓶10 mg,批号:654380-10MG;丹参酮Ⅱ A购自上海纯优生物科技有限公司,纯度≥98%,每瓶10 mg,批号:568-72-9-10MG;联苯双酯滴丸(bifendate, Bif)购自万邦德制药集团股份有限公司,每丸含联苯双酯1.5 mg,批号:A02J180112。丙氨酸氨基转移酶(ALT,批号:mI058577)、天门冬氨酸氨基转移酶(AST,批号:mI016824)、超氧化物歧化酶(SOD,批号:mI643059)、丙二醛(MDA,批号:mI016824)等ELISA试剂盒均购自上海酶联生物科技有限公司。葡萄糖调节蛋白78抗体(glucose regulated protein 78 ku,Grp78,鼠抗兔单克隆抗体,货号:AF5366)购自江苏Affinity Biosciences(LTD)公司;门冬氨酸特异性半胱氨酸蛋白酶12抗体(cysteine aspartic acid specific protease-12,caspase-12,鼠抗兔单克隆抗体,货号:55238-1-AP)、caspase-3抗体(鼠抗兔单克隆抗体,货号:19677-1-AP)等抗体均购自美国Proteintech公司;B淋巴细胞瘤-2基因抗体(B-cell lymphoma 2,Bcl-2,鼠抗兔单克隆抗体,货号:3498S)、Bcl-2相关X蛋白抗体(Bcl-2-associated X protein,Bax,鼠抗兔单克隆抗体,货号:2774S)等抗体均购自美国cell signaling technology(CST)公司;Grp78和caspase-12引物均购自生工生物工程(上海)股份有限公司;TUNEL凋亡检测试剂盒(显色法,货号:QIA33)购自美国Merck公司;实时定量PCR试剂盒购自贝克曼库尔特商贸(中国)有限公司。
1.2 主要仪器IX-73荧光倒置显微镜(日本Olympus公司);倒置显微镜图像采集系统(日本Olympus公司);X1R低温高速离心机(美国赛默斯世尔公司);MILLI-Q型纯水机(武汉优普纯水设备有限公司);DYY-6C型电泳仪(北京六一);酶标仪(美国BioTke公司); Mini-Protena电泳系统(美国伯乐公司);CKX41-A32PH倒置显微镜(日本奥林巴斯公司);凝胶成像系统(美国biorad公司)。
1.3 动物SPF级昆明种小鼠,♂,(18-22) g,5-6 周,由济南朋悦实验动物繁育有限公司提供,合格证号:SCXK(鲁)2019-0003。适应性饲养3 d,自由饮食饮水,维持光照和黑暗各12 h,温度20 ℃-25 ℃,相对湿度(50±5)%。本研究经蚌埠医学院实验动物中心和伦理委员会批准。
1.4 动物分组及造模将60只小鼠,随机分为6组:正常组、模型组、阳性药组(Bif,150 mg·kg-1)、丹参酮Ⅱ A低剂量组(10 mg·kg-1)、中剂量组(20 mg·kg-1)、高剂量组(40 mg·kg-1),每组10只。用药组小鼠按0.1 ml/10 g分别灌胃给予相应剂量丹参酮Ⅱ A或联苯双酯,正常组和模型组同法给予等量生理盐水,1次/d,连续7 d。所有小鼠在末次给药后禁食10 h,除正常组外,其余小鼠均单次灌胃给予衣霉素(1 mg·kg-1)进行造模[3],再禁食12 h。称体质量,眼眶静脉丛采血,静置30 min后,离心(4 ℃,3 000 r·min-1×20 min),保留上清用于AST、ALT等生化指标检测;颈椎脱臼处死小鼠,取肝脏、脾脏、胸腺称质量,计算内脏指数 [内脏指数=肝脏/脾脏/胸腺质量/小鼠体质量],剪取肝脏相同部位制备组织匀浆和蛋白上样样品分别用于MDA、SOD含量以及Grp78、caspase-12、caspase-3、Bax、Bcl-2等蛋白水平测定,剩余肝脏置于10%甲醛中固定保存,用于组织病理学、TUNEL染色和免疫组化检测。
1.5 小鼠血清ALT、AST和肝组织SOD、MDA检测严格按试剂盒说明书的操作,采用赖氏法测定血清ALT、AST活性和肝组织匀浆(按组织块:生理盐水=1 ∶9加入到匀浆器中,在冰上研磨,制备成10%肝匀浆)中SOD、MDA水平。
1.6 小鼠肝组织病理形态学检查取肝左叶组织,10%甲醛固定,经乙醇脱水、二甲苯透明、石蜡包埋、5 μm连续切片、常规HE染色、中性树脂封片后,光学显微镜下观察肝组织病理学变化。
1.7 小鼠肝组织免疫组化取肝左叶组织,10%甲醛固定,石蜡包埋、4 μm连续切片,60 ℃温箱烘干,用抗原修复液(柠檬酸缓冲液)修复15 min,3% H2O2室温避光孵育15 min,再分别加入抗 Grp78 抗体(1 ∶200)、抗 caspase-12 抗体(1 ∶200) 4 ℃孵育过夜,二抗室温孵育1 h,加入SABC 室温反应 30 min,DAB 显色,苏木精复染,封片,显微镜下观察并拍片。
1.8 小鼠肝组织TUNEL染色充分脱蜡和水化,利用蛋白酶 k进行细胞通透10-30 min,加入TUNEL 反应液37 ℃反应1 h,加入DAB反应10 min,PBS 的充分清洗 5次,封片,显微镜下观察并拍片。
1.9 Western blot检测每组随机取6块肝组织测定相关蛋白的表达量。剪取50 mg左右肝组织到2 mL玻璃匀浆器内,同时加入1 mL 蛋白裂解液,于冰上匀浆 5 min 至肉眼看不见纤维,冰上裂解30 min,转移入预冷的1.5 mL Ep 管中,4 ℃,12 000×g离心 20 min,取上清,用BCA法测定蛋白质浓度,加入上样缓冲液。取20 μg样品蛋白经 SDS-PAGE 转移电泳、抗体免疫、ECL 显影、曝光等步骤检测Grp78、caspase-12、caspase-3、Bax、Bcl-2 蛋白表达情况(GADPH 做内参)。
1.10 实时定量 PCR(RT-PCR)RT-PCR 检测肝组织中Grp78、caspase-12 mRNA 表达变化,提取肝脏组织总RNA,反转录成 cDNA,以 cDNA 为模板进行扩增,检测 mRNA 表达量。引物序列如下:GRP78 正义链5′-ATGATGAAGTTCACTGTGGTGG-3′,反义链 5′-CTGATCGTTGGCTATGATCTCC-3′。caspase-12正义链5′-TGGCCCATGAATCACATCTAAT-3′ ,反义链5′-TGGACAAAGCTTCAGTGTATCT-3′。
2 结果
2.1 丹参酮Ⅱ A对衣霉素诱导的急性肝损伤小鼠血清ALT、AST和肝组织匀浆SOD、MDA的影响与正常组相比,模型组小鼠血清ALT、AST和肝组织匀浆MDA活性明显升高,SOD水平明显下降。与模型组相比,丹参酮Ⅱ A(20、40 mg·kg-1)和Bif(150 mg·kg-1)均能明显降低小鼠ALT、AST和MDA活性、升高SOD水平,差异有显著性(均P<0.05或P<0.01),见Tab 1。

Tab 1 Effect of tanshinone ⅡA on ALT, AST, SOD and MDA in tunicamycin-induced mice n=10)
2.2 丹参酮Ⅱ A对衣霉素诱导的急性肝损伤小鼠肝脏、脾脏、胸腺指数的影响与正常组相比,衣霉素模型组小鼠的肝、脾及胸腺指数均明显升高。与模型组相比,丹参酮Ⅱ A不同剂量和Bif均能明显降低衣霉素升高的小鼠肝、脾及胸腺指数,见Tab 2。

Tab 2 Effect of tanshinone ⅡA on liver, spleen, thymus index in liver of tunicamycin-induced mice n=10)
2.3 丹参酮Ⅱ A对急性肝损伤小鼠肝脏病理损伤和肝细胞凋亡的影响正常小鼠肝组织中肝小叶结构清晰,肝细胞索由中央静脉向四周整齐排列(Fig 1A),肝组织细胞凋亡较少(Fig 1B),而灌胃衣霉素后小鼠肝小叶结构发生异常,细胞索结构紊乱,间质间可见较明显的炎细胞浸润和大量肝细胞凋亡。丹参酮Ⅱ A(10、20、40 mg·kg-1)和Bif(150 mg·kg-1)均能明显减轻衣霉素诱导的炎细胞浸润、细胞索紊乱和肝细胞凋亡(Fig 1)。
2.4 免疫组化和RT-PCR结果镜下可见阳性染色的细胞呈棕褐色,正常组小鼠肝组织内Grp78(Fig 2A)和caspase-12(Fig 2B) 蛋白和mRNA均表达较少,诱发急性肝损伤后,肝组织内 Grp78和caspase-12的蛋白和mRNA表达明显增多,且主要位于受损肝组织部位。丹参酮Ⅱ A干预后肝组织内Grp78和caspase-12蛋白和mRNA表达明显减少(Tab 3,Fig 2)。

Fig 1 Effect of tanshinone ⅡA on pathological changes of liver of tunicamycin-treated mice (scale bar=50 μm)

Tab 3 Level of Grp78, caspase-12 mRNA in liver of tunicamycin-treated mice n=10)
2.5 Western blot结果与正常组相比,模型组Grp78、caspase-12、caspase-3、Bax表达明显增加,Bcl-2明显减少。丹参酮Ⅱ A干预后肝组织内Grp78、caspase-12、caspase-3、Bax表达水平明显减少,Bcl-2明显增加(Fig 3A, 3B)。

Fig 2 Effect of tanshinone ⅡA on Grp78 and caspase-12 protein expression in liver of tunicamycin-treated mice (scale bar=50 μm)
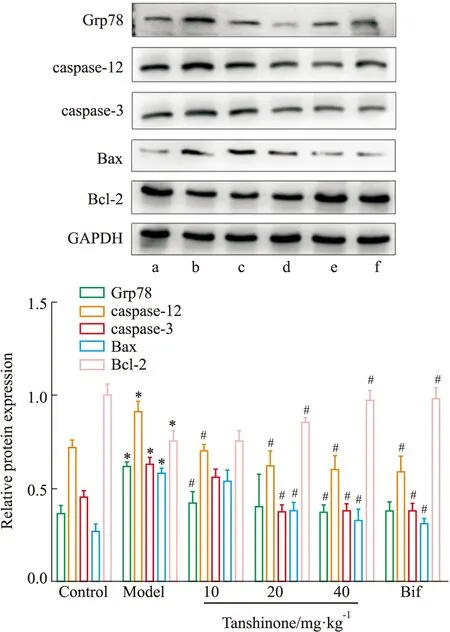
Fig 3 Effect of tanshinone ⅡA on Grp78, caspase-9, caspase-3, Bax and Bcl-2 protein levels in liver of tunicamycin-treated mice
3 讨论
内质网(endoplasmic reticulum,ER)是真核细胞蛋白质合成、钙离子贮存以及脂质生成的主要场所,是维持细胞正常功能的重要细胞器,当细胞稳态改变时会干扰内质网功能而引起内质网应激(endoplasmic reticulum stress,ERS)[12]。ERS是真核细胞的一种自我保护机制,在ERS早期阶段细胞可对抗不良刺激,恢复内质网稳态,发挥自我保护作用,但是ERS反应时间过长或过强时,会激活ERS特异性凋亡程序,以清除受损细胞[12]。衣霉素是一种常用的ERS诱导剂,可通过抑制内质网糖基化,过度激活ERS,介导细胞调亡。已有许多研究报道了使用衣霉素建立小鼠、大鼠、胃癌细胞、成骨细胞、神经细胞、脂肪细胞等ERS体内和体外模型[2,14-15],如衣霉素体外刺激小鼠成骨细胞MC3T3-E1诱导ERS[16]。最近也有研究发现,采用衣霉素体内给药还可激活肝细胞ERS导致肝脏损伤和肝细胞调亡,但相关报道较少,仍有待进一步验证。
为进一步考察衣霉素诱导ERS小鼠肝损伤的效果和机制,本研究采用衣霉素1 mg·kg-1单次灌胃给药24 h,诱导小鼠ERS急性肝损伤模型。HE染色结果显示,模型组小鼠肝组织细胞明显肿胀,肝小叶界限模糊,并存在少量炎细胞浸润和肝细胞坏死;同时模型组小鼠肝指数、脾指数及胸腺指数均明显增加,血清中AST、ALT水平和肝组织匀浆中MDA活性明显升高、SOD活性明显下降,以上结果提示造模小鼠已发生肝损伤。葡萄糖调节蛋白78(glucose regulated protein 78kD,Grp78),又名免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,Bip)是ERS发生的重要标志物,Grp78/Bip水平可直接反映细胞的ERS水平,本研究结果显示,模型组小鼠肝组织中Grp78/Bip蛋白表达明显增加,表明衣霉素成功激活了小鼠肝细胞ERS反应。门冬氨酸特异性半胱氨酸蛋白酶12(cysteine aspartic acid specific protease-12,caspase-12)是内质网特异性的凋亡效应蛋白,其可通过切割Bid 蛋白,促使活性的 p15 Bid 蛋白释放和堆积,激活凋亡执行因子caspase-3,从而抑制或活化 Bax、Bcl-2等凋亡相关蛋白的表达,诱导细胞凋亡[17]。本研究Western blot结果显示,模型组小鼠肝组织中caspase-12、caspase-3及Bax表达明显升高,而抗凋亡蛋白Bcl-2表达明显下降,表明衣霉素可能是通过过度激活ERS触发 Grp78/caspase-12 信号通路诱导了肝细胞的凋亡。因此,通过阻断ERS触发 Grp78/caspase-12 信号通路的活化可能是防治肝损伤的全新思路。
丹参酮是从中药丹参中提取的脂溶性菲醌化合物。大量研究发现,丹参酮Ⅱ A具有抗微生物、抗炎、抗肿瘤、降血糖等多种药理作用[18]。许多研究证实,丹参酮Ⅱ A可通过调节PPARα、Nrf2/ARE、MEK/ERK/mTOR 等通路有效改善急性肝损伤小鼠的病理损伤[3-5],但丹参酮Ⅱ A能否通过通路调控ERS触发的caspase-12/caspase-3信号通路而发挥抗肝损伤的作用,尚未见报道。本研究将联苯双酯和不同浓度丹参酮Ⅱ A对衣霉素诱导的ERS小鼠进行预先给药后发现,与模型组相比,联苯双酯和丹参酮Ⅱ A均能明显减轻衣霉素诱导的炎细胞浸润、细胞索紊乱和肝细胞凋亡,降低小鼠血清中 AST、ALT水平,升高肝组织中SOD含量,而减少 MDA 含量,提示丹参酮Ⅱ A对衣霉素诱导的小鼠急性肝损伤具有较好的保护作用。同时Western blot结果显示,与模型组相比,丹参酮Ⅱ A治疗组小鼠肝组织中Grp78/Bip、caspase-12、caspase-3及Bax表达明显下降,而抗凋亡蛋白Bcl-2表达明显升高,表明丹参酮Ⅱ A可能是通过下调 Grp78/Bip 蛋白表达,拮抗ERS 触发 Grp78/caspase-12 通路的激活,发挥其抗凋亡的作用。
综上表明,丹参酮Ⅱ A对衣霉素引起的损伤肝细胞具有一定的保护作用,其机制可能与其抑制 ERS 触发的 Grp78/caspase-12 信号通路活化有关。本文为解释急性肝损伤的发病机制提供了新的思路,也进一步验证了丹参酮Ⅱ A对急性肝损伤的治疗作用。此外,抑制Grp78/caspase-12 通路激活也有望成为临床治疗急性肝损伤的新策略及药物研发的新思路。

