人参皂苷Rg1下调NOX2-NLRP1减轻PC12细胞缺氧再复氧损伤的作用
黄茸茸,陆松侠,孙玲玲,张 晗,丁世欣,李维祖
(1. 安徽新华学院药学院药理学教研室,安徽 合肥 230088;2. 安徽医科大学药理学教研室,抗炎免疫药理学教育部重点实验室,国家中医药管理局中药药理三级实验室,安徽 合肥 230032)
近年来,受人口老龄化、饮食习惯改变等多因素影响,卒中类疾病的发病率、致残致死率逐年升高。其中缺血性脑卒中主要由脑部血液供应不足导致,治疗策略常通过溶栓治疗以恢复血流灌注,再灌注过程虽可挽救缺血半暗带内的濒死脑神经细胞,但同时也可加重脑神经细胞损伤,甚至致死。导致脑缺血/再灌注损伤的机制较为复杂,且互为因果,已有实验研究发现其可能与自由基生成增多、炎性损伤、兴奋性氨基酸毒性、细胞钙超载及神经细胞凋亡等多种机制有关[1],但尚未完全阐明,仍需进一步探究。近年有研究表明,氧化应激和炎症反应与脑缺血/再灌注损伤的关系较为密切。NADPH氧化酶2(nicotinamide adenine dinucleotide phosphate oxidase 2,NOX2)是脑中活性氧(reactive oxygen species,ROS)生成的主要来源,而ROS的大量生成是激活炎症小体的主要途径。核苷酸结合寡聚化结构域NOD样受体蛋白1(nucleotide-binding oligomerization domain-like receptor protein 1,NLRP1)炎症小体的活化能调控炎症因子前体pro-IL-1β和pro-IL-18的成熟和分泌,从而导致脑组织出现炎性损伤[2]。因此,NOX2-NLRP1信号通路可为筛选治疗脑缺血/再灌注损伤(cerebral ischemia/reperfusion injury,CIRI)药物的重要靶点。
目前临床尚无有效防治CIRI的药物,这使得从中药材资源中寻找有效的天然活性成分成为研究热点。人参(ginseng)为五加科草本植物,是我国传统中药材之一,因对中枢神经系统、心血管系统、免疫系统等具备较为广泛的双向调节作用,其保健及药用价值较高。人参皂苷Rg1(ginsenoside Rg1)为四环三萜类衍生物,是人参中的主要生物活性成分,有最新研究报道[3-6],人参皂苷Rg1对中枢神经退行性疾病如阿尔茨海默病、抑郁症、癫痫及酒精性肝病等疾病均有一定治疗保护作用,但其对脑缺血/再灌注损伤的保护作用及机制未明,有待进一步研究。因此,本实验通过体外研究NOX2-NLRP1信号通路在PC12细胞氧糖剥夺/再复氧(oxygen glucose deprivation/reoxygenation,OGD/R)损伤中的作用及Rg1的干预作用,以寻证防治脑缺血/再灌注损伤的新靶点及有效防治药物,并为人参药材的开发提供实验基础。
1 材料
1.1 实验细胞PC12细胞株,安徽医科大学药理教研室细胞库冻存惠赠。
1.2 药品和试剂人参皂苷Rg1(≥98%),成都德斯特生物技术有限公司,DR0009;Apocynin,德国Merck Millipore公司,178385-1GM;Tempol,德国Merck Millipore公司,581500-500MG;RIPA细胞裂解液,江苏碧云天生物技术有限公司,P0013B;DMEM高糖培养液,美国Hyclone公司,SH30022.01B;胎牛血清,杭州天杭生物科技有限公司,11011-8611;乳酸脱氢酶(LDH)检测试剂盒,江苏凯基生物技术有限公司,KGT02448;活性氧(ROS)检测试剂盒,江苏凯基生物技术有限公司,KGAF018;白介素-1β(IL-1β)检测试剂盒,江苏酶免实业有限公司,3748;Annexin V-FITC/PI凋亡检测试剂盒,北京四正柏生物科技有限公司,FXP018-050;无血清细胞冻存液,苏州新赛美生物科技有限公司,C40100。
1.3 实验仪器5% CO2恒温培养箱(香港Heal Force公司);无菌超净工作台(苏州净化设备有限公司);三气培养箱(美国Thermo Fisher公司);IX-71 荧光倒置显微镜(日本Olympus有限公司);全波长酶标仪(美国Thermo Fisher公司);PowerPac 200 Western blotting电泳仪(美国Bio-Rad公司);Mini-PROTEAN Tetra电泳槽(美国Bio-Rad公司);Countstar自动细胞计数仪(上海睿钰生物技术有限公司);高内涵细胞成像分析系统(美国MD公司)。
2 方法
2.1 PC12细胞OGD/R模型的建立PC12细胞在DMEM高糖培养基中长至约70%时,将其接种至培养板。取对数生长期PC12细胞,除去DMEM高糖培养基,用PBS清洗3次,更换为无糖Earle平衡盐溶液后置于三气培养箱(含1% O2+5% CO2+94% N2)中,37 ℃培养6 h,即缺氧缺糖6 h,之后再换回DMEM高糖无血清培养基于常氧培养箱中复氧24 h建立OGD/R模型。
2.2 实验分组与给药实验分为6组,即空白对照组、OGD/R模型组、OGD/R+Tempol(50 μmol·L-1)组、OGD/R+Apocynin(50 μmol·L-1)组、OGD/R+Rg1(5 μmol·L-1)组、OGD/R+Rg1(10 μmol·L-1)组。空白对照组不做处理正常培养,其余各组细胞均缺氧缺糖处理6 h,再复氧复糖24 h制作OGD/R细胞模型。各给药组均需在造模前分别加药孵育2 h。
2.3 DCFH-DA法检测活性氧ROS生成各组PC12细胞再复氧复糖24 h后,吸取细胞上清于-20 ℃存放备用。用PBS清洗细胞3次,然后将DCFH-DA储存液和PBS缓冲液以1 ∶1 000混合配制成工作液,每个培养孔加1 mL,摇床上摇晃20 min,再将培养板中的工作液吸出,用PBS清洗培养板3次,5 min/次,将培养板置于细胞高内涵成像系统内进行拍摄并分析ROS的生成量。
2.4 Annexin V-FITC/PI双染法检测细胞凋亡情况各组PC12细胞再复氧复糖24 h后弃去培养基。用预冷的PBS洗涤细胞2次,加入10 μL/孔Annexin V-FITC试剂混匀后,于室温避光孵育15 min,再加入5 μL碘化丙锭溶液(PI)后混匀避光孵育5 min,再用PBS洗涤细胞2次,在荧光显微镜下观察各组细胞的凋亡情况并拍照,绿色荧光显示早期凋亡细胞,红色荧光显示晚期凋亡细胞。
2.5 细胞上清中LDH活力与IL-1β的含量检测各组PC12细胞再复氧复糖24 h后取上清,于4 ℃离心10 min后,用LDH检测试剂盒按说明书操作,使用酶标仪在440 nm检测各组上清吸光度值,计算LDH活力;采用ELISA法按试剂盒的操作说明书操作,使用酶标仪在450 nm波长下测定各组上清吸光度,根据标准品线性回归曲线,按曲线方程计算各组细胞上清中IL-1β的浓度值。
2.6 Western blot法检测NOX2、p22phox、p47phox、NLRP1、ASC、Caspase-1、PSD95、Tau、p-Tau的蛋白表达水平取给药预处理后缺氧缺糖6 h,再复氧24 h后的各组PC12细胞,吸出培养基,PBS缓冲液清洗3次后加入1 mL PBS缓冲液,用细胞刮刮取细胞,然后将各组细胞悬浮液分别置于离心管中,4 ℃预冷的冰冻离心机1 200 r·min-1离心15 min,弃去上清,每管加入细胞裂解液200 μL,每10 min于涡旋仪上震荡10 s,共3次。然后放入冰冻离心机中1 200 r·min-1,离心15 min,取上清作为细胞总蛋白。采用BCA法测定各组蛋白浓度,再加入loading buffer煮沸变性,SDS-PAGE凝胶电泳并转PVDF膜,转膜完成后于5%脱脂奶粉封闭液中室温下孵育1 h,再加一抗:NOX2(Abcam公司,ab80508,1 ∶1 000)、p22phox(Bioworld公司,BS60290,1 ∶1 000)、p47phox(Bioworld公司,BS6181,1 ∶1 000)、NLRP-1(Abcam公司,ab98181,1 ∶1 000)、Caspase-1(Bioworld公司,BS5641,1 ∶500)、ASC(Bioss公司,bs-6741R,1 ∶1 000)、PSD95 (Servicebio公司,GB11277,1 ∶1 000)、Tau(Servicebio公司,GB111609,1 ∶1 000)、p-Tau(Abcam公司,ab92676,1 ∶1 000)和β-actin(Servicebio公司,GB12001,1 ∶1 000)于4 ℃下孵育过夜后,将PVDF膜用TBST缓冲液洗涤3次,10 min/次,加入HRP标记的二抗(1 ∶10 000),室温孵育1 h,再用TBST缓冲液洗涤3次,10 min/次。最后将PVDF膜浸泡于ECL化学发光液中3 min,用化学发光成像系统进行显影。使用ImageJ软件分析各目的蛋白的灰度值,并以β-actin的表达作为参照,计算各目标蛋白的相对表达量。
3 实验结果
3.1 人参皂苷Rg1对OGD/R后PC12细胞上清中LDH活性的影响细胞上清中LDH的活性(即释放量)与细胞损伤密切相关。由Fig 1结果显示,与空白对照组比较,模型组PC12细胞上清的LDH释放量显著增加(P<0.01);而与模型组相比,Tempol、Apocynin、Rg1(5、10 μmol·L-1)药物组细胞上清的LDH释放均明显降低(P<0.05或P<0.01)。提示人参皂苷Rg1可明显减轻OGD/R处理对PC12细胞的损伤。
3.2 人参皂苷Rg1对OGD/R后PC12细胞凋亡的影响细胞凋亡是脑缺血/再灌注损伤的重要形式,因此本实验通过Annexin V-FITC/PI双染法观察人参皂苷Rg1对OGD/R处理PC12细胞凋亡的影响。Fig 2结果显示,空白对照组细胞生长良好,早期凋亡和晚期凋亡细胞少见;但与其相比,OGD/R模型组早期凋亡和晚期凋亡的细胞数明显增加(P<0.01);而与模型组比较,Tempol、Apocynin和Rg1(5、10 μmol·L-1)药物预处理均能明显减少OGD/R后早期凋亡和晚期凋亡细胞(P<0.05或P<0.01)。表明人参皂苷Rg1可通过抑制凋亡减轻OGD/R处理对PC12细胞的损伤。

Fig 1 Effect of ginsenoside Rg1 on activity of LDH after OGD/R in PC12 cells n=4)
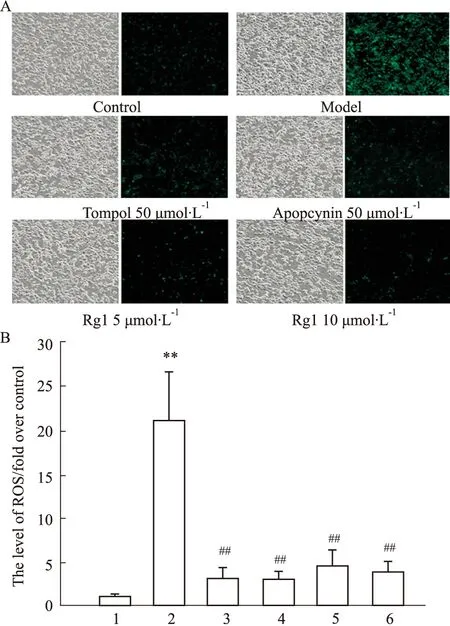
Fig 3 Effect of ginsenoside Rg1 on ROS production after OGD/R in PC12 cells n=3)
3.3 人参皂苷Rg1对OGD/R后PC12细胞ROS生成的影响ROS大量生成导致的氧化应激损伤是脑缺血/再灌注损伤的重要机制之一。因此本研究使用DCFH-DA荧光染色法检测OGD/R后PC12细胞的ROS水平。如Fig 3结果显示,空白对照组细胞生长状态良好,有少量ROS生成;但模型组细胞则出现形态变圆,大小不一,ROS生成明显增加(P<0.01);而与模型组相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)药物处理组的细胞状态有明显改善,ROS的水平明显降低(P<0.01)。结果提示人参皂苷Rg1可通过抑制ROS生成减轻OGD/R对PC12细胞的氧化应激损伤。
3.4 人参皂苷Rg1对OGD/R后PC12细胞中NADPH氧化酶2相关蛋白NOX2、p22phox和p47phox表达的影响NADPH氧化酶2是神经元中生成ROS的重要酶系统,因此实验进一步检测OGD/R后PC12细胞中ROS生成是否与此有关。Fig 4所示,空白对照组中NOX2、p22phox和p47phox蛋白表达水平较低,但与对照组比较,模型组细胞的NOX2、p22phox和p47phox蛋白表达明显增多(P<0.05或P<0.01);而与模型组比较,Tempol处理对p22phox与p47phox蛋白的表达有抑制作用(P<0.05),而对NOX2的蛋白表达无显著影响;但Apocynin和Rg1(5、10 μmol·L-1)处理均可明显降低OGD/R后PC12细胞中NOX2、p22phox和p47phox的蛋白表达(P<0.05或P<0.01)。实验结果表明,人参皂苷Rg1可通过下调NADPH氧化酶2表达抑制OGD/R后PC12细胞中ROS生成。

Fig 4 Effect of Rg1 on expressions of NOX2, p22phox and p47phox after OGD/R in PC12 cells n=3)
3.5 人参皂苷Rg1对OGD/R后PC12细胞及上清中IL-1β含量的影响Fig 5结果显示,空白对照组细胞中及上清中IL-1β的水平均较低,但与对照组比较,模型组细胞中及上清中IL-1β的水平明显升高(P<0.05);而与模型组相比,Tempol、Apocynin、Rg1(5, 10 μmol·L-1)组细胞及上清中IL-1β的含量水平明显降低(P<0.05或P<0.01)。结果提示,人参皂苷Rg1可通过抑制炎症因子IL-1β生成减轻OGD/R对PC12细胞的炎性损伤。

Fig 5 Effect of ginsenoside Rg1 on IL-1β level after OGD/R in PC12 cells and in supernatant n=3)
3.6 人参皂苷Rg1对OGD/R后PC12细胞中NLRP1炎症小体相关蛋白NLRP1、ASC及Caspase-1表达的影响Fig 6结果显示,空白对照组PC12细胞中NLRP1、ASC及Caspase-1表达水平较低,但与对照组相比,模型组细胞的NLRP1、ASC及Caspase-1的蛋白表达均明显增加(P<0.05或P<0.01);而与模型组相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)处理均可使NLRP1炎症小体相关蛋白表达明显下降(P<0.05或P<0.01)。该实验结果表明,人参皂苷Rg1可通过抑制NLRP1炎症小体激活减轻OGD/R处理后PC12细胞的炎症损伤。
3.7 人参皂苷Rg1对OGD/R后PC12细胞中PSD95、Tau及p-Tau蛋白表达的影响PSD95是突触后致密区的支架蛋白,p-Tau水平与神经纤维缠结密切相关,本研究进一步检测了OGD/R对PC12细胞PSD95和p-Tau水平的影响。如Fig 7结果显示,与空白对照组相比,模型组细胞中的PSD95蛋白表达明显降低(P<0.01),p-Tau蛋白表达明显升高(P<0.01),而Tau蛋白的表达则差异无统计学意义;但与模型组相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)处理组均可使PSD95蛋白表达明显升高(P<0.05或P<0.01),使p-Tau蛋白的表达明显降低(P<0.05或P<0.01)。该实验结果表明,人参皂苷Rg1可明显减轻OGD/R所致的神经突触结构性损伤;而其能明显抑制磷酸化Tau蛋白水平,表明人参皂苷Rg1还可减轻OGD/R处理PC12细胞所致的神经毒性反应。

Fig 6 Effect of Rg1 on expressions of NLRP1, ASC and Caspase-1 after OGD/R in PC12 cells n=3)

Fig 7 Effect of Rg1 on expression of PSD95, Tau and p-Tau after OGD/R in PC12 cells n=3)
4 讨论
脑缺血是中老年群体中常见的疾病之一,大量研究发现[7],脑缺血/再灌注后可能会引发更加严重的神经功能障碍及脑组织损伤,被称为“脑缺血/再灌注损伤”,因其与临床多种脑血管病密切相关,已成为当前研究热点之一。CIRI损伤机制十分复杂,可导致蛋白质分子及其调节发生变化,且多种因素参与了缺血/再灌注引起的神经元细胞损伤,如氧化应激、炎症反应、血脑屏障破坏等,最终导致不可逆的神经元死亡。
OGD/R模型是一种体外中风模型,与脑缺血/再灌注的体内病理模型相似。PC12细胞来源于大鼠肾上腺嗜铬细胞瘤髓质,是研究神经元功能、信号转导和评价药物功效的常用细胞类型,本实验研究即是采用PC12细胞建立体外OGD/R模型。实验结果显示,OGD/R模型组细胞变圆,且大小不一,并出现变性坏死及凋亡等损伤;而Tempol、Apocynin和Rg1(5、10 μmol·L-1)药物组均可不同程度的改善OGD/R导致的细胞损伤。
脑缺血会导致大量活性氧(ROS)生成,且脑组织复氧复糖也会刺激ROS的过度释放来参与脑缺血/再灌注性损伤。ROS生成过多会破坏生物膜导致乳酸脱氢酶(LDH)释放增加,因此,LDH释放是评价神经元损伤程度的重要指标之一[8]。本实验结果显示,与模型组比较,Tempol、Apocynin和Rg1(5、10 μmol·L-1)药物组能明显减少ROS生成及上清中LDH活性,说明经药物干预可明显减轻OGD/R后PC12细胞的氧化应激损伤。细胞凋亡是由基因控制的自主有序的死亡,脑缺血过程中肿瘤坏死因子和自由基的产生,生长因子和神经营养因子的缺乏,DNA损伤等多种诱因可能触发细胞凋亡[9];且另有研究表明,强效抗氧化剂对大脑I/R导致的神经凋亡具有显著抑制作用[10]。本实验结果显示,OGD/R刺激可促进细胞凋亡的发生,而抗氧剂Tempol、NADPH氧化酶2抑制剂Apocynin及人参皂苷Rg1均可有效逆转OGD/R导致的神经元凋亡。实验数据均表明,Rg1对OGD/R导致的PC12细胞氧化应激损伤具有较好的保护作用。
有研究显示,广泛分布于脑神经元细胞、星形胶质细胞及小胶质细胞等的NADPH氧化酶是脑缺血/再灌注时ROS的重要来源,在CIRI损伤中发挥关键作用。NADPH氧化酶催化亚基gp91phox/NOX2及其同源物统称为NOX家族蛋白。有研究发现[11],NOX家族中的NOX2与中风后脑内ROS的生成密切相关,且敲除NADPH氧化酶基因或使用NADPH氧化酶抑制剂均可明显减轻氧化损伤。另有实验研究显示[12],NOX2抑制剂(gp91ds-tat)可明显抑制I/R诱导的ROS的释放,并减少脑梗死体积,减轻神经凋亡和血脑屏障损伤,因此,NADPH氧化酶成为治疗缺血性脑血管病的重要靶点。Apocynin又称为罗布麻宁、茶叶花宁、夹竹桃麻素等,已有研究报道,Apocynin能够降低脑缺血大鼠的神经功能缺陷及细胞凋亡率,从而减轻CIRI损伤,其机制可能与抑制NADPH酶的活化有关[13]。Tempol (4-Hydroxy-TEMPO)是一种超氧化物清除剂,具有较好的神经保护、抗炎和镇痛效果。有研究报道,其可有效清除自由基,抑制脂质过氧化和脑神经细胞发生氧化性损伤,对改善脑内细胞炎症反应有较明显的作用[14]。本实验结果显示,Tempol、Apocynin和Rg1(5、10 μmol·L-1)组可明显降低OGD/R后PC12细胞的NOX2、p22phox和p47phox蛋白表达,同时降低OGD/R后细胞ROS的释放,提示人参皂苷Rg1可能是通过抑制NOX2的活性来减少OGD/R诱导的ROS生成,同时提示抑制NOX2的活性可能是抑制细胞凋亡和改善CIRI损伤的有效策略之一。
在脑缺血/再灌注损伤的众多机制中,炎症机制已得到公认。已有大量实验证明,IL-1β是最重要的细胞因子,其参与脑缺血/再灌注性损伤,且可能与炎症小体NLRP-1密切相关[15]。炎症小体NLRP-1主要在大脑、血液和胸腺等组织中表达,其主要由NLRP-1、ASC、Caspase-1三种蛋白构成。NLRP-1通过接头蛋白ASC招募Pro-caspase-1,Caspase-1激活后可对pro-IL-1β等细胞因子前体进行加工,使其成熟并释放到胞外,诱发神经炎性反应而导致中枢神经系统病变。另有研究报道显示,NLRP-1可能介导了脑缺血后细胞损伤的相关炎症反应,而ROS是触发缺血性中风后NLRP-1炎症小体通路激活的主要信号[16]。因此,抑制NLRP-1炎症小体活化也成为防治脑缺血/再灌注性损伤的重要策略之一。本实验结果显示,OGD/R后可明显增加PC12细胞中NLRP-1,ASC,Caspase-1和IL-1β相关蛋白表达,提示NLRP-1介导了OGD/R细胞的炎症反应,这与文献报道结果一致。本实验数据则进一步显示,Tempol,Apocynin和Rg1(5、10 μmol·L-1)均能降低OGD/R后PC12细胞的NLRP1,ASC,Caspase-1和 IL-1β 蛋白表达水平,同时降低细胞上清中IL-1β的含量。这说明Rg1可能是通过下调NOX2-NLRP1通路来减轻OGD/R导致的神经元损伤。
脑缺血/再灌注损伤所导致的神经功能障碍是脑卒中治疗中亟待解决的难点问题,而突触可塑性是构成学习记忆等功能的重要神经化学基础。突触后致密蛋白95(postsynaptic density protein 95,PSD95)是突触后致密区的支架蛋白,有研究表明,PSD95表达异常与学习记忆功能障碍密切相关,当脑缺血/再灌注引发脑组织神经功能障碍时,PSD95的表达被明显抑制[17]。Tau蛋白是一种相对分子量较小的微管相关蛋白,在正常生理条件下可促进微管蛋白聚集成微管并增强其稳定性,在维持神经细胞生长发育及轴突信息传递中发挥重要作用。近年研究发现,脑缺血后Tau蛋白异常磷酸化明显增加,p-Tau蛋白已成为神经元缺血性损伤较为敏感的标志之一。而Tau蛋白的过度磷酸化,是加速神经元死亡的主要原因[18]。本实验研究发现,Tempol、Apocynin和Rg1(5、10 μmol·L-1)组可使PSD95蛋白表达明显升高,使p-Tau蛋白的表达明显降低,说明人参皂苷Rg1能够减轻脑缺血/再灌注所致的突触结构性损伤和抑制tau蛋白磷酸化水平。
综上所述,PC12细胞在缺氧复氧处理后细胞活性降低,氧化应激与细胞凋亡明显,炎症小体相关蛋白表达上调,最终造成细胞病理性损伤。而Tempol、Apocynin和Rg1(5,10 μmol·L-1)各药物组均能减轻OGD/R导致的细胞损伤从而抑制细胞凋亡,说明人参皂苷Rg1可能是通过抑制NOX2-NLRP1信号通路来减轻PC12细胞缺氧复氧性损伤。

