白藜芦醇通过ROS-JNK通路抑制晚期糖基化终末产物诱导PC12细胞凋亡
姜 磊,路延超,张家恺,张 睿,许顺江,张国军
(1.首都医科大学附属北京天坛医院实验诊断中心,2.北京市免疫试剂临床工程技术研究中心,北京 100070;河北医科大学第一医院 3.中心实验室,4. 核医学科, 5. 放射科,河北 石家庄 050031;6.国家药监局体外诊断试剂质量控制重点实验室,北京 100070)
糖尿病脑病(diabetic encephalopathy,DE)是糖尿病引起的认知功能障碍,与阿尔茨海默病(Alzheimer’s disease,AD)具有相似病理改变,如神经元变性、海马萎缩、Aβ沉积和突触减少等[1]。研究发现,DE的发病途径主要集中在氧化应激、炎症和自噬等[2]。氧化应激损伤作为ROS连锁反应的始动因素,可引起细胞毒性作用和生命大分子(膜脂质、蛋白质、DNA)的损伤,进而导致DE的发生与发展。
晚期糖基化终末产物(advanced glycation end products,AGEs)作为体内过量葡萄糖等碳水化合物合成的有毒物质,可以通过抑制体内抗氧化物的产生、促进体内ROS的产生和促炎等多种途径发挥毒性作用[3-4]。AGEs 及其受体RAGE在小胶质细胞高度表达可诱导机体产生一系列炎症反应,从而导致大量经炎症介质的产生,引发继发性脑损伤[5]。
白藜芦醇(resveratrol,RSV)是一种从虎杖、桑椹、葡萄、浆果和花生等植物性食物中提取的类黄酮多酚类化合物[6-7]。RSV可在一定程度上改善AD大鼠动物模型的空间学习记忆能力[8]。RSV可有效防止炎症反应和脂肪酸氧化,其机制可能与AMPK的激活和衰老标志物p21的表达增加有关[6-7]。此外,JNK作为MAPK通路4种主要的分支路线之一,可通过被 ROS 激活来调节细胞的生存或死亡[9]。本研究通过流式细胞仪检测 ROS 在RSV干预下AGEs诱导DE细胞模型中的表达,探讨RSV治疗 DE 的潜在分子机制,为临床使用RSV对DE的防治提供理论依据。
1 材料
1.1 细胞与试剂大鼠嗜铬细胞瘤(PC12)细胞从中国科学院上海细胞库购入;AGEs(批号A0764)和RSV(批号R5010)购于美国SIGMA公司;DMEM培养基(批号12800017)和胎牛血清(批号 10099141C)购于美国Invitrogen公司;MTS(批号 G3580) 购于美国Promega公司;JNK(批号9252)和p-JNK(批号4668)一抗购于美国 CST 公司; Bcl-2(批号 ab59348)和PUMA(批号ab9643)一抗购于美国 Abcam公司; BAX(批号 50599-2-lg)、Caspase-3(批号 19677-1-AP)和β-actin(批号66009-1-Ig)一抗购于美国Proteintech公司;驴抗鼠(批号A23710)和驴抗兔(批号 A23920)荧光二抗购于 Abbkine公司;RO 检测试剂盒(批号 D6470)和AnnexinV-FITC/PI凋亡试剂盒(批号 CA1020)购自中国 Solarbio 公司;TUNEL BrightRed 凋亡检测试剂盒(批号 A113)购自Vazyme 公司。
1.2 仪器BB150-2TCS CO2细胞培养箱(美国 Thermo Fisher 公司);5810R低温高速离心机(德国 Eppendorf 公司);Promega-GloMax酶标仪(美国 Promege 公司);Odyssey红外成像系统(美国LI-COR Biosciences公司);CYTOMICS FC 500流式细胞仪(美国Beckman公司);CK40-F200荧光显微镜(日本 Olympus 公司)。
2 方法
2.1 细胞培养及传代将PC12细胞加入含10%胎牛血清的 DMEM 培养基中,在37 ℃温度和 5% CO2培养箱中孵育。每2 d换1次培养基,在细胞处于对数生长期时,经0.25% 胰酶消化后传代用于后续实验。
2.2 MTS法检测细胞的相对存活率将PC12细胞用培养基制成细胞密度为1×109个·L-1的细胞悬液并种入96孔板,用不同浓度AGEs(0、50、100、200、400 g·L-1)、不同浓度 RSV(0、5、10、20、40 μmol·L-1)和AGEs+RSV联合处理细胞24 h后,每孔加入10 μL MTS试剂,在37 ℃,5% CO2的环境下孵育24 h。在酶标仪490 nm波长下读取吸光度值。细胞存活率/%=(实验组OD值/对照组OD值)×100%。计算不同组别细胞存活率,实验均重复3次,取其均值。
2.3 TUNEL法检测细胞的凋亡将处理好的PC12细胞去除培养基后加入适量4%多聚甲醛固定20 min。PBS清洗两次后加入2 g·L-1的Proteinase K溶液100 μL,孵育5 min。加入100 μL 1×Equilibration Buffer覆盖样本,室温平衡30 min。再加入TdT孵育缓冲液,37 ℃孵育60 min。DAPI复染,使用荧光显微镜在620 nm荧光下观察BrightRed红色荧光,在460 nm荧光下观察DAPI蓝色荧光。
2.4 Annexin V-FITC/PI流式细胞分析法检测细胞凋亡严格按照Annexin V-FITC/PI 凋亡试剂盒说明书操作,向处理好的各组PC12细胞中加入100 μL 1×Binding Buffer重悬细胞。再加入5 μL Annexin V-FITC和5 μL PI Staining Solution,充分混匀。避光、室温反应10 min。加入400 μL 1×Binding Buffer,轻轻混匀。1 h之内使用CYTOMICS FC 500流式细胞仪进行检测。左下象限为活细胞[Annexin V(-) PI(-)];左上象限为非活细胞,即坏死细胞[Annexin V(-) PI(+)];右上象限为晚凋细胞[(Annexin V(+) PI(+)];右下象限为早凋细胞[(Annexin V(+) PI(-)]。本实验中凋亡细胞记右上和右下两象限细胞。
2.5 流式细胞仪检测细胞活性氧严格按照活性氧检测试剂盒说明书操作,1 ∶1 000用无血清培养液稀释DCFH-DA,使用终浓度为10 μmol·L-1。避光条件下加入1 mL/孔DCFH-DA,4 ℃染色20 min,流式细胞仪488 nm的激发光进行激发,用无血清细胞的新鲜培养液充分洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。1 h之内在CYTOMICS FC 500流式细胞仪上检测荧光强度。
2.6 Western blot检测相关蛋白表达提取各组PC12细胞总蛋白,BCA蛋白检测方法对总蛋白进行定量。使用SDS-PAGE电泳分离蛋白后,将蛋白转移到PVDF膜上。5% BSA室温封闭30 min,一抗4 ℃孵育24 h。二抗室温避光孵育40 min。使用Odyssey超灵敏多功能红外荧光扫描成像仪系统曝光目的条,计算目的蛋白/β-actin的灰度值。
3 结果
3.1 MTS检测AGEs和RSV对 PC12 细胞存活率的影响MTS结果如Fig 1所示,不同浓度(0、50、100、200、400 g·L-1)的AGEs刺激PC12细胞24 h后,MTS结果显示,AGEs体外处理对PC12细胞有明显的生长抑制作用。400 g·L-1AGEs处理24 h后,细胞的存活率降至70%(P<0.01)。因此,在接下来的实验中,以400 g·L-1AGEs诱导PC12细胞制备DE细胞模型。5-10 μmol·L-1RSV溶液作用PC12细胞24 h对细胞活性未见明显抑制作用,因此选择10 μmol·L-1RSV进行干预。将5 μmol·L-1和10 μmol·L-1的RSV分别与400 g·L-1AGEs联合应用于 PC12 细胞,与AGEs组比较,10 μmol·L-1的RSV可有效提高细胞存活率(P<0.05)。提示一定浓度的RSV可抑制AGEs对PC12细胞存活率的影响。

Fig 1 Effects of AGEs and RSV on PC12 cell viability n=3)
3.2 RSV对AGEs诱导的PC12细胞凋亡的影响TUNEL染色如Fig 2所示,细胞中被TUNEL BrightRed 染成红色的细胞为凋亡细胞,表现为胞体变小、染色质凝集和核固缩。AGEs组被TUNEL BrightRed染成红色的细胞明显增多,而加入RSV后可逆转此现象。流式细胞结果如Fig 3所示,与正常对照组比较,AGEs组细胞凋亡率明显增加(P<0.01);与AGEs组比较,AGEs+RSV组凋亡率明显减少(P<0.01)。上述结果表明,RSV可明显降低AGEs诱导的PC12细胞的凋亡。
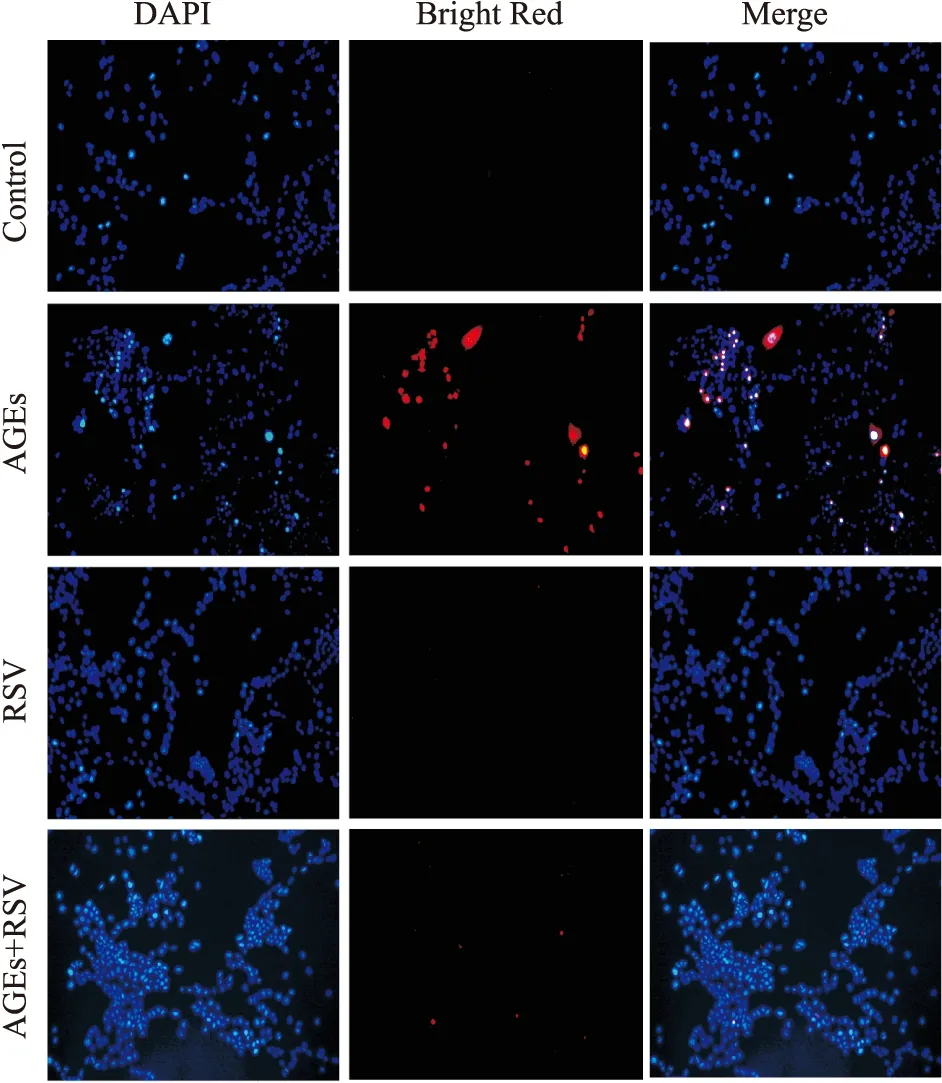
Fig 2 PC12 cell apoptosis in different groups detected by TUNEL staining (×200)
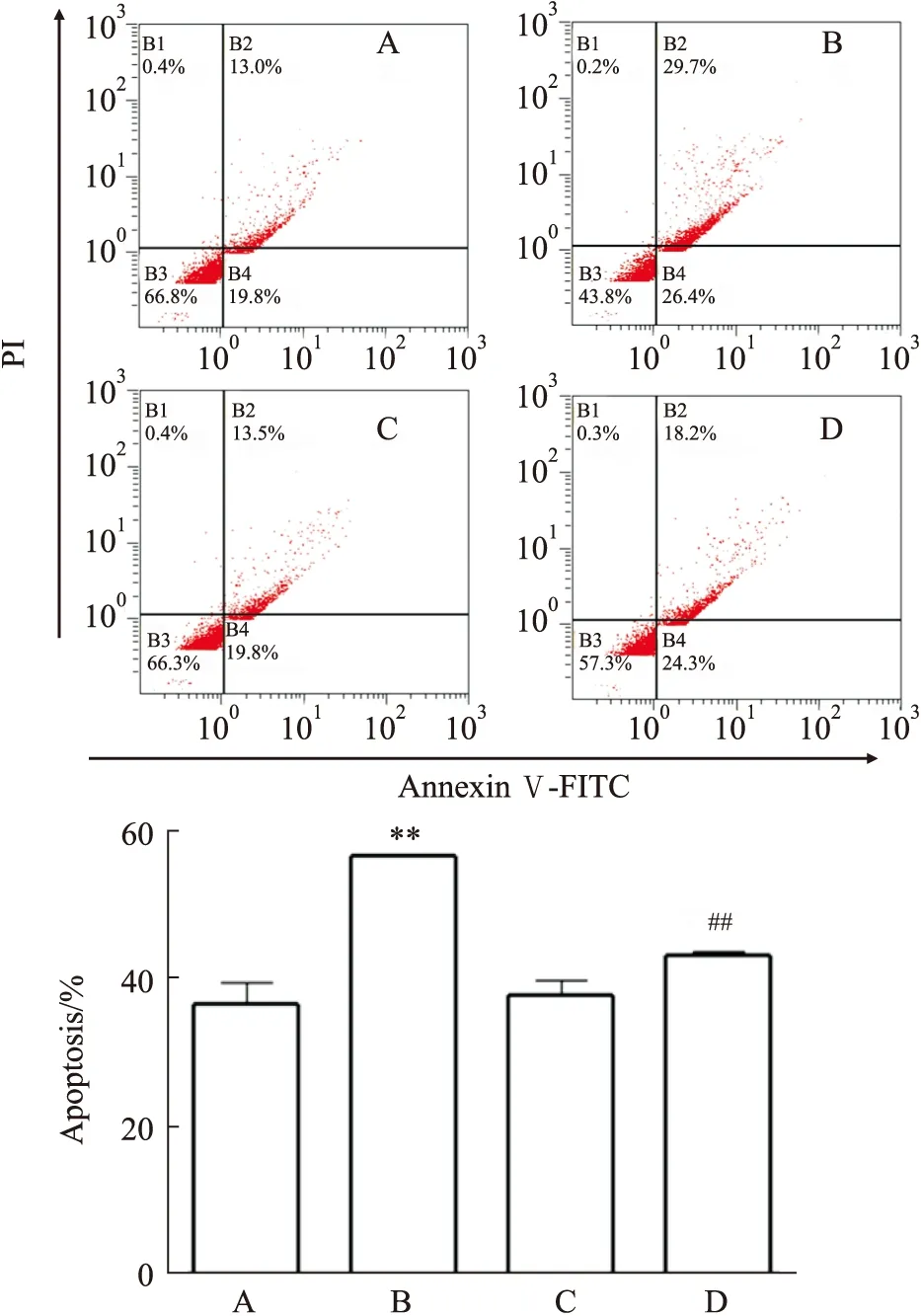
Fig 3 Effects of RSV on apoptosis of PC12 cells induced by AGEs n=3)
3.3 RSV对AGEs诱导的PC12细胞ROS的影响如Fig 4所示,与正常对照组比较,AGEs组ROS水平明显增加(P<0.01);与AGEs组比较,AGEs+RSV组ROS水平明显减少(P<0.01)。提示RSV可明显降低AGEs诱导的PC12细胞ROS的产生。
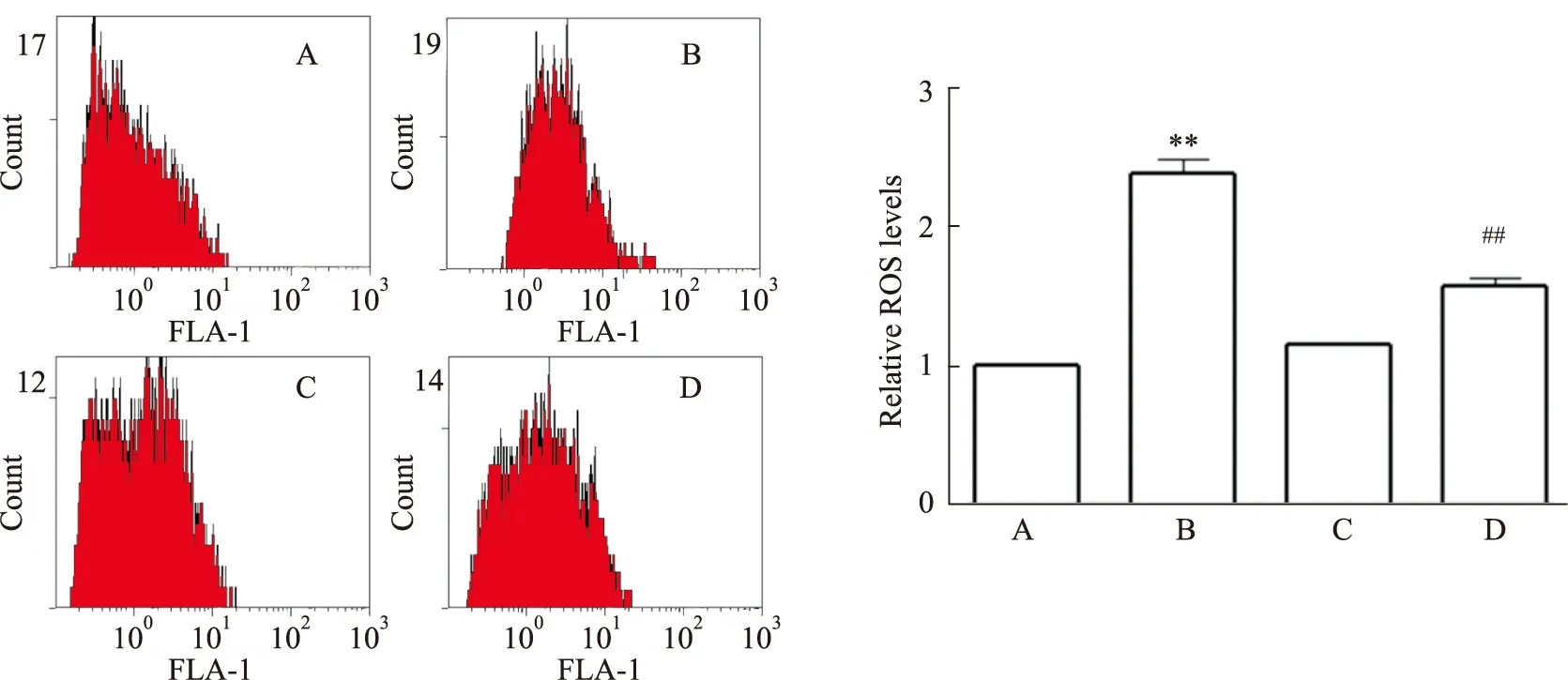
Fig 4 Effects of RSV on ROS of PC12 cells induced by AGEs n=3)
3.4 RSV对AGEs诱导的PC12细胞凋亡相关蛋白的影响如Fig 5所示,与正常对照组比较,AGEs组p-JNK、PUMA、Bax和Caspase-3蛋白表达明显增加(P<0.05或P<0.01),Bcl-2蛋白表达明显降低(P<0.01),JNK蛋白表达差异无统计学意义;与AGEs组比较,AGEs+RSV组p-JNK、PUMA、Bax和Caspase-3蛋白表达明显降低(P<0.05或P<0.01),Bcl-2蛋白表达明显增加(P<0.01),JNK蛋白表达无统计学差异。以上结果表明,RSV可能通过JNK通路调控AGEs对PC12细胞的凋亡作用。

Fig 5 Effects of RSV on apoptosis related proteins of PC12 cells induced by AGEs n=3)
3.5 JNK特异性抑制剂对AGEs诱导的PC12细胞凋亡的影响如Fig 6所示,JNK特异性磷酸化抑制剂(SP600125)可明显抑制AGEs诱导的PC12细胞的凋亡(P<0.01)。提示抑制JNK的磷酸化可抑制AGEs对PC12细胞的凋亡作用。
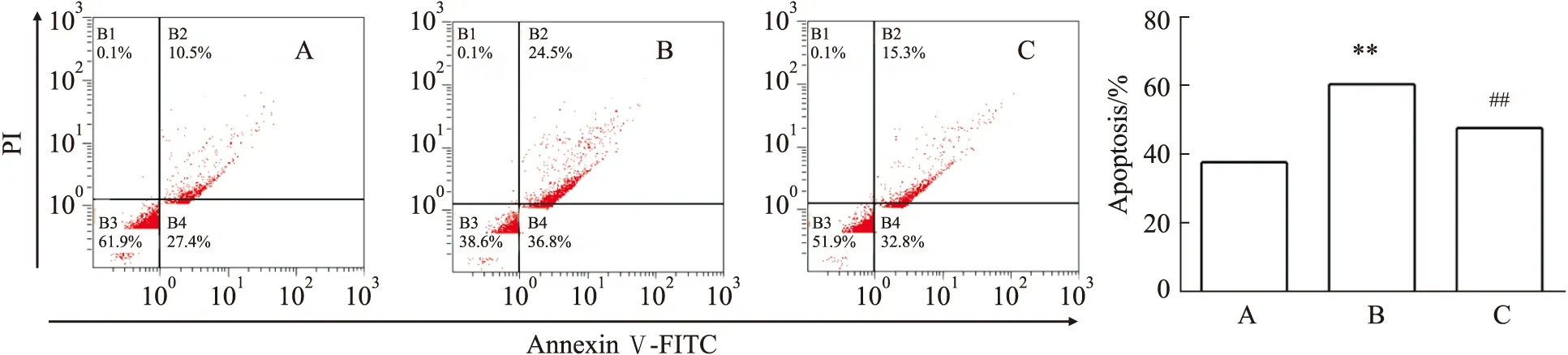
Fig 6 Effects of SP600125 on apoptosis of PC12 cells induced by AGEs n=3)
4 讨论
糖尿病通常被认为是一种双激素疾病,其特征是高血糖水平的低胰岛素血症和高胰高血糖素血症[10]。目前,全球糖尿病患者的数量不断上升,预计到2040年将达到6.42亿人[11]。大量的流行病学调查表明,2型糖尿病病人患AD的风险是非糖尿病病人的2倍[12]。糖尿病与记忆障碍具有相关性,但其机制尚不清楚[13]。最近文献报道DE大鼠呈现脑老化和AD样病理改变,如神经元变性、海马萎缩、神经细胞外Aβ沉积、神经细胞内神经元纤维缠结、神经细胞缺失和突触减少等[1]。因此,糖尿病被认为是AD的独立风险因子之一。我们推测DE和AD可能存在某些相似的发病机制和病理改变。关于AD的发病机制至今不明,存在多种学说,包括氧化应激学说、Aβ广泛聚集学说、tau蛋白的过度磷酸化假说、基因突变学说、淀粉样肽学说、免疫学说、线粒体功能障碍、炎症和自噬等,其中氧化应激学说备受关注。大量研究证实氧化应激是糖尿病和AD发病的重要机制,且参与了AD的病理进程。
有研究表明,在学习记忆障碍动物模型体内AGEs表达明显升高,而过多的AGEs导致神经元氧化应激损伤,加速学习记忆功能减退[14]。由于AGEs对神经元和中枢神经系统的其他细胞具有强毒性,AGEs水平增多会导致脂质过氧化物含量增加,脑内的超氧化物歧化酶、过氧化氢酶以及抗氧化酶活性明显下降,蛋白激酶C(PKC)激活,从而造成氧化应激损伤,氧化应激可通过激活聚腺苷二磷酸核糖聚合酶,进一步增强PKC活性,由此形成氧化应激恶性循环,造成糖尿病患者脑内氧化应激损伤[15]。虽然已明确AGEs可引起神经细胞的氧化应激损伤,但如何通过AGEs培养PC12细胞构建氧化应激诱导的DE细胞模型尚未见报道。本实验通过不同浓度AGEs对PC12细胞存活率的影响分析,发现400 g·L-1AGEs培养 PC12细胞24 h会使细胞存活率降至70%左右,ROS表达明显升高,因此使用400 g·L-1AGEs培养 PC12细胞24 h能够较准确地模拟 DE时脑内氧化应激损伤,建立DE细胞模型。
c-Jun 氨基末端激酶(JNK)是哺乳类细胞中MAPK信号通路的重要分支,在细胞氧化应激、细胞周期、细胞凋亡、生殖和炎症反应等多种生理和病理过程中起重要作用。大量研究表明,在氧化应激细胞中JNK是一种重要的促凋亡机制,JNK不仅容易通过不同的信号途径被活性氧激活,而且药物抑制JNK后还能有效防止由于活性氧导致的细胞凋亡[9]。PUMA作为重要的凋亡调节因子可结合Bcl-2和Bax,促使下游Caspase-3执行细胞凋亡。本研究结果显示,AGEs可诱导PC12细胞ROS升高,JNK蛋白活化,PUMA、Bax和Caspase-3蛋白增加,Bcl-2蛋白降低,增加细胞凋亡,降低细胞存活率。SP600125作为JNK特异性抑制剂可显著抑制AGEs引起的细胞凋亡。提示AGEs 对PC12细胞的损伤作用可能与ROS-JNK通路活化有关。
大量研究表明,白藜芦醇具有抗氧化、抗肿瘤、抗炎、抗病毒、治疗自身免疫性疾病、防止肥胖、增加线粒体呼吸、增加糖异生、防止2型糖尿病和延缓衰老等生理活性[6-7]。任等[16]研究发现,20 μmol·L-1白藜芦醇可显著抑制三甲基氯化锡诱导的大鼠海马神经元氧化损伤。本研究发现10 μmol·L-1RSV 同样可有效降低AGEs对PC12细胞氧化应激的损伤,同时降低JNK的活化,降低 PUMA、Bax和Caspase-3 蛋白的表达,提高Bcl-2蛋白的表达,降低细胞凋亡,提高细胞存活率。
综上所述,本实验成功构建了DE细胞模型,并明确了RSV的干预浓度;过量的AGEs可降低PC12细胞存活率,且 RSV可抵抗这一过程;RSV可能通过ROS-JNK信号通路抑制 AGEs对PC12细胞凋亡的影响,为后续的研究提供帮助。下一步我们将构建 DE大鼠模型,通过体内实验验证RSV对DE的影响。

