羟基红花黄色素A对缺血再灌注脑损伤小鼠皮层COX-2/PGD2/DPs途径的影响
王 琼,刘茂竹,陈梦园,刘 霞,鲁 懿,杨俊卿
(重庆医科大学药学院药理学教研室,重庆 400016)
中风具有较高的发病率和死亡率,可分为出血性中风和缺血性中风,其中缺血性中风约占中风总发生率的87%[1]。缺血性中风主要是由于脑组织局部血液供应减少或中断而引起的脑血管意外[2],其临床上治疗策略主要是再通/复氧。但是,这又必然会导致脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)[3]。目前,由于CIRI的病理生理机制并不完全清楚,因此缺乏有效治疗策略和有效的干预药物。因此,深入研究CIRI的病理生理机制,寻找有效降低CIRI的药物具有重要的医学意义和社会价值。
研究表明,炎症反应在脑缺血再灌注损伤的发病机理中起关键作用[4]。因此,抑制由脑缺血性中风引起的炎症反应可能成为中风治疗的一种新策略。羟基红花黄色素A(hydroxysafflor yellow A, HSYA)是红花黄色素中含量最高、药理功效最强的水溶性成分,有研究发现HSYA具有保护心血管系统[5]、抗氧化[6]、抗脑缺血再灌注损伤[7]等作用,但是其机制尚不明确。研究发现,炎症反应及其相关的环氧合酶2(cyclooxygenase-2,COX-2)及其下游通路前列环素(prostacyclin,PGI2)参与了CIRI的机制[8],但是HSYA对CIRI作用机制是否涉及COX-2/PGD2/DPs途径,尚未见报道。
本实验拟通过大脑中动脉栓塞/再灌注(middle cerebral artery occlusion/reperfusion, MCAO/R)小鼠模型,进一步验证HSYA对缺血再灌注脑损伤小鼠的保护作用。同时观察小鼠皮层COX2、DP1、DP2mRNA和蛋白的表达改变,以及炎症相关因子TNF-α、IL-1β、PGD2含量的变化,以期从炎症反应的调节通路之一的COX-2/PGD2/DPs途径,初步探讨HSYA对缺血再灌注脑损伤小鼠的保护作用机制,为HSYA广泛用于临床治疗急性缺血性脑卒中提供新的实验依据。
1 材料与方法
1.1 主要材料和仪器C57BL/6J小鼠,60只,雄性,体质量(18-22)g,SPF级,购于重庆医科大学实验动物中心,许可证号SYXK(渝)2018-0003。HSYA(批号:CAS#78281-02-4)购于宝鸡市辰光生物科技有限公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-tetrazolium chloride solution,TTC)(批号:17779)购于美国Sigma公司;蛋白印迹相关试剂购自江苏碧云天生物技术有限公司;COX-2抗体(批号:GR3267180-1)和DP1抗体(批号:GR79858-8)购于英国abcam公司,DP2抗体(批号:73b0750)购于艾菲公司;COX-2、DP1、DP2引物由上海生物生工公司合成;低温离心机(美国赛默飞公司);湿式转膜仪和垂直电泳槽(北京六一仪器厂);凝胶成像系统、qPCR仪(美国Bio-Rad公司);正置显微镜(日本Nikon公司)。
1.2 方法
1.2.1I/R模型建立 采用线栓法建立小鼠MCAO/R模型[9]。腹腔注射1%的戊巴比妥钠(50 mg·kg-1)麻醉小鼠,将其仰卧固定,在颈部切口,在显微镜下分离出右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),结扎颈总动脉和颈外动脉,颈内动脉用动脉夹夹紧。在颈总动脉远心端插入顶端硅胶包被的线栓,线栓经颈总动脉进入大脑前动脉(anterior cerebral artery,ACA)的起始部,直到线栓黑色标处到达颈内与颈外的分叉处。插栓1 h后,缓慢拔出线栓,再灌注24 h。假手术组除不插栓外,其余处理与模型组相同。造模过程中小鼠体温维持在37 ℃左右。
1.2.2分组与给药 小鼠随机分成3组:假手术组(Sham组)、模型组(Model组)、HSYA处理组(HSYA 20 mg·kg-1组),每组20只小鼠。HSYA溶于生理盐水中备用。小鼠在每次给药前称体质量,尾静脉注射HSYA (20 mg·kg-1)0.2 mL,每天1次,d5给药后立即造模。MCAO/R造模后存活率约为60%(假手术组除外),假手术组造模后为20只,模型组造模后剩余12只,HSYA处理组造模后剩余13只。死亡小鼠尸检发现可能是由于线栓戳到蛛网膜下腔导致脑出血致死。HSYA临床建议成人有效剂量约为2 mg·kg-1,一般情况下每天1次[10]。且已有研究发现颈总动脉注射16 mg·kg-1HSYA可显著改善大鼠局灶性脑缺血再灌注损伤[11]。因此,本实验结合病人临床给药剂量以及已有动物实验的有效剂量,换算到小鼠剂量约为20 mg·kg-1,并且我们预试验发现给药5 d对小鼠脑缺血再灌注损伤有明显预防性保护效果,因此在正式实验中采用剂量为小鼠静脉注射HSYA 20 mg·kg-1。
1.2.3神经功能评分 本实验采用经典的Longa 5分法进行神经功能缺损评定[12]。小鼠正常运动,0分;小鼠的左前肢不能完全伸展,1分;小鼠行走时向对侧转圈,2分;小鼠行走时向对侧倾斜,3分;小鼠不能自发行走并且意识丧失,记为4分;死亡小鼠不纳入统计范围。假手术组、模型组、HSYA处理组每组取12只小鼠进行神经功能评分。神经功能评分后各组小鼠再进行后续实验。
1.2.4脑梗死体积测定 再灌注24 h后,小鼠用1%戊巴比妥钠麻醉后处死,断头取脑,-20 ℃冰箱中速冻全脑30 min,待全脑冻硬后置于冰盒上连续均匀切片5片。将脑切片置于1% TTC染液中,放入37 ℃恒温水浴锅中避光孵育,正反面各15 min。观察脑组织变化,正常组织为红色,缺血组织为白色。拍照后用ImageJ图像分析软件计算每片脑片梗死体积和脑片体积。假手术组、模型组、HSYA处理组每组各4只小鼠。
1.2.5皮层组织病理学观察 再灌注24 h后,小鼠用1%戊巴比妥钠麻醉,打开小鼠胸腔,剪碎右心耳作为灌流液出口,灌注针从左心尖插入,先缓慢推注20 mL磷酸盐缓冲液(phosphate buffered solution,PBS)进行冲洗,再推注10 mL多聚甲醛进行内固定。推注完成后,断头取脑后4%多聚甲醛溶液固定3 d,然后石蜡包埋并切片,进行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色。显微镜下观察小鼠皮层神经元组织病理学变化。假手术组、模型组、HSYA处理组每组各3只小鼠。
1.2.6Western blot法检测皮层蛋白的表达 收集假手术组、模型组、HSYA处理组小鼠右脑皮层组织(梗死区和半暗带混合),每组剩余5只,随机取4只小鼠进行后续Western blot、qRT-PCR、ELISA检测实验。加入蛋白裂解液(RIPA-PMSF 100 ∶1)到装有小鼠组织的匀浆器中,均匀研磨,裂解组织蛋白,等量蛋白用湿法经12% SDS-PAGE进行电泳分离后转移至0.45 μm PVDF膜上,5%胎牛血清蛋白室温封闭2.5 h后,加入一抗COX-2(稀释比例1 ∶1 000)、DP1(稀释比例1 ∶1 000)、DP2(稀释比例1 ∶500)、Tublin(稀释比例1 ∶5 000)。4 ℃孵育过夜。次日再加二抗(1 ∶5 000)孵育1 h,最后显影成像,Image Lab软件对结果图片进行灰度分析。
1.2.7定量实时聚合酶链反应(qRT-PCR)检测mRNA表达 用TRIzol试剂盒提取小鼠右脑皮层总RNA,采用SYBR预混料,在10 μL体系内进行实时定量聚合酶链反应。反应条件:在95 ℃下循环30 s,然后在95 ℃下循环50 s,60 ℃下循环30 s。引物由上海生物生工公司合成。引物序列见Tab 1。

Tab 1 List of primers used in qPCR analysis
1.2.8ELISA检测细胞因子 用ELISA试剂盒(江苏酶标生物科技公司)检测小鼠右脑组织皮层中的PGD2、IL-1β、TNF-α水平。该试剂盒采用双抗体一步夹心法酶联免疫吸附实验。往预先包被捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物3,3′,5,5′-四甲基联苯胺(TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品含量呈正相关。用酶标仪在450 nm波长下测定光密度值,计算样品浓度。

Fig 1 Effects of HSYA on neurological function score and cerebral infarction volume in MCAO/R-treated mice
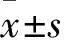
2 结果
2.1 HSYA对缺血再灌注小鼠神经行为学评分和脑梗死体积的影响TTC染色和神经功能评分结果显示,与假手术组相比,模型组梗死体积和术后神经功能评分明显增加。与模型组相比,HSYA预处理可以明显减少MCAO/R小鼠损伤侧脑梗死体积且明显降低了小鼠术后神经功能评分。
2.2 HSYA对缺血再灌注脑损伤小鼠皮层组织病理形态学的影响HE染色结果显示,与假手术组相比,模型组细胞排序紊乱且核固缩明显,核深染且空泡较多,死亡细胞数约占细胞总数90%。与模型组相比,HSYA组的细胞核仁较为清晰,排列整齐,少量细胞死亡,死亡细胞数约占细胞总数30%。
2.3 HSYA对缺血再灌注脑损伤小鼠皮层COX-2、DP1、DP2蛋白和mRNA表达影响从qRT-PCR和Western blot结果可知,与假手术组相比,模型组COX-2、DP1、DP2的mRNA和蛋白表达明显增加。与模型组相比,HSYA 20 mg·kg-1组COX-2、DP1、DP2的mRNA和蛋白表达水平明显降低。

Fig 2 Effects of HSYA on cortical tissue cells of MCAO/R-treated mice (n=3)
2.4 HSYA对缺血再灌注脑损伤小鼠皮层炎症因子水平的影响从ELISA结果得知,与假手术组相比,模型组小鼠皮层炎症因子TNF-α、IL-1β、PGD2水平增加。与模型组相比,HSYA(20 mg·kg-1)预处理后,炎症因子TNF-α、IL-1β、PGD2水平明显下降。
3 讨论
在脑缺血数小时后,促炎因子会作用于血管内皮细胞激发一系列炎症反应,一方面会造成缺血区域血脑屏障通透性改变和神经元的死亡;另一方面会招募中性粒细胞、小胶质细胞等迁移到缺血性病变区,导致创伤后过度炎症反应与继发性脑损伤[13]。因此,抑制由脑缺血性中风引起的炎症反应对于脑卒中治疗至关重要。

Fig 3 Effect of HSYA on expression of COX-2, DP1, DP2 mRNA and protein in cortex of mice subjected to ischemia-reperfusion injury n=4)

Fig 4 Effects of HSYA on IL-1β, PGD2 and TNF-α in cortex of mice subjected to ischemia reperfusion injury n=4)
COX-2是一种诱导酶,在正常组织细胞中一般不表达或者低表达,但在细胞内外多种刺激(如促炎因子、细胞因子、机械性刺激等)下高表达,并在炎症等病理情况下起主导作用。COX-2参与免疫调节、血管功能和突触信号的传递,是神经炎症的重要介质之一[14]。近年来研究发现, HSYA有抗脑缺血再灌注损伤的作用[7]。但是HSYA对CIRI作用的病生机制是否涉及COX-2/PGD2/DPs途径并不清楚。本研究发现,HSYA 20 mg·kg-1可显著降低造模后小鼠皮层组织中COX-2蛋白和mRNA的表达,且COX-2的下游信号通路PGD2/DPs也有明显改变。PGD2是COX-2的下游产物,是脑中富含最丰富的前列腺素。已有研究发现,在脑缺血/再灌注模型中PGD2的有害作用,主要是通过DP2受体发挥作用[15]。DP2是PGD2的特异性受体,类属7次跨膜G蛋白受体,与Gi型G蛋白偶联,抑制cAMP(cyclic adenosine monophosphate)产生而诱导cGMP(cyclic guanosine monophosphate)产生,导致细胞内Ca2+上调,促进炎症因子IL-2、IL-4等释放[16]。与模型组相比,HSYA预处理组中小鼠皮层组织PGD2和DP2表达明显下调,这提示HSYA降低了COX-2、PGD2、DP2的表达从而保护小鼠脑缺血再灌注损伤。DP1类属视紫红质型G蛋白受体,与Gs型G蛋白相偶联,激动后细胞内cAMP含量增加并促进Ca2+释放,能够增强内皮细胞屏障功能以及保护神经元[16]。已有研究发现激活DP1受体可明显改善小鼠脑缺血再灌注损伤[16]。在本实验中,造模后小鼠皮层DP1表达升高,推测这是一种小鼠造模损伤后自身应激反应保护性的升高,但HSYA预处理后小鼠皮层DP1表达降低,可能是由于上游COX-2的表达减少,因此导致下游的产物减少。但总体来说,HSYA降低了COX-2以及其下游通路PGD2/DPs的表达从而减缓了脑缺血再灌注小鼠的炎症反应。
综上所述,HSYA能够降低小鼠脑梗死率,减轻脑细胞病理损伤,改善神经功能,减轻炎症反应。更为重要的是,本研究发现HSYA可降低脑缺血再灌注小鼠皮层组织中COX-2、DP1、DP2mRNA和蛋白的表达,这提示HSYA可能通过COX-2/PGD2/DPs途径保护小鼠脑缺血再灌注损伤。

