MicroRNA-125b对肝星状细胞增殖、凋亡以及胶原蛋白表达的作用
王佳慧,汪 磊,彭 岳,原鲜玲,赵铁建,郑 洋
(广西中医药大学 1.赛恩斯新医药学院医学系,2.基础医学院 生理教研室,广西 南宁 530222)
肝纤维化(hepatic fibrosis,HF)是肝脏对于各种慢性刺激的损伤修复反应,主要以肝星状细胞 (hepatic stellate cells,HSC)受到外界刺激被活化从而产生大量细胞外基质(extracellular matrix,ECM)沉积为主要特点,HF是慢性肝病进程中的关键阶段,进一步发展会导致肝硬化,甚至肝癌,有研究表明恰当有效的治疗措施可以逆转HF[1-3]。
微小RNAs(microRNA,miRNA)属于非编码小核糖核酸中的一类,主要通过与mRNA的3'非翻译区(3'UTR)的结合调控mRNA的表达,从而调控蛋白质的合成,导致其可以参与细胞增殖和分化、细胞死亡、代谢和信号转导等生物过程的调节[4-5]。在HF方面,目前研究认为miRNA主要通过影响HSC的增殖及活化、ECM的产生及降解、信号转导等多个方面参与HF发生、发展过程。如miR-150和miR-194的过表达可抑制LX2细胞增殖、下调CollagenI和α-SMA表达[6];miR-125b在多种肝病中表达失调,在非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)小鼠模型中,miR-125b通过调控RhoA通路,从而导致HF的发生[7]。miR-125b与HF关系密切,但其具体的调控机制尚不明确,故本次研究使用细胞转染方法,希冀阐明miR-125b对HSC表型的影响,为HF的防治以及药物的研发提供新的标靶。
1 材料
1.1 仪器低速离心机(广州吉迪仪器有限公司,JIDI-20D)、水平摇床(上海达姆实业有限公司,T200)、酶标仪(北京普朗新技术有限公司,mullSKANMK3)、倒置显微镜(OLYMPUS,IX51)、流式细胞仪(BECKMAN,CytoFLEX)、RT-PCR仪(ABI,QuantStudio 6)。
1.2 细胞株大鼠肝星状细胞(HSC-T6)Procell 货号:CL-2317。
1.3 试剂MTT(BIOSHARP,0793)、 CollagenⅠ(220KD)(Abcam,ab260043)、CollagenⅢ(138KD)(abcam,ab34710)、β-actin(42KD)(Servicebio, GB12001)细胞凋亡检测试剂盒(南京凯基生物,KGA1026)、 Lip2000(赛墨飞,12566014)、miR-125b相关片段(上海吉玛制药技术有限公司)。
2 方法
2.1 细胞培养将HSC-T6进行复苏后接种于无菌培养瓶中,加入含10% FBS和1%高糖DMEM培养液,将其置于37 ℃、5% CO2的培养箱中培养,选用生长旺盛的对数期细胞进行实验。
2.2 细胞转染取对数生长期的HSC-T6进行转染,将其分为空白组、过表达组(mimics)、过表达对照组(mimics NC)、抑制组(inhibitor)、抑制对照组(inhibitor NC),除空白组外,各组按如下操作进行转染:将各组用无血清培养基配成miRNA-DMEM 终浓度为20 nmol·L-1,为了增加转染的成功率加入Lipofec-tamineTM2000试剂,将其配制为浓度5 mL·L-1,而后加入相应的孔中每孔1 mL。转染结束后将转染液替换成完全培养基用于后续实验。
2.3 MTT检测各组细胞增殖取对数生长期的HSC-T6细胞,胰酶消化后,用培养基调整细胞密度到7×107个·L-1,接入96孔板,对细胞进行转染,方法见上述,每组3个复孔,于37 ℃,5%CO2饱和湿度条件下培养3个时间段,每孔加入10 μL MTT,37 ℃培养4 h,吸出培养基,酶标仪测定吸光值。
2.4 细胞流式检测各组细胞凋亡取对数期的HSC-T6细胞,胰酶消化后,用培养基调整细胞密度到7×107个·L-1,接入96孔板,对细胞转染后继续培养48 h,用PBS将细胞洗2次,1 500 r·min-1,3 min;按照凋亡试剂盒操作说明进行,然后检测。
2.5 RT-PCR检测miR-125b、CollagenⅠ、Collagen Ⅲ表达将各组细胞按“2.2”处理后,在细胞中加入1 mL TRIzol试剂,提取总的RNA。弃上清,加入无RNase的75%乙醇1 mL,离心5 min。弃上清,干燥RNA沉淀5-10 min,将沉淀溶于20 μL DEPC水中。用逆转录试剂盒得到cDNA,用RT-PCR检测相应分子的表达,miR-125b、U6、CollagenⅠ、CollagenⅢ和β-actin上下游引物及长度见Tab 1。

Tab 1 Primer sequences
2.6 免疫印迹检测CollagenⅠ、Collagen Ⅲ表达将各组细胞按转染操作处理后,提取细胞总蛋白,使用BCA法测定各组细胞蛋白浓度,然后进行SDS-PAGE电泳、转膜,用TBST液室温摇床封闭2 h,然后加入Collagen Ⅰ、Collagen Ⅲ、β-actin 抗体4 ℃过夜,使PVDF膜浸泡于二抗孵育液中,通过ECL显色系统显色,用BandScan分析胶片灰度值。
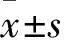
3 结果
3.1 转染后miR-125b的含量被提高或者下降当细胞转染结束后,用RT-PCR检测转染各组miR-125b的表达量,结果如Fig 1所示。转染miR-125b mimics及inhibitor后,过表达组miR-125b的表达明显高于mimics NC组和空白对照组(P<0.05),而inhibitor组则没有检测到miR-125b表达,说明该组没有miR-125b表达,进一步表明inhibitor具有很好的抑制作用,结果表明转染操作顺利完成,将miR-125b模拟物或抑制物导入细胞后,成功的调控了细胞miR-125b的表达,构建了成功的细胞模型。

Fig 1 Expression of miR-125b in each group
3.2 miR-125b可以调控HSC的增殖当细胞转染结束后测定3个时间段的细胞增殖率(24、48、72 h),以此判断miR-125b对HSC细胞增殖的作用,结果表明miR-125b mimics 组与miR-125b mimics NC组相比,3个时间段均对细胞的增殖有抑制作用,但是只有72 h的抑制作用,差异具有统计学意义(P<0.05);miR-125b inhibitor组与inhibitor NC组相比,3个时间段均对细胞的增殖有促进作用,但只在72 h差异有统计学意义(P<0.05),实验结果表明miR-125b可以调控HSC增殖,详细情况见Fig 2。

Fig 2 HSC proliferation after miR-125b transfection n=3)
3.3 miR-125b可以调控HSC细胞的凋亡当各组细胞转染结束后,按照凋亡试剂盒上的操作方法检测各组HSC细胞的凋亡情况。转染48 h后,各组的凋亡率情况分别为,mimics组:( 8.23 ± 0.56 )%,mimics NC组:( 6.15± 0.26)%,inhibitor组:(2.54 ± 0.51)%,inhibitor NC组:(5.23± 0.56)% 。转染48 h后,mimics组凋亡率提高,具有促进HSC凋亡的作用;inhibitor 组凋亡率下降,具有抑制HSC凋亡的作用,并且差异均具有统计学意义(P<0.05),实验结果表明miR-125b可以调控HSC凋亡,见Fig 3。

Fig 3 Effect of miR-125b on HSC apoptosis n=3)
3.4 miR-125b可以抑制Collagen Ⅰ、Collagen Ⅲ mRNA的表达当细胞转染结束48 h后,miR-125b mimics 组具有抑制Collagen Ⅰ、Collagen Ⅲ mRNA表达的作用;miR-125b inhibitor组具有促进Collagen Ⅰ、Collagen Ⅲ mRNA表达的作用,与阴性对照组比较,差异均具有统计学意义(P<0.05),见Fig 4。实验结果表明,miR-125b抑制了胶原的生成,减少了细胞外基质的沉积的作用,具有确切的抗肝纤维化的作用。

Fig 4 Effect of miR-125b on Collagen Ⅰ and Collagen Ⅲ mRNA expression n=3)
3.5 miR-125b可以抑制Collagen Ⅰ、Collagen Ⅲ 蛋白的表达当细胞转染结束48 h后,过表达组具有抑制Collagen Ⅰ、Collagen Ⅲ 表达的作用;抑制组具有促进Collagen Ⅰ、Collagen Ⅲ表达的作用,与阴性对照组相比,差异均具有统计学意义(P<0.05),见Fig 5。实验结果表明miR-125b表达量的增加,具有抗胶原生成的作用。

Fig 5 Effect of miR-125b on expression of Collagen Ⅰ and Collagen Ⅲ n=3)
4 讨论
HF被认为是由于各种慢性肝损伤而产生的一种伤口愈合性病理应答过程,以ECM的积累为特征[8]。HSC的激活被认为是HF的重要关键步骤[9-10]。目前关于HF的防治工作已经取得了长足的发展,其主要的工作关注点是HSC的增殖和凋亡[11-12]。miRNA是一类内源性表达的18-25个核苷酸长的非编码调节RNA分子。研究发现miRNA在细胞的多种生理过程中具有重要的调控作用。此外,研究还发现miRNA可与编码蛋白质的信使RNA(mRNA)的3'-非翻译区(UTR)碱基配对,从而调控mRNA的表达[13]。miRNA作为基因表达的调节分子,可以调控HSC的生理功能来参与HF的发生发展过程[14-15]。
本实验采用转染的方式来探究miR-125b对HSC表型的影响。因为转染miRNA存在单双链的问题,所以需要选择其相应的阴性序列进行比较对照。研究结果显示,当在HSC细胞中miR-125b的表达量增加时,HSC合成的 Collagen Ⅰ、Collagen Ⅲ的表达会下降,并且HSC细胞的增殖会受到抑制以及凋亡率会增加,差异具有统计学意义;而当HSC细胞中miR-125b的表达量下降时,HSC合成的 Collagen Ⅰ、Collagen Ⅲ的表达会增加,并且HSC细胞的增殖会受到促进以及凋亡率会被抑制,差异具有统计学意义。ECM的过度沉积是HF主要的病理特征,而Collagen Ⅰ和Collagen Ⅲ是ECM的主要组成部分,而miR-125b可以减少Collagen Ⅰ和Collagen Ⅲ的表达;抑制HSC增殖促进其凋亡是防治HF的有效策略,而miR-125b可以抑制HSC增殖促进HSC凋亡,综合以上表明miR-125b具有确切的抗肝纤维化的作用。有研究发现,miR-125b可以靶向作用于Hedgehog信号通路上重要的转录因子Gli3减少其表达,从而抑制HSC的激活。miR-125b还可以通过作用于RhoA通路,调控HSC迁移以及影响其收缩,抑制HSC的激活过程。本次研究表明,miR-125b通过抑制HSC增殖,促进其凋亡,减少细胞外基质Collagen Ⅰ、Collagen Ⅲ的产生,呈现抗肝纤维化的作用,但是具体的分子机制引起我们课题组进一步深入思考,例如miR-125b通过什么途径调控HSC,miR-125b是否通过调控肝内炎症反应抑或是调控肝内血管新生反应参与HSC生理过程,miR-125b呈现的抗肝纤维化的作用是否存在多靶点的调控作用。课题组进一步希望通过二代测序进一步探究miR-125b上游信号分子lncRNA和cricRNA的差异表达,以及通过蛋白组学寻找肝纤维化中显著表达差异的蛋白质,从而阐明miR-125b分子调控肝纤维化的完整信号网络。综上,miR-125b可以成为防治肝纤维化研究工作新的靶位点。

