NLRP6炎症小体与肠道微生态研究进展
聂 源, 朱 萱
(南昌大学 第一附属医院消化科, 江西 南昌 330006)
肠道内含有数量巨大且结构复杂的肠道微生物并参与机体多种重要生命功能。肠道微生态主要由各种微生物、代谢物和肠道黏膜屏障组成,机体内外环境的改变,可导致肠道微生态失衡、肠道代谢功能的变化和相关疾病的发展。NLRP6炎症小体(NOD-like receptor protein 6 inflammasome)是NLR(NOD-like receptor)免疫受体家族的重要成员之一,在机体炎症反应应答以及肠道微生态维持方面起着至关重要的作用。NLRP6炎症小体表达的变化常导致肠道微生态失调,疾病的易感性发生变化。本文将NLRP6炎症小体对肠道微生态的调控作用进行综述,以期基于NLRP6炎症小体和肠道微生态调控机制为肠道微生态失衡引起的相关疾病治疗提供参考。
1 NLRP6炎症小体分布与激活
1.1 NLRP6炎症小体结构与分布
NLRP6炎症小体主要由胞浆内模式识别受体(Pattern recognition receptors, PRRs)、 细胞凋亡相关的斑点样蛋白(Apoptosis-associated speck-like protein containing a caspase-recruitment domain, ASC) 和半胱氨酸天冬氨酸蛋白酶 (Caspase)组成[1]。NLRP6炎症小体活化主要包括合成前体物质、信号激活等两个过程,分别是NLRP6炎症小体、Pro-Caspase-1、 Pro-白介素(IL)-1β和Pro-IL-18等的合成。NLRP6 炎症小体激活、Pro-Caspase-1剪切成为成熟的Caspase-1, 进而将Pro-IL-1β、Pro-IL-18剪切为IL-1β、IL-18并分泌至胞外[2]。合成前体物质的信号常由Toll样受体(TLRs)或炎症因子以NF-κB或丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)途径诱导生成。激活信号常由病原体相关分子模式或危险相关分子模式方式激活[3]。除了上述经典作用途径外,NLRP6炎症小体还促进细胞焦亡(Pyroptosis)或Caspase-11激活的相关细胞因子释放[4]。IL-1β是经典促炎症因子,在早期固有免疫相关细胞炎性活化中具有关键作用,如单核-巨噬细胞、Th17细胞,也可增强多种炎症因子和黏附因子的表达和功能[5]。促炎症因子IL-18又称促γ干扰素诱导因子,在单核-巨噬细胞、肠上皮细胞、粒细胞等均有表达,不仅可诱导γ干扰素产生,还可与其他炎症因子协同,增强体内T细胞以及NK 细胞的活性[6]。
NLRP6炎症小体在人和鼠的肝脏、肠道、肾脏等器官均有表达。与其他炎症小体分布不同,NLPR6炎症小体主要分布在肠上皮组织,尤其是肠上皮细胞(IECs)、分泌黏液的杯状细胞、肌成纤维细胞。在人体中,NLRP6炎症小体主要表达于十二指肠、空肠和回肠,而在小鼠中,NLRP6炎症小体在小肠和大肠中都有一定表达[7]。NLRP6炎症小体高表达于富含微生物部位,如小肠。
1.2 NLRP6炎症小体激活
一项肠道代谢组学的研究结果显示,胆汁酸(Bile acids, BAs)衍生物牛磺酸可作为NLRP6炎症小体和IL-18产生的正调控因子,精胺和组胺作为NLRP6炎症小体激活的负调控因子[8]。在婴幼儿时期,肠道微生物包括变形杆菌、放线杆菌、纤毛虫等定殖微生物可诱导依赖NLRP6炎症小体的抗菌反应[9]。原生动物也激活NLRP6炎症小体以诱导上皮IL-18的分泌。除微生物激活机制外,应激诱导的促肾上腺皮质激素释放激素抑制大鼠肠道NLRP6炎症小体的表达[10]。综上,许多机体内外危险信号与NLRP6炎症小体激活相关。
2 NLRP6炎症小体与肠道微生物相互作用
2.1 NLRP6 炎症小体负向调控肠道微生物
NLRP6炎症小体是细胞内固有免疫的感受器,与许多下游信号关联,在肠道微生物调节中起着至关重要的作用。Anand等[11]报道,NLRP6-/-小鼠对李斯特菌、伤寒沙门氏菌和大肠埃希菌的感染具有较弱的抵抗力,NLRP6-/-小鼠的血液循环中单核细胞和中性粒细胞的数量增多,NLRP6-/-小鼠可增强Toll样受体相关的MAPK和经典NF-κB信号途径相关的炎症因子表达。研究结果很好地揭示了NLRP6作为炎症信号的负调控因子,并证明了NLRP6炎症小体在革兰阳性和阴性致病菌清除方面的作用。Elinav等发现,NLRP6-/-、ASC-/-、IL-18-/-小鼠与野生型(WT)小鼠粪便样本微生物组成明显不同,表现为较高的普雷沃氏菌和TM7菌,且更容易罹患葡聚糖硫酸钠(DSS)诱导的结肠炎。将NLRP6-/-、ASC-/-、IL-18-/-小鼠与WT小鼠同笼饲养4周,WT小鼠对结肠炎的易感性也增加,且证明NLRP6炎症小体对肠道微生物调控是通过IL-18介导的,趋化因子CCL5表达上调,促使免疫细胞于肠道局部募集,从而导致自发性肠道炎症,使用广谱抗生素使肠道微生物耗竭可扭转这一现象[12]。给予NLRP6炎症小体的抑制剂也有类似的结果。microRNA-650(miR-650)作为NLRP6基因的上游调控因子,在溃疡性结肠炎患者和DSS诱导的结肠炎小鼠模型的肠道黏膜中高表达[13]。体外实验,miR-650可抑制NLRP6基因的表达,导致CACO-2细胞和IEC6细胞凋亡增加,DSS诱导的小鼠死亡率增加[13]。Tomuschat等[14]报道,NLRP6炎症小体在先天性巨结肠患者中表达下调,NLRP6表达减少可能导致先天性巨结肠患者结肠肠道微生物的改变,从而增加先天性巨结肠的易感性。国内的研究人员报道,植物乳杆菌可以诱导NLRP6炎症小体的活化,进而抑制 IL-1β和IL-18的分泌,缓解DSS诱导的结肠炎[15]。Radulovic等[16]报道,将膳食黄酮处理的DSS模型小鼠与未经膳食黄酮处理DSS模型小鼠同笼饲养,可减轻未经膳食黄酮处理DSS模型小鼠的结肠炎症状,肠道微生物组成发生了明显变化,且该保护作用与NLRP6表达量相关。上述结果表明NLRP6炎症小体可重塑肠道微生物组成。
2.2 NLRP6 炎症小体正向调控肠道微生物
由于NLRP6炎症小体与肠道微生物关联信号通路很多,NLRP6炎症小体在调控肠道微生物的角色,也有相反的报道。Seregin 等[17]报道,NLRP6-/-小鼠存在微生物失调,嗜黏蛋白阿克曼氏菌增加,且是DSS 诱导结肠炎致病基础。相较于无菌WT小鼠,无菌的NLRP6-/-小鼠经自然再繁殖后早3周内出现了微生物失调[8]。Hara等报道,李斯特菌的脂磷壁酸与NLRP6结合,并通过ASC激活NLRP6炎症小体,释放caspase-1/11。与WT小鼠相比,NLRP6-/-、Caspase-1-/-小鼠存活率提高,证实NLRP6炎症小体在系统革兰阳性病原体感染过程中是有害的[18]。接受IL-18,但没有接受IL-1β时,宿主防御被取消,表明NLRP6炎症小体通过产生IL-18加剧了李斯特菌的感染。此外,作者将NLRP6-/-小鼠与WT小鼠同笼饲养4周,以确定在NLRP6-/-小鼠中观察到的保护作用是否依赖于肠道微生物,结果显示NLRP6/Caspase-11信号可独立与微生物调控李斯特菌感染[18]。在肠易激综合征模型中小鼠NLRP6表达明显下降,并且发现丁酸梭菌可以对NLRP6表达抑制,对肠易激综合征内脏超敏反应有抑制作用[19]。去泛素化可抑制NLRP6-ASC的活性,抑制IL-18的成熟,其中去泛素酶CYLD起关键作用。小鼠去泛素酶CYLD缺乏导致活化的IL-18水平升高而且感染轮状柠檬酸杆菌后结肠炎症状加重,同时证明活化的IL-18水平与去泛素酶CYLD表达呈明显负相关[20]。研究结论不一致可能与许多因素相关。目前绝大部分研究是基于动物模型,动物饲养环境和不同的诱导方式可能会影响结论,因此,制定统一的动物实验标准和规范动物饲养条件尤显重要。
2.3 肠道微生物代谢产物对NLRP6炎症小体的激活作用
肠道微生物在参与机体物质能量代谢过程中,可大量产生小分子代谢产物,在宿主免疫与肠道微生物信息传递中起重要作用。Li等[21]报道,肠道微生物失调是高果糖饮食诱导C57BL/6J小鼠海马神经炎症的关键因素,可能是通过损伤肠上皮屏障来介导的,并且证明短链脂肪酸可刺激肠道NLRP6炎症小体表达。改善肠上皮黏膜损伤,对于小鼠海马神经炎症和神经损伤具有一定保护作用,佐证了补充短链脂肪酸或食用膳食纤维可降低神经退行性疾病的风险。Wang等[22]报道,肥胖大鼠肠道NLRP6水平降低,经胃旁路术可使NLRP6炎症小体表达上调,恢复异常的肠通透性,且赖于肠道微生物相关的代谢物,如牛磺酸和组胺。胃旁路术后牛磺酸水平升高,对NLRP6炎症小体表达有正反馈作用。综上,肠道微生物代谢产物对NLRP6炎症小体也具有激活作用。
2.4 肠道微生物菌群直接对NLRP6炎症小体的激活作用
肠道内存在各种结构功能复杂、数量庞大的微生物菌群。在正常生理情况下,肠道微生物与肠道宿主免疫维持免疫耐受状态。然而,在病理情况下,肠道内致病菌可激活机体免疫状态,而NLRP6炎症小体在其过程中起识别作用。在一项基于脂多糖和干扰素γ作为刺激肠胶质细胞建立的肠道炎症模型进行的双歧杆菌和脆弱拟杆菌调控肠胶质细胞的研究中,发现双歧杆菌对肠胶质细胞的NLRP6的表达有双重效应,而脆弱拟杆菌对NLRP6具有抑制作用。双歧杆菌和脆弱拟杆菌通过影响NLRP6、IL-18、IL-1β和Caspase-1等表达,从而抑制或促进肠道炎症[23]。在避水应激模型(WAS)中,小鼠血清CRH水平明显升高,通过下丘脑-垂体-肾上腺素轴(HPA)导致肠道微生物改变或导致NLRP6表达下调,间接使肠道微生物发生改变。将小鼠与经WAS诱导的小鼠同笼饲养,发现同笼饲养的普通小鼠也可发展为明显的肠道炎症,肠道通透性显著增加,然而具体是何种致病微生物并未进行相应研究[24]。国内有研究报道,长双歧杆菌可通过NLRP6炎症小体下调IL-18等下游分子表达,从而降低肠易激综合征内脏高敏感性和肠道炎症[25]。
2.5 NLRP6炎症小体是改善肠道微生物失衡的靶点
NLRP6炎症小体是肠道微生物刺激识别的感受器,进而引起下游系列反应。Bao等[26]报道,温和灸显著增加了肠易激综合征大鼠肠道内乳酸杆菌、双歧杆菌和普拉梭菌的相对含量,但降低了大肠埃希菌的相对含量;温和灸促进NLRP6、ASC、Caspase-1表达,乳酸杆菌、双歧杆菌、普拉梭菌的相对丰度与结肠中NLRP6、ASC、Caspase-1的RNA和蛋白表达相关。感染白色念珠菌和热灭活的白色念珠菌的CACO-2细胞和未处理组相比,NLRP3、NLRP6、ASC、β防御素-2、β防御素-3、紧密连接蛋白的表达明显下调,白色念珠菌可以抑制NLRP3和NLRP6通路,并通过减少抗菌肽和紧密连接蛋白的产生抑制肠黏膜屏障功能[27]。在避水应激模型(WAS)中,小鼠血清CRH水平明显升高,并通过下丘脑-垂体-肾上腺素轴导致肠道微生物改变,或导致NLRP6表达下调,间接使肠道微生物发生改变。将小鼠与经WAS诱导小鼠同笼饲养,发现同笼饲养的普通小鼠也可发展为明显的肠道炎症,肠道通透性显著增加,然而具体是何种致病微生物未进行相应研究[24]。YU等[28]通过对短肠综合征(Short Bowel Syndrome, SBS)鼠和乳脂球膜处理的SBS鼠进行比较,发现乳脂球膜处理的SBS鼠组肠道通透性降低,杯状细胞增多,MCU1阳性细胞比例上升,且NLRP6和IL-18的表达高于SBS组,而IL-1β和Caspase-1的表达低于SBS组。国内研究报道,在溃疡性结肠炎患者中,健脾清热活血方可负向调节NLRP6表达,进而抑制Caspase-1活化,下调IL-18表达,发挥治疗溃疡性结肠炎效用[29]。同样,清肠化湿方能够调节肠道NLRP6炎症小体及相关炎症因子,紧密连接蛋白表达水平,减轻肠道炎症反应,缓解肠黏膜损伤,且表现为明显的剂量依赖关系[30]。总之,靶向NLRP3炎症小体可改善肠道微生态失衡,进而改善症状。
2.6 肠道微生物通过肠-肝循环对NLRP6炎症小体的激活作用
肠道微生物可穿过薄弱的肠道屏障进入肠肝循环中,通过NLRP6炎症小体识别,进而引起肝脏炎症改变,促进非酒精性脂肪性肝病(NAFLD)或代谢性疾病的进展。Henao-Mejia等报道,在蛋氨酸胆碱缺乏饮食喂养4周的小鼠中,AS-/-、Caspase-/-的非酒精性脂肪性肝炎(NASH)症状严重程度比WT小鼠重,并且与IL-18表达下调相关,而不是IL-1β。与WT小鼠相比,和NLRP6-/-、ASC-/-、Caspase-/-、IL-18-/-小鼠同笼饲养的WT小鼠NAFLD的严重程度明显上升,易感性增加是通过NLRP6炎症小体-IL-18信号轴调节的微生物群差异介导的。小鼠肠道菌群改变的代谢产物通过门静脉移位激活了肝脏中的TLR4和TLR9,肿瘤坏死因子-α(TNF-α)的分泌增加,导致NAFLD症状[31]。革兰阴性细菌外膜的主要成分脂多糖直接与NLRP6炎症小体结合,诱导NLRP6炎症小体构象变化和二聚化,在ATP的刺激下,NLRP6同源二聚体进一步组装成线性分子,从而招募下游信号分子[32]。枸杞是中药常见药物,其含有的枸杞多糖具有改善MCD饮食诱导NASH小鼠模型的肝损伤,且与NLRP6、ASC、Caspase等表达下调有关,提示了NLRP6炎症小体通路参与枸杞多糖改善NASH模型的肝损伤。肝脏疾病进展与肠道微生物密切相关,而肠-肝循环中NLRP6炎症小体扮演着重要作用[33]。
3 NLRP6炎症小体与肠道黏膜屏障相互作用
3.1 NLRP6炎症小体与肠黏膜物理屏障相互调控作用
肠道黏膜屏障主要由物理屏障、化学屏障和免疫屏障组成。肠黏膜屏障以物理屏障最为重要,主要由内外两层黏液层、肠上皮细胞和紧密连接构成。两层黏液层可防止共生微生物与结肠上皮直接接触,外层黏膜被杯状细胞分泌的粘蛋白(Mucoprotein, Muc) 2覆盖,是微生物群的主要栖息地[34]。外层粘蛋白的破坏会导致隐窝形态异常,可能导致浸润性腺癌和结直肠癌[34]。NLRP6炎症小体激活有助于肠道黏液层的形成,保护肠上皮免受病原体的入侵和物理损伤。Wlodarska等[35]报道,与WT小鼠相比,NLRP6-/-小鼠表现为自噬减少,杯状细胞增生减少,肠道黏液释放障碍,且鼠柠檬酸杆菌在上皮隐窝中渗透得更深。在NLRP6-/-、ASC-/-、Caspase-1-/-小鼠未形成肠道黏液屏障,而在IL-18-/-小鼠肠道黏液层正常形成,研究结果表明肠道黏液屏障生成与NLRP6炎症小体相关,与NLRP6炎症小体下游信号无关,而且前哨杯状细胞被NLRP6炎症小体以钙依赖的方式激活时会分泌黏液[35]。Volk等[36]报道,拟杆菌属S24-7和Alderrutzia属具有不同的内黏液层功能,发现NLRP6炎症小体在前哨杯状细胞介导的粘蛋白分泌中对TLR1、TLR2、TLR4配体的反应是必不可少的。前哨杯状细胞可以内吞微生物代谢产物,如LPS、脂质A、P3CSK4和鞭毛蛋白,而不是内吞LTA或细菌DNA,进而诱导细胞内活性氧产生(ROS),ROS进一步激活NLRP6炎症小体,调节杯状细胞分泌Muc。研究表明,NLRP6炎症小体调节杯状细胞功能和内外黏液层的形成只与最佳的TLR激动剂相关,而与基线稳态水平无关[37]。
3.2 NLRP6炎症小体与肠黏膜化学屏障相互调控作用
化学屏障主要包括抗菌肽(antimicrobial peptides, AMPs)、粘蛋白等化学物质。NLRP6炎症小体通过促进IECs合成抗菌肽,形成保护性化学屏障,其中血管生成素-4、血小板凝集素-1和抵抗素样分子β起着维持肠道微生态平衡的作用[8]。肠道微生物区系首先激活NLRP6炎症小体,诱导IECs合成IL-18,从而促进抗菌肽的自分泌或依赖于IL-22的合成。由于上述功能轴的存在,NLRP6-/-小鼠不能合成保护性抗菌肽,导致肠道菌群失调,表现为普雷沃氏菌、TM7菌属增加,乳杆菌或厚壁菌门减少[38]。Levy等[8]报道微生物衍生的代谢物,如牛磺酸,通过激活NLRP6炎症小体诱导IL-18介导的抗菌肽分泌。清肠化湿方以清热化湿为主,广泛用于控制活动性溃疡性结肠炎患者症状,并通过调节NLRP6炎症因子及相关下游细胞因子、紧密连接蛋白表达水平,从而减轻肠道炎症反应,缓解肠黏膜损伤[39]。Huber等报道,NLRP6炎症小体导致IL-18依赖的IL-22bp下调,从而促进肠上皮细胞增殖。NLRP6对DSS诱导结肠炎的作用还可能与肠道内单核细胞有关。将WT小鼠肠道内Ly6Chigh的单核细胞转移至NLRP6-/-小鼠,NLRP6-/-小鼠的肠黏膜屏障功能明显改善,表现为抗菌肽分泌增加。综上,NLRP6炎症小体通过调节杯状细胞功能与上皮细胞分泌抗菌肽从而与肠道黏膜屏障完整性相关[40]。
4 展 望
NLRP6炎症小体及其关联的信号通路在维持肠道黏膜屏障完整性、微生物组成方面至关重要,与肠道微生态以及疾病发生发展密切相关 (图1)[41]。NLRP6炎症小体通过调控肠道微生物组成,进而导致疾病易感性的结论不一致,可能与NLRP6炎症小体具体关联信号通路不一致相关。目前,有关NLRP6炎症小体在肠道微生态相互作用的研究、实验多基于NLRP6-/-小鼠进行,规范动物饲养环境和制备多种不同诱导方式的模型小鼠也很重要。NLRP6 炎症小体作为炎症反应的核心识别环节,可识别肠道微生物紊乱、代谢物等变化,进而反馈调控肠道微生态变化。研究NLRP6 炎症小体与肠道微生态相互作用,不仅增加对两者的认识,还可为基于两者相互机制靶向治疗微生态失衡相关疾病提供研究新方向。但基于NLRP6 炎症小体组装或激活的靶向药物较少,能够实现应用临床的更少,需增加靶向NLRP6的药物学研究。总之,目前NLRP6 炎症小体与肠道微生态相互调控研究,一方面应控制实验的干扰因素,优化规范实验条件,以便得到更加可靠的结论,另一方面需加强相关的转化医学的研究,更好地造福人类。
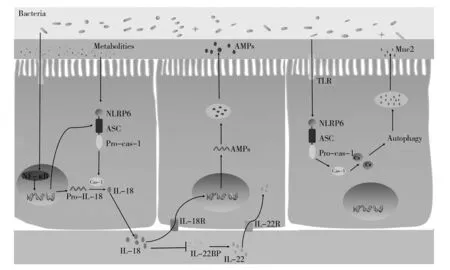
图1 NLRP6炎症小体与肠道微生态调控机制Fig.1 The regulation mechanism of NLRP6 inflammasome and intestinal microecology

