水分活度对洋葱伯克霍尔德菌群生长的影响
王杠杠, 王似锦, 马仕洪
(中国食品药品检定研究院,北京 100050)
洋葱伯克霍尔德菌群(Burkholderiacepaciacomplex,Bcc)是包括洋葱伯克霍尔德菌(Burkholderiacepacia)在内的一系列表型类似且16S rRNA高度同源的革兰阴性菌的总称[1-3],临床上是引起囊性纤维化(cystic fibrosis)患者、慢性肉芽肿(chronic granulomatous)患者及免疫力低下患者严重感染的条件致病菌[4]。因其复杂且可变的基因组,Bcc可适应低氧环境,实现呼吸道上皮黏附,且对临床多种抗生素存在耐药性[5]。一旦感染,患者生命安全会受到巨大威胁。Bcc广泛存在于制药环境尤其是水系统中,近年来,屡有发生药品及卫生用品因污染该菌而召回的案例[6]。目前,Bcc已经被美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)明确为不可接受微生物(objectionable microorganism),FDA提醒生产企业应注意非无菌水基药品Bcc污染的风险[7]。目前针对Bcc的控制手段和研究方向主要集中在检出、鉴定及耐药性方面,倾向于对原辅料、中间产品和成品的控制及感染后的治疗,而对于处方控制的关注较少[8-11]。长期以来,水分含量是反映药品质量安全和稳定的重要参数,然而对于控制药品微生物污染,水分活度(water activity,Aw)比水分含量更有意义。Aw是相同温度下产品水蒸气压与纯水蒸气压的比值。1957年,澳大利亚科学家Scott[12]提出,微生物存在最低生长Aw,低于该限值微生物将不能生长。降低Aw会导致微生物生长延滞期延长,代谢活性降低,生长速率减慢[13]。因此,Aw测量和控制可作为微生物风险控制的关键环节[14]。美国药典<1112>章节中指出,测量非无菌药品Aw有助于优化处方以提高防腐体系的抑菌效果,降低处方(尤其是液体、膏、乳液和霜)受微生物污染的风险[8]。本实验室曾在样品中分离了一株洋葱伯克霍尔德菌,其能够在该样品的防腐体系中存活和生长[15],这意味着Bcc对于含有抑菌剂的非无菌药品依然存在风险。研究Aw与Bcc生长间的关系可能为此类产品优化处方、提高抑菌效果、降低污染风险提供重要依据。本研究选取2个Bcc的典型种作为研究对象,其中洋葱伯克霍尔德菌(Burkholderiacepacia)2株,新洋葱伯克霍尔德菌(Burkholderiacenocepacia)1株,分别在氯化钠、甘油、蔗糖调节的不同Aw条件下培养,通过全自动生长曲线分析仪绘制生长曲线,探究不同调节剂作用下Bcc最低生长Aw及Aw对其生长曲线的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 洋葱伯克霍尔德菌(Burkholderiacepacia)2株:CICC10857(=ATCC25416)、201708
01-1(环境分离菌株);新洋葱伯克霍尔德菌(Burkholderiacenocepacia)1株:20180108-11(环境分离菌株)。
1.1.2 试剂与培养基 氯化钠(sigma,美国);甘油(国药,上海);蔗糖(北京糖业,北京);胰酪大豆胨液体培养基TSB(BD,美国)。
1.1.3 仪器与设备 全自动生长曲线分析仪(Bioscreen,芬兰);Aqualab 4TE Duo水分活度测定仪(Decagon Devices,美国);BJ-2202S电子天平(Sartorius,德国);生物安全柜(Nuaire,美国);复合型低温恒温培养箱(Yamato,日本)。
1.2 方法
1.2.1 培养基制备 以氯化钠、甘油、蔗糖为调节剂,配制Aw不同的TSB,灭菌后测量25 ℃时Aw。实验用3组TSB灭菌后Aw实测值见表1。
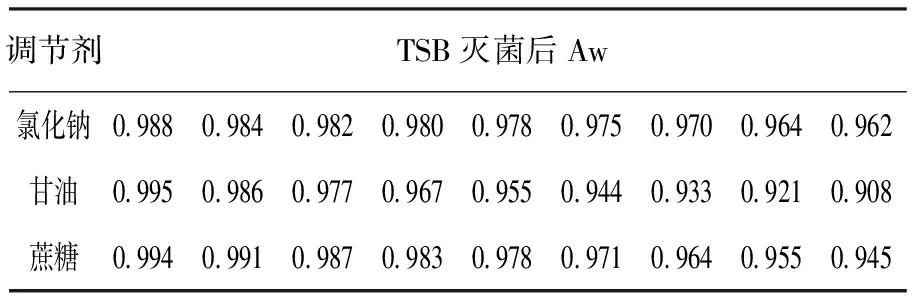
表1 实验用TSB灭菌后水分活度
1.2.2 菌悬液制备与接种 将冻干菌种接种至10 mL TSB中,32.5 ℃培养18 h,稀释成105cfu/mL的菌悬液。将不同Aw梯度的TSB与菌悬液加入全自动生长曲线分析仪配套蜂窝板中,每孔加入培养基300 μL、菌悬液10 μL(接入菌量约为103cfu/孔),每种培养基2个平行孔。
1.2.3 全自动生长曲线分析 将蜂窝板放入全自动生长曲线分析仪,设置仪器培养温度为32.5 ℃,每隔30 min测量1次吸光度(OD600),连续测量72 h。测量结束后导出数据,以OD600对时间作图,绘制生长曲线。
2 结果与分析
2.1 Bcc最低生长水分活度
图1为3株Bcc分别在氯化钠、甘油、蔗糖调节的不同Aw条件下的生长曲线。初始OD600在0.06~0.10,OD600在72 h内始终小于0.11则认为该条件下菌株不生长。当Aw≥0.990时,3组Bcc生长曲线无显著差异,生长曲线呈S型,培养10 h左右OD600开始明显增加,至30 h左右达到峰值。氯化钠组Aw<0.978时3株Bcc均不生长;甘油组Aw<0.944时,3株Bcc均不生长,Aw=0.944时仅20170801-1生长,其余2株不生长;蔗糖组,Aw<0.971时3株Bcc均不生长,Aw=0.971时仅20180108-11生长,其余2株不生长。
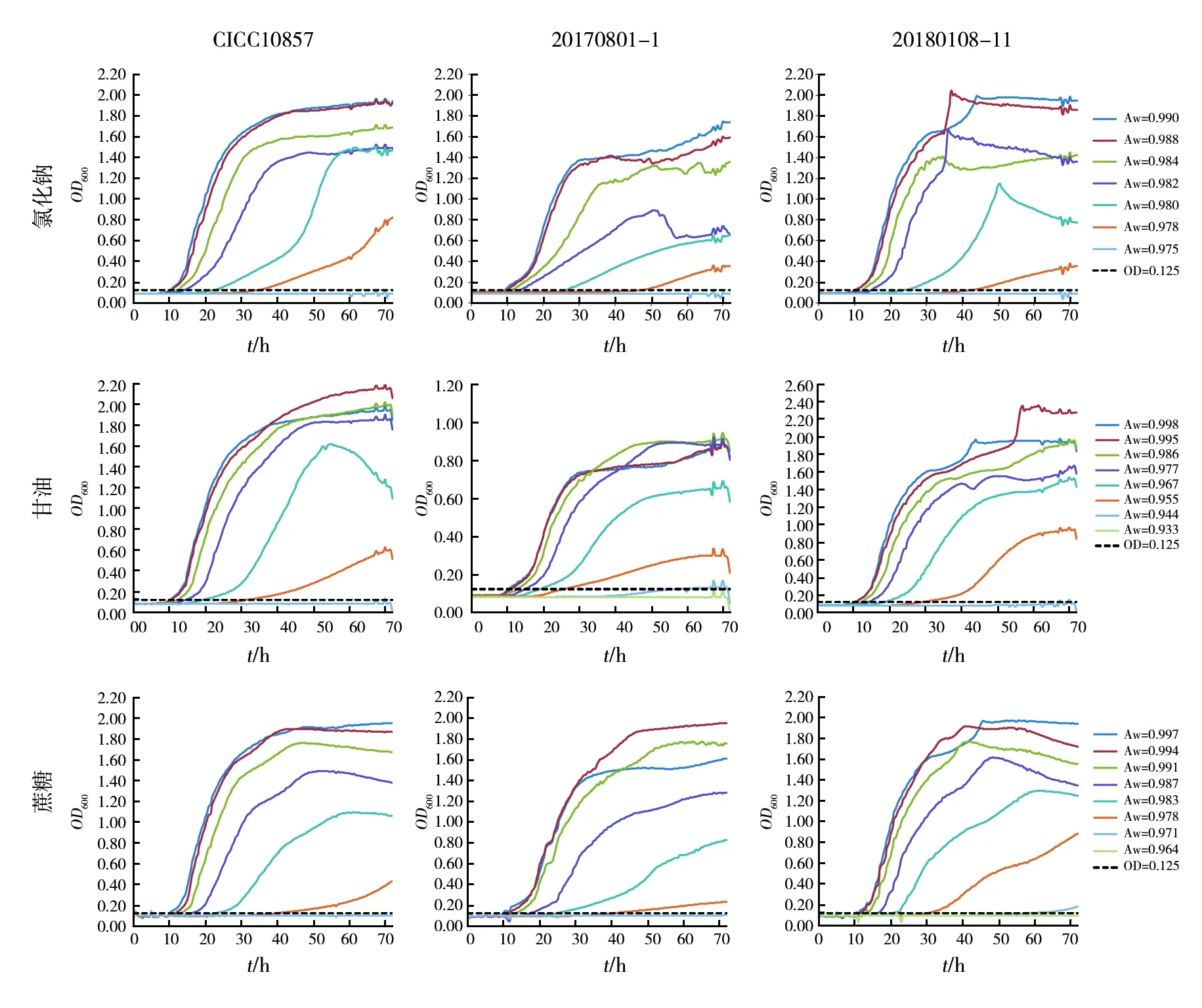
图1 不同水分活度(Aw)条件下Bcc生长曲线Fig.1 Growth curve of Bcc under different Aw
由此得到不同调节剂作用下3株Bcc最低生长Aw(表2)。氯化钠组最低生长Aw为0.978,甘油组、蔗糖组3株菌结果略有差异,甘油组最低生长Aw为0.944~0.955,蔗糖组最低生长Aw为0.971~0.978。与氯化钠和蔗糖相比,在甘油作为调节剂时,Bcc可在更低Aw条件下生长。
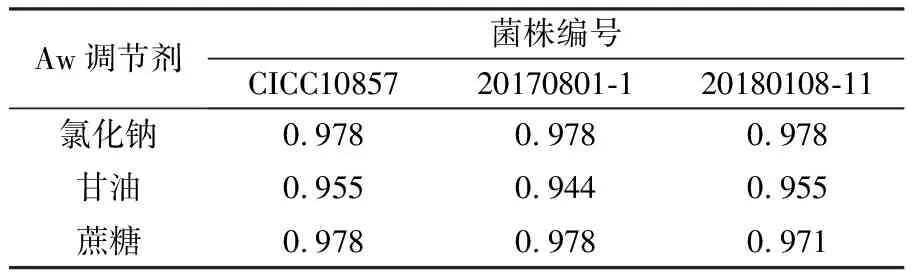
表2 不同调节剂作用下Bcc最低生长水分活度(Aw)
2.2 水分活度对Bcc生长曲线的影响
在高于最低生长Aw条件下,Bcc生长曲线基本呈S形,OD600随培养时间延长不同程度增加。以可测量时间(time to detection, TTD)、曲线峰值、曲线斜率作为指标评价Aw对Bcc生长曲线的影响。
所有生长曲线中,甘油组20170801-1在Aw=0.944时终点OD值最低,约为0.14。取0.11~0.14的中间值0.125作为设定值,OD600达到该设定值的时间即为该条件下TTD,TTD与延滞期及生长速率相关[16]。Aw对TTD的影响见图2。氯化钠组TTD在9~48 h,甘油组TTD在9~56 h,蔗糖组TTD在9~57 h。随Aw降低TTD延长,且在接近最低生长Aw时,TTD延长程度增加,3株Bcc之间TTD差异更明显。不同调节剂作用下无明显差异。
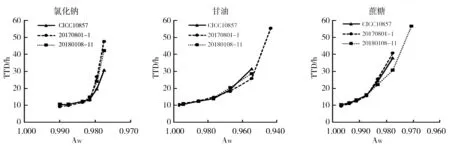
图2 水分活度(Aw)对 Bcc生长曲线TTD的影响Fig.2 Effect of Aw on growth curve TTD of Bcc
曲线峰值一定程度上反映了平台期菌液浓度。Aw对曲线峰值的影响见图3。氯化钠组峰值在0.36~2.04,甘油组峰值在0.17~2.36,蔗糖组峰值在0.19~1.98。3株Bcc曲线峰值差异明显,20170801-1峰值明显小于其余2株,但Aw对其峰值影响规律基本一致:在Aw≥0.988时,曲线峰值随Aw降低变化不明显,部分曲线峰值小幅度上升;在Aw接近最低生长Aw时,曲线峰值随Aw降低明显下降。不同调节剂作用下无明显差异,且均在Aw≈0.990时峰值达到最大值。
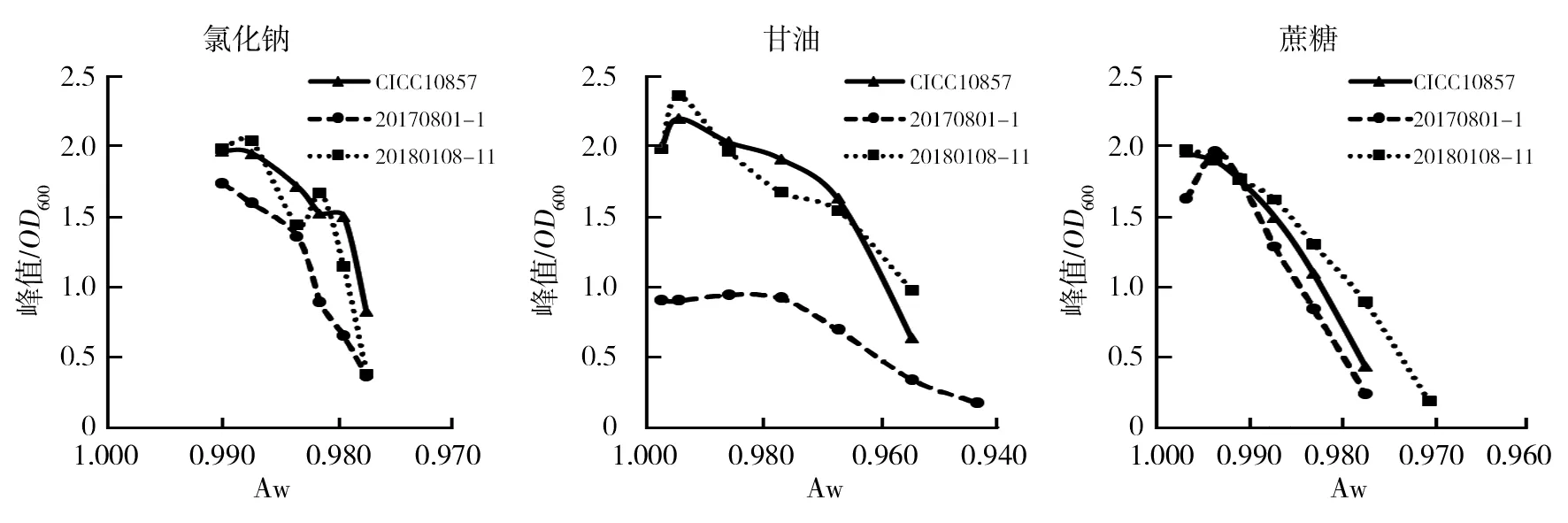
图3 水分活度(Aw)对Bcc生长曲线峰值的影响Fig.3 Effect of Aw on growth curve peak value of Bcc
取生长曲线S形中段(接近直线上升部分)进行线性拟合,所得斜率即为生长曲线斜率,该斜率反映了该阶段比生长速率。Aw对曲线斜率的影响见图4。氯化钠组斜率为0.011 4~0.125 3,甘油组斜率0.002 4~0.124 8,蔗糖组斜率0.003 5~0.138 3。 3株Bcc曲线斜率差异明显,20170801-1斜率明显小于其余2株,但Aw对其斜率影响规律基本一致:在Aw≥0.988时,曲线斜率随Aw降低变化不明显,部分曲线峰值小幅度上升;但随Aw继续降低,曲线峰值随之明显下降。不同调节剂作用下无明显差异,且均在Aw≈0.990时峰值达到最大值。

图4 水分活度(Aw)对Bcc生长曲线斜率的影响Fig.4 Effect of Aw on growth curve slope of Bcc
3 讨 论
本研究表明,培养温度为32.5 ℃时,Bcc在不同调节剂作用下最低生长Aw为0.978(氯化钠)、0.944~0.955(甘油)、0.971~0.978(蔗糖),菌株之间有微小差异。本实验室在之前的研究中,通过定性实验表明菌株20170801-1在30~35 ℃最低生长Aw为0.974~0.978(氯化钠)、0.944(甘油)、0.962~0.965(蔗糖)[17],与本研究结果基本一致,且与假单胞菌属的最低生长Aw接近[8]。
对3种调节剂所得结果进行对比发现,氯化钠和蔗糖作用下Bcc最低生长Aw接近,与之相比甘油作用下则更低。这与文献报道相一致:在讨论Aw作用时,氯化钠与蔗糖对大多数细菌的影响是相似的,但甘油对于革兰阳性球菌抑制作用更强,而对于革兰阳性杆菌及革兰阴性杆菌抑制作用更弱[18]。
由于OD600生长曲线与传统平板计数所得生长曲线有所区别,在细胞浓度较低时,OD600无法及时反映细胞数量变化[16]。因此本研究无法直接探讨Aw对Bcc生长延滞期、生长速率等经典参数的影响,而是选择TTD、曲线峰值、曲线斜率作为间接指标。随Aw降低,Bcc生长曲线TTD延长,曲线峰值及斜率整体呈下降趋势。研究结果可以一定程度上估计Aw对Bcc生长曲线在延滞期、生长速率的影响,但仍有局限性,后续可通过建立Bcc生长模型进一步研究。明确Aw对Bcc生长的影响,有助于非无菌药品生产企业在药品处方设计、生产等阶段正确评估Bcc污染的风险,为建立有效控制措施提供依据。